BIJLAGE I
SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Xospata 40 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke filmomhulde tablet bevat 40 mg gilteritinib (als fumaraat).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet (tablet).
Ronde, lichtgele filmomhulde tablet van ongeveer 7.1 mm, bedrukt met het bedrijfslogo en ‘235’ aan dezelfde zijde.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
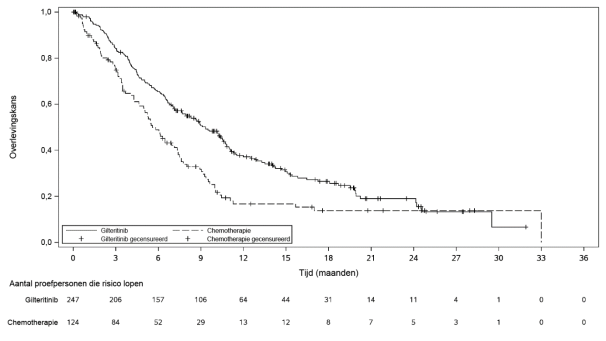
Xospata is geïndiceerd als monotherapie voor de behandeling van volwassen patiënten die gerecidiveerde of refractaire acute myeloïde leukemie (AML) met een FLT3-mutatie hebben (zie rubriek 4.2 en 5.1).
4.2 Dosering en wijze van toediening
De behandeling met Xospata moet gestart en begeleid worden door een arts die ervaring heeft met het gebruik van geneesmiddelen tegen kanker.
Voorafgaand aan het gebruik van gilteritinib dient bij patiënten met gerecidiveerde of refractaire AML door middel van een gevalideerde test een FMS-achtige tyrosinekinase 3 (FLT3) interne tandemduplicatie (ITD) of tyrosinekinasedomein (TKD) mutatie te zijn bevestigd.
Met Xospata kan opnieuw worden gestart nadat patiënten een hematopoïetische stamceltransplantatie (HSCT) hebben ondergaan (zie tabel 1).
Dosering
De aanbevolen startdosis is eenmaal daags 120 mg gilteritinib (drie 40 mg tabletten).
De bloedchemie, met inbegrip van creatinefosfokinase, moet beoordeeld worden voordat de behandeling wordt gestart, op dag 15 en maandelijks gedurende de behandeling (zie rubriek 4.4).
Een elektrocardiogram (ecg) moet gemaakt worden voordat de behandeling met gilteritinib wordt gestart, op dag 8 en 15 van cyclus 1 en voorafgaand aan de start van de erop volgende drie maanden van behandeling (zie rubriek 4.4 en 4.8).
Aan vrouwen die zwanger kunnen worden, dient te worden geadviseerd om in de zeven dagen voorafgaand aan het begin van de behandeling met gilteritinib een zwangerschapstest uit te voeren (zie rubriek 4.4 en 4.6).
De behandeling moet voortgezet worden totdat de patiënt geen klinisch voordeel van Xospata meer ondervindt of totdat de toxiciteit onaanvaardbaar wordt. Omdat de klinisch response vertraagd kan optreden, moet de voortzetting van de behandeling tot 6 maanden met de voorgeschreven dosis overwogen worden om zo tijd te geven voor een klinische respons.
Bij het uitblijven van een respons [patiënt heeft samengestelde complete remissie (CRc) niet bereikt] na 4 weken van behandeling kan de dosis worden verhoogd tot eenmaal daags 200 mg (vijf tabletten van 40 mg), indien getolereerd of klinisch gerechtvaardigd.
Dosisaanpassingen
Tabel 1: Aanbevelingen voor onderbreking, dosisverlaging en staking van het gebruik van Xospata bij patiënten met gerecidiveerde of refractaire AML
Criteria | Toediening van Xospata |
Differentiatiesyndroom |
|
Posterieure reversibele encefalopathiesyndroom |
|
QTcF-interval > 500 msec |
|
QTcF-interval verhoogd met > 30 msec op ecg op dag 8 van cyclus 1 |
|
Pancreatitis |
|
Overige toxiciteit van graad 3a of hoger die verband zou houden met de behandeling. |
|
Geplande HSCT |
|
- Graad 1 is licht, graad 2 is matig ernstig, graad 3 is ernstig, graad 4 is levensbedreigend.
- De dagelijkse dosis kan van 120 mg naar 80 mg of van 200 mg naar 120 mg worden verlaagd.
- CRc wordt gedefinieerd als het remissiepercentage van alle CR (zie rubriek 5.1 voor de definitie van CR), CRp [bereikte CR behalve onvolledig bloedplaatjesherstel (< 100 x 109/l)] en CRi (alle criteria voor CR bereikt behalve voor onvolledig hematologisch herstel met resterende neutropenie < 1 x 109/l met of zonder volledig bloedplaatjesherstel).
Ouderen
Er is geen dosisaanpassing nodig bij patiënten ≥ 65 jaar (zie rubriek 5.2).
Leverfunctiestoornis
Er is geen dosisaanpassing nodig bij patiënten met een lichte (Child-Pugh-klasse A) of matig ernstige (Child-Pugh-klasse B) leverfunctiestoornis. Xospata wordt niet aanbevolen bij patiënten met een ernstige (Child-Pugh-klasse C) leverfunctiestoornis, aangezien de veiligheid en werkzaamheid niet zijn geëvalueerd bij deze groep patiënten (zie rubriek 5.2).
Nierfunctiestoornis
Er is geen dosisaanpassing nodig bij patiënten met een lichte, matige of ernstige nierfunctiestoornis (zie rubriek 4.4 en 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van Xospata bij kinderen in de leeftijd tot 18 jaar zijn nog niet vastgesteld.
Er zijn geen gegevens beschikbaar. Als gevolg van in vitro waargenomen binding aan 5HT2B (zie rubriek 4.5) kunnen er gevolgen zijn voor de hartontwikkeling bij patiënten jonger dan 6 maanden.
Wijze van toediening
Xospata is bestemd voor oraal gebruik.
De tabletten kunnen met of zonder voedsel worden ingenomen. Ze moeten in hun geheel ingeslikt worden met water en mogen niet worden gebroken of fijngemaakt.
Xospata moet elke dag op ongeveer hetzelfde tijdstip ingenomen worden. Indien een dosis is gemist of niet op het gebruikelijke tijdstip is ingenomen, moet de dosis nog diezelfde dag zo snel mogelijk worden ingenomen en moeten de patiënten vanaf de volgende dag het normale schema weer aanhouden. Bij braken na inname moeten de patiënten niet opnieuw een dosis innemen, maar de volgende dag het normale schema hervatten.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof(fen) of voor een van de in rubriek 6.1 vermelde hulpstof(fen).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De veiligheid van Xospata werd geëvalueerd bij 319 patiënten met gerecidiveerde of refractaire AML die ten minste één dosis van 120 mg gilteritinib hebben ontvangen.
De meest voorkomende bijwerkingen van gilteritinib waren alanine-aminotransferase (ALAT) verhoogd (82,1%), aspartaataminotransferase (ASAT) verhoogd (80,6%), alkalische fosfatase in bloed verhoogd (68,7%), creatinefosfokinase in bloed verhoogd (53,9%), diarree (35,1%), vermoeidheid (30,4%), nausea (29,8%), constipatie (28,2%), hoesten (28,2%), perifeer oedeem (24,1%), dyspneu (24,1%), duizeligheid (20,4%), hypotensie (17,2%), pijn in extremiteit (14,7%), asthenie (13,8%), artralgie (12,5%) en myalgie (12,5%).
De meest voorkomende ernstige bijwerkingen waren acute nierschade (6,6%), diarree (4,7%), ALAT verhoogd (4,1%), dyspneu (3,4%), ASAT verhoogd (3,1%) en hypotensie (2,8%). Andere klinisch significante ernstige bijwerkingen waren differentiatiesyndroom (2,2%), elektrocardiogram QT verlengd (0,9%) en posterieure reversibele encefalopathiesyndroom (0,6%).
Lijst van bijwerkingen in tabelvorm
De bijwerkingen die zijn waargenomen tijdens klinische studies, worden hieronder per MedDRA systeem/orgaanklasse en frequentiecategorie aangegeven. De frequentiecategorieën zijn als volgt gedefinieerd: zeer vaak (≥1/10); vaak (≥1/100, <1/10); soms (≥1/1.000, <1/100); zelden (≥1/10.000, <1/1.000); zeer zelden (<1/10.000); niet bekend (kan met de beschikbare gegevens niet worden bepaald). In elke frequentiegroep worden de bijwerkingen weergegeven in afnemende volgorde van ernst.
Tabel 2: Bijwerkingen
MedDRA systeem/orgaanklasse | Alle graden | Graad ≥ 3 | Frequentiecategorie |
Immuunsysteemaandoeningen | |||
Anafylactische reactie | 1,3 | 1,3 | Vaak |
Zenuwstelselaandoeningen | |||
Duizeligheid | 20,4 | 0,3 | Zeer vaak |
Posterieure reversibele encefalopathiesyndroom | 0,6 | 0,6 | Soms |
Hartaandoeningen | |||
Elektrocardiogram QT verlengd | 8,8 | 2,5 | Vaak |
Pericardeffusie | 4,1 | 0,9 | Vaak |
Pericarditis | 1,6 | 0 | Vaak |
Hartfalen | 1,3 | 1,3 | Vaak |
Bloedvataandoeningen | |||
Hypotensie | 17,2 | 7,2 | Zeer vaak |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | |||
Hoesten | 28,2 | 0,3 | Zeer vaak |
Dyspneu | 24,1 | 4,4 | Zeer vaak |
Differentiatiesyndroom | 3,4 | 2,2 | Vaak |
Maagdarmstelselaandoeningen | |||
Diarree | 35,1 | 4,1 | Zeer vaak |
Nausea | 29,8 | 1,9 | Zeer vaak |
Constipatie | 28,2 | 0,6 | Zeer vaak |
Lever- en galaandoeningen | |||
Alanine-aminotransferase verhoogd* | 82,1 | 12,9 | Zeer vaak |
Aspartaataminotransferase verhoogd* | 80,6 | 10,3 | Zeer vaak |
Skeletspierstelsel- en bindweefselaandoeningen | |||
Creatinefosfokinase in bloed verhoogd* | 53,9 | 6,3 | Zeer vaak |
Alkalische fosfatase in bloed verhoogd* | 68,7 | 1,6 | Zeer vaak |
Pijn in extremiteit | 14,7 | 0,6 | Zeer vaak |
Artralgie | 12,5 | 1,3 | Zeer vaak |
Myalgie | 12,5 | 0,3 | Zeer vaak |
Skeletspierstelselpijn | 4,1 | 0,3 | Vaak |
Nier- en urinewegaandoeningen | |||
Acuut nierletsel | 6,6 | 2,2 | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | |||
Vermoeidheid | 30,4 | 3,1 | Zeer vaak |
Perifeer oedeem | 24,1 | 0,3 | Zeer vaak |
Asthenie | 13,8 | 2,5 | Zeer vaak |
Malaise | 4,4 | 0 | Vaak |
* Frequentie is gebaseerd op centrale laboratoriumwaarden.
Beschrijving van geselecteerde bijwerkingen
Differentiatiesyndroom
Van de 319 patiënten die in de klinische studies met Xospata werden behandeld, kregen er 11 (3%) het differentiatiesyndroom. Het differentiatiesyndroom gaat gepaard met een snelle proliferatie en differentiatie van myeloïde cellen en kan levensbedreigend of fataal zijn indien het niet wordt behandeld. Symptomen en klinische bevindingen van het differentiatiesyndroom bij patiënten die met Xospata werden behandeld, waren koorts, dyspneu, pleurale effusie, pericardeffusie, longoedeem, hypotensie, snelle gewichtstoename, perifeer oedeem, rash (huiduitslag) en nierfunctiestoornis. Sommige patiënten hadden bijkomend acute febriele neutrofiele dermatose. Het differentiatiesyndroom deed zich al na een dag en tot 82 dagen voor nadat met Xospata was begonnen en werd zowel met als zonder bijkomende leukocytose waargenomen. Van de 11 patiënten die het differentiatiesyndroom kregen, herstelden er 9 (82%) na behandeling of na onderbreking van de behandeling met Xospata. Zie voor aanbevelingen bij vermoeden van het differentiatiesyndroom rubriek 4.2 en 4.4.
PRES
Van de 319 patiënten die in de klinische studies met Xospata werden behandeld, kreeg 0,6% het posterieure reversibele encefalopathiesyndroom (PRES). PRES is een zeldzame, reversibele neurologische aandoening, waarbij de symptomen zich snel kunnen ontwikkelen, waaronder insult, hoofdpijn, verwarring, visuele en neurologische stoornissen, al dan niet gepaard gaand met hypertensie. De symptomen verdwenen na stopzetting van de behandeling (zie rubriek 4.2 en 4.4).
QT-verlenging
Van de 317 patiënten die in klinische studies werden behandeld met Xospata met een dosis van 120 mg met een QTc-waarde na baseline, hadden 4 patiënten (1%) een QTcF > 500 msec. Voorts hadden, ongeacht de dosis, 12 patiënten (2,3%) met gerecidiveerde/refractaire AML een maximaal QTcF-interval > 500 msec na baseline (zie rubriek 4.2, 4.4 en 5.1).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem.
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Astellas Pharma Europe B.V.
Sylviusweg 62
2333 BE Leiden
Nederland
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/19/1399/001
10. DATUM VAN HERZIENING VAN DE TEKST 06/2024.
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
1
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4128898 | XOSPATA 40MG FILMOMH TABL 84 X 40MG | L01EX13 | - | € 15688 | Ja | - | - |