SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET DIERGENEESMIDDEL
Metrovis 250 mg tabletten voor honden en katten
4. KLINISCHE GEGEVENS
4.3 Contra-indicaties
Niet gebruiken bij leveraandoeningen.
Niet gebruiken bij overgevoeligheid voor het werkzame bestanddeel of één van de hulpstoffen.
4.8 Interactie met andere geneesmiddelen en andere vormen van interactie
Metronidazol kan remmend werken op de afbraak van andere geneesmiddelen in de lever, zoals fenytoïne, ciclosporine en warfarine.
Cimetidine kan de metabolisering van metronidazol in de lever verlagen wat kan leiden tot verhoogde serumconcentraties van metronidazol.
Fenobarbital kan de metabolisering van metronidazol in de lever verhogen wat kan leiden tot verlaagde serumconcentraties van metronidazol.
4.9 Dosering en toedieningsweg
Voor oraal gebruik.
De aanbevolen dosering is 50 mg metronidazol per kg lichaamsgewicht per dag, gedurende 5 - 7 dagen. De dagelijkse dosis mag worden verdeeld over twee gelijke doses, voor tweemaal daagse toediening (d.w.z. tweemaal daags 25 mg/kg/lichaamsgewicht).
Teneinde een juiste dosering te berekenen, dient het lichaamsgewicht zo nauwkeurig mogelijk te worden bepaald. De volgende tabel is bedoeld als richtlijn voor het toedienen van het diergeneesmiddel in de aanbevolen dosering van ofwel 50 mg per kg lichaamsgewicht, eenmaal daags toegediend, ofwel, bij voorkeur, 25 mg per kg lichaamsgewicht, tweemaal daags toegediend.
| Aantal tabletten | ||
Tweemaal daags | Eenmaal daags | ||
Lichaamsgewicht (kg) | Ochtend | Avond | |
5 kg | ½ | ½ | 1 |
7,5 kg | ¾ | ¾ | 1 ½ |
10 kg | 1 | 1 | 2 |
12,5 kg | 1 ¼ | 1 ¼ | 2 ½ |
15 kg | 1 ½ | 1 ½ | 3 |
17,5 kg | 1 ¾ | 1 ¾ | 3 ½ |
20 kg | 2 | 2 | 4 |
![]()
![]()
![]()
![]() = ¼ tablet = ½ tablet = ¾ tablet = 1 tablet
= ¼ tablet = ½ tablet = ¾ tablet = 1 tablet
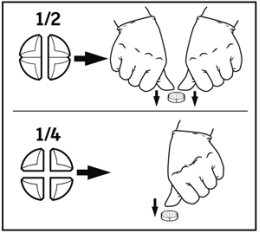
De tabletten kunnen in 2 of 4 gelijke delen worden verdeeld om een nauwkeurige dosering te garanderen. Plaats de tablet op een plat oppervlak, met de breuklijnen omhoog en de bolle (ronde) zijde naar beneden.
Halve tablet: druk met uw duimen op beide zijden van de tablet.
Kwart tablet: druk met uw duim op het midden van de tablet.
4.11 Wachttijd(en)
Niet van toepassing.