SAMENVATTING VAN DE PRODUCTKENMERKEN
1. BENAMING VAN HET DIERGENEESMIDDEL
Prednicure 25 mg tabletten voor honden
4. KLINISCHE GEGEVENS
4.2 Indicaties voor gebruik met specificatie van de doeldiersoort(en)
Voor de symptomatische behandeling of als adjuvante behandeling van immuungemedieerde inflammatoire aandoeningen bij honden.
4.3 Contra-indicaties
Niet gebruiken bij dieren met:
- Virale, mycotische of parasitaire infecties die niet onder controle zijn met een geschikte behandeling
- Diabetes mellitus
- Hyperadrenocorticisme
- Osteoporose
- Hartfalen
- Nierinsufficiëntie
- Corneale ulceratie
- Gastro-intestinale ulceratie
- Glaucoom
Niet gelijktijdig gebruiken met levende-verzwakte vaccins
Niet gebruiken bij overgevoeligheid voor het werkzame bestanddeel, andere corticosteroïden, of voor (één van) de hulpstoffen.
Zie ook rubrieken 4.7 en 4.8.
4.8 Interactie met andere geneesmiddelen en andere vormen van interactie
Fenytoïne, barbituraten, efedrine en rifampicine kunnen de metabole klaring van corticosteroïden versnellen, wat kan leiden tot lagere bloedwaarden en een verminderd fysiologisch effect.
Het gelijktijdige gebruik van dit diergeneesmiddel met niet-steroïdale ontstekingsremmers kunnen gastro-intestinale ulceratie verergeren.
Toediening van prednisolon kan hypokaliëmie veroorzaken en daarmee het risico op toxiciteit van hartglycosiden verhogen. Het risico op hypokaliëmie kan worden verhoogd als prednisolon samen met kaliumuitscheidende diuretica wordt toegediend.
Er moeten voorzorgsmaatregelen worden genomen bij gecombineerd gebruik met insuline.
De behandeling met het diergeneesmiddel kan de werkzaamheid van vaccinatie beïnvloeden. Bij vaccineren met levende-verzwakte vaccins moet voor of na de behandeling een interval van twee weken in acht worden genomen.
4.9 Dosering en toedieningsweg
Oraal gebruik.
De dosis en de totale duur van de behandeling, binnen het toegestane doseringsbereik, wordt door de dierenarts per individueel geval bepaald, afhankelijk van de ernst van de symptomen.
Startdosis: 0,5 - 2,0 mg per kg lichaamsgewicht per dag.
Toediening gedurende één tot drie weken bij de bovengenoemde doseringen kan nodig zijn. Voor behandeling op langere termijn: wanneer na een periode van dagelijkse dosering het gewenste effect is bereikt, moet de dosis worden verlaagd tot de laagste effectieve dosis is bereikt. De verlaging van de dosis moet gebeuren door middel van alternerende dag therapie en/of door de dosis te halveren met tussenpozen van 5-7 dagen totdat de laagste effectieve dosis is bereikt.
Honden moeten 's ochtends worden gedoseerd om samen te vallen met de endogene cortisolpiek.
De volgende tabel is bedoeld als richtlijn voor de dosering van het diergeneesmiddel bij de minimale dosis van 0,5 mg/kg lichaamsgewicht en de maximale dosis van 2 mg/kg lichaamsgewicht:
| Aantal tabletten | |
Prednicure 25 mg voor honden | ||
Lichaamsgewicht (kg) | Minimumdosis | Maximumdosis |
> 10 - 12,5 kg | ¼ | 1 |
>12,5 - 25 kg | ½ | 1-2 |
>25 - 37,5 kg | ¾ | 2-3 |
> 37,5 - 50 kg | 1 | 3-4 |
> 50 - 62,5 kg | 1 ¼ | 4-5 |
> 62,5 - 75 kg | 1 ½ | 5-6 |
![]() = ¼ Tablet
= ¼ Tablet ![]() = ½ Tablet
= ½ Tablet ![]() = ¾ Tablet
= ¾ Tablet ![]() = 1 Tablet
= 1 Tablet
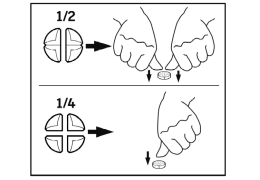
De tabletten kunnen worden verdeeld in 2 of 4 gelijke delen om een nauwkeuriger dosering mogelijk te maken.
4.11 Wachttijd(en)
Niet van toepassing.