SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Hemlibra 30 mg/ml oplossing voor injectie
Hemlibra 150 mg/ml oplossing voor injectie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Hemlibra 30 mg/ml oplossing voor injectie
Elke ml oplossing bevat 30 mg emicizumab*
Elke injectieflacon van 0,4 ml bevat 12 mg emicizumab in een concentratie van 30 mg/ml.
Elke injectieflacon van 1 ml bevat 30 mg emicizumab in een concentratie van 30 mg/ml.
Hemlibra 150 mg/ml oplossing voor injectie
Elke ml oplossing bevat 150 mg emicizumab*
Elke injectieflacon van 0,4 ml bevat 60 mg emicizumab in een concentratie van 150 mg/ml.
Elke injectieflacon van 0,7 ml bevat 105 mg emicizumab in een concentratie van 150 mg/ml.
Elke injectieflacon van 1 ml bevat 150 mg emicizumab in een concentratie van 150 mg/ml.
Elke injectieflacon van 2 ml bevat 300 mg emicizumab in een concentratie van 150 mg/ml.
* Emicizumab is een gehumaniseerd monoklonaal gemodificeerd immunoglobuline G4 (IgG4) antilichaam geproduceerd door middel van DNA-recombinatietechniek in ovariumcellen van de Chinese hamster (CHO).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie.
Kleurloze tot lichtgele oplossing.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Hemlibra is geïndiceerd voor de routineprofylaxe van bloedingen bij patiënten met hemofilie A (aangeboren factor VIII-deficiëntie):
● met remmers tegen factor VIII
● zonder remmers tegen factor VIII met:
- ernstige ziekte (FVIII < 1%)
- matig-ernstige (moderate) ziekte (FVIII ≥ 1% en ≤ 5%) met een ernstig fenotype voor bloedingen.
Hemlibra kan bij alle leeftijdsgroepen worden gebruikt.
4.2 Dosering en wijze van toediening
Behandeling dient ingesteld te worden onder toezicht van een arts met ervaring in de behandeling van hemofilie en/of bloedingsstoornissen.
Dosering
Behandeling (inclusief routineprofylaxe) met bypassing agents (zoals geactiveerd protrombinecomplex-concentraat [aPCC] en geactiveerd recombinant humaan FVII [rFVIIa]) moet de dag voor aanvang van de behandeling met Hemlibra worden stopgezet (zie rubriek 4.4).
Profylaxe met factor VIII (FVIII) kan worden voortgezet gedurende de eerste 7 dagen van de behandeling met Hemlibra.
De aanbevolen dosis is 3 mg/kg eenmaal per week gedurende de eerste 4 weken (oplaaddosis), gevolgd door een onderhoudsdosis vanaf week 5 van 1,5 mg/kg eenmaal per week, 3 mg/kg elke twee weken of 6 mg/kg elke vier weken, in alle gevallen toegediend als subcutane injectie.
Het oplaaddoseringsschema blijft hetzelfde, ongeacht het onderhoudsdoseringsschema.
Om therapietrouw te bevorderen moet het onderhoudsdoseringsschema worden bepaald op basis van de voorkeur van de arts en de patiënt/verzorger.
De patiëntdosis (in mg) en het volume (in ml) moeten als volgt worden berekend:
● Oplaaddosis (3 mg/kg) eenmaal per week gedurende de eerste 4 weken:
Lichaamsgewicht patiënt (kg) x dosis (3 mg/kg) = totale hoeveelheid (mg) toe te dienen emicizumab
● Gevolgd door een onderhoudsdosis vanaf week 5 van 1,5 mg/kg eenmaal per week, 3 mg/kg elke twee weken of 6 mg/kg elke vier weken vanaf week 5:
Lichaamsgewicht patiënt (kg) x dosis (1,5 of 3 of 6 mg/kg) = totale hoeveelheid (mg) toe te dienen emicizumab
Het totale subcutaan toe te dienen volume Hemlibra wordt als volgt berekend:
Totale toe te dienen hoeveelheid (mg) emicizumab ÷ concentratie injectieflacon (mg/ml) = totaal te injecteren volume (ml) Hemlibra.
Bij het bereiden van het totale toe te dienen volume mogen de verschillende concentraties Hemlibra (30 mg/ml en 150 mg/ml) niet in dezelfde injectiespuit worden gecombineerd.
Per injectie mag niet meer dan 2 ml worden toegediend.
Voorbeelden:
Lichaamsgewicht patiënt 16 kg, bij een onderhoudsdosering van 1,5 mg/kg eenmaal per week:
● Voorbeeld oplaaddosis (eerste 4 weken): 16 kg x 3 mg/kg = 48 mg emicizumab is nodig voor de oplaaddosis.
● Om het toe te dienen volume te berekenen, wordt de berekende dosis 48 mg gedeeld door 150 mg/ml: 48 mg emicizumab ÷ 150 mg/ml = 0,32 ml van de 150 mg/ml concentratie van Hemlibra moet worden geïnjecteerd.
● Kies uit de beschikbare injectieflaconsterktes de passende doses en volumes.
● Voorbeeld onderhoudsdosis (vanaf week 5): 16 kg x 1,5 mg/kg = 24 mg emicizumab nodig voor de onderhoudsdosis.
● Om het toe te dienen volume te berekenen, wordt de berekende dosis 24 mg gedeeld door 30 mg/ml: 24 mg emicizumab ÷ 30 mg/ml = 0,8 ml van de 30 mg/ml concentratie van Hemlibra moet eenmaal per week worden geïnjecteerd.
● Kies uit de beschikbare injectieflaconsterktes de passende doses en volumes.
Lichaamsgewicht patiënt 40 kg, bij een onderhoudsdosering van 3 mg/kg elke 2 weken:
● Voorbeeld oplaaddosis (eerste 4 weken): 40 kg x 3 mg/kg = 120 mg emicizumab is nodig voor de oplaaddosis.
● Om het toe te dienen volume te berekenen, wordt de berekende dosis 120 mg gedeeld door 150 mg/ml: 120 mg emicizumab ÷ 150 mg/ml = 0,8 ml van de 150 mg/ml concentratie van Hemlibra moet worden geïnjecteerd.
● Kies uit de beschikbare injectieflaconsterktes de passende doses en volumes.
● Voorbeeld onderhoudsdosis (vanaf week 5): 40 kg x 3 mg/kg = 120 mg emicizumab nodig voor de onderhoudsdosis.
● Om het toe te dienen volume te berekenen, wordt de berekende dosis 120 mg gedeeld door 150 mg/ml: 120 mg emicizumab ÷ 150 mg/ml = 0,8 ml van de 150 mg/ml concentratie van Hemlibra moet elke 2 weken worden geïnjecteerd.
● Kies uit de beschikbare injectieflaconsterktes de passende doses en volumes.
Lichaamsgewicht patiënt 60 kg, bij een onderhoudsdosering van 6 mg/kg elke 4 weken:
● Voorbeeld oplaaddosis (eerste 4 weken): 60 kg x 3 mg/kg = 180 mg emicizumab is nodig voor de oplaaddosis.
● Om het toe te dienen volume te berekenen, wordt de berekende dosis 180 mg gedeeld door 150 mg/ml: 180 mg emicizumab ÷ 150 mg/ml = 1,20 ml van de 150 mg/ml concentratie van Hemlibra moet worden geïnjecteerd.
● Kies uit de beschikbare injectieflaconsterktes de passende doses en volumes.
● Voorbeeld onderhoudsdosis (vanaf week 5): 60 kg x 6 mg/kg = 360 mg emicizumab is nodig voor de onderhoudsdosis.
● Om het toe te dienen volume te berekenen, wordt de berekende dosis 360 mg gedeeld door 150 mg/ml: 360 mg emicizumab ÷ 150 mg/ml = 2,4 ml van de 150 mg/ml concentratie van Hemlibra moet elke 4 weken worden geïnjecteerd.
● Kies uit de beschikbare injectieflaconsterktes de passende doses en volumes.
Duur van de behandeling
Hemlibra is bedoeld als langdurige profylactische behandeling.
Dosisaanpassingen tijdens de behandeling
Voor Hemlibra worden geen dosisaanpassingen aanbevolen.
Uitgestelde of vergeten doses
Als een patiënt een geplande subcutane injectie met Hemlibra vergeet, moet de patiënt geïnstrueerd worden om de vergeten dosis zo snel mogelijk toe te dienen, tot een dag vóór de dag van de volgende geplande dosis. De patiënt moet dan de volgende dosis op de gebruikelijke geplande dag toedienen. De patiënt mag niet twee doses op dezelfde dag gebruiken om een vergeten dosis in te halen.
Speciale populaties
Pediatrische patiënten
Voor pediatrische patiënten worden geen dosisaanpassingen aanbevolen (zie rubriek 5.2). Er zijn geen gegevens beschikbaar bij patiënten jonger dan 1 jaar.
Oudere patiënten
Bij patiënten van ≥ 65 jaar worden geen dosisaanpassingen aanbevolen (zie rubriek 5.1 en 5.2). Er zijn geen gegevens beschikbaar bij patiënten ouder dan 77 jaar.
Verminderde nier- en leverfunctie
Voor patiënten met een licht verminderde nier- of leverfunctie worden geen dosisaanpassingen aanbevolen (zie rubriek 5.2). Beperkte gegevens zijn beschikbaar over het gebruik van Hemlibra bij patiënten met een matig verminderde nier- of leverfunctie. Emicizumab is niet onderzocht bij patiënten met een ernstig verminderde nier- of leverfunctie.
Behandeling in de perioperatieve setting
De veiligheid en werkzaamheid van emicizumab zijn niet formeel beoordeeld in de chirurgische setting. In klinische onderzoeken hebben patiënten chirurgische ingrepen ondergaan zonder het stopzetten van emicizumab profylaxe.
Als bypassing agents (zoals aPCC en rFVIIa) nodig zijn in de perioperatieve periode, zie dan de doseringsadviezen voor gebruik van bypassing agents in rubriek 4.4. Als FVIII nodig is in de perioperatieve periode, zie rubriek 4.5.
Wanneer de hemostatische activiteit van een patiënt gecontroleerd wordt, zie rubriek 4.4 voor laboratoriumtests die niet door emicizumab beïnvloed worden.
Immuuntolerantie-inductie (ITI)
De veiligheid en werkzaamheid van emicizumab gedurende immuuntolerantie-inductie zijn nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Hemlibra is alleen voor subcutaan gebruik en moet met passende aseptische techniek worden toegediend (zie rubriek 6.6).
De injectie moet worden beperkt tot de aanbevolen injectieplaatsen: de buik, de achterkant van de bovenarmen en de dijen (zie rubriek 5.2).
Een verzorger of beroepsbeoefenaar in de gezondheidszorg moet Hemlibra subcutaan in de achterkant van de bovenarm toedienen.
Door de injectieplaatsen af te wisselen, kunnen injectieplaatsreacties mogelijk worden voorkomen of verminderd (zie rubriek 4.8). Hemlibra mag niet subcutaan worden toegediend op plaatsen waar de huid rood, beschadigd, pijnlijk of hard is, of op plaatsen met moedervlekken of littekens.
Tijdens de behandeling met Hemlibra worden andere geneesmiddelen voor subcutane toediening bij voorkeur op een ander deel van het lichaam geïnjecteerd.
Toediening door de patiënt en/of verzorger
Hemlibra is bedoeld voor gebruik onder toezicht van een beroepsbeoefenaar in de gezondheidszorg. Na een grondige training in de techniek van het subcutaan injecteren mag een patiënt Hemlibra bij zichzelf injecteren, of de verzorger van de patiënt mag injecteren als de arts vaststelt dat dit kan.
De arts en de verzorger moeten vaststellen in hoeverre een kind zichzelf met Hemlibra kan injecteren. Echter voor kinderen die jonger zijn dan 7 jaar wordt het niet aanbevolen om zelf te injecteren.
Zie voor de volledige toedieningsinstructies van Hemlibra rubriek 6.6 en de bijsluiter.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Het algehele veiligheidsprofiel van Hemlibra is gebaseerd op gegevens uit klinische onderzoeken en toezicht na het op de markt brengen. De ernstigste bijwerkingen die in klinische onderzoeken met Hemlibra zijn gemeld, waren trombotische microangiopathie (TMA) en trombotische voorvallen, waaronder caverneuze sinustrombose (CST) en oppervlakkige veneuze trombose die gelijktijdig optrad met huidnecrose (zie hieronder en rubriek 4.4).
De meest voorkomende bijwerkingen die werden gemeld bij ≥ 10% van de patiënten die met minstens één dosis Hemlibra werden behandeld, waren: injectieplaatsreacties (19,4%), artralgie (14,2%) en hoofdpijn (14,0%).
In totaal drie patiënten (0,7%) die profylaxe met Hemlibra kregen in de klinische onderzoeken, stopten met de behandeling als gevolg van de volgende bijwerkingen: TMA, huidnecrose die gelijktijdig optrad met oppervlakkige tromboflebitis, en hoofdpijn.
Lijst van bijwerkingen in tabelvorm
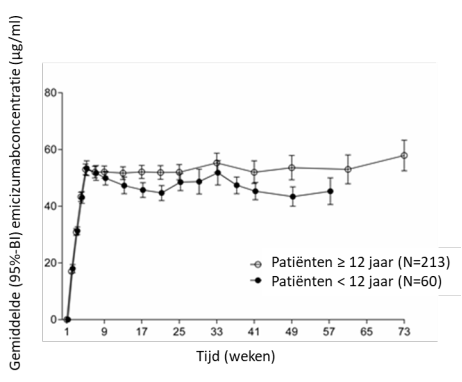
De volgende bijwerkingen zijn gebaseerd op gegevens uit toezicht na het op de markt brengen en samengevoegde gegevens uit vijf klinische fase III-onderzoeken (onderzoeken bij volwassenen en adolescenten [BH29884 – HAVEN 1, BH30071 – HAVEN 3 en BO39182 – HAVEN 4], een onderzoek met alle leeftijdsgroepen [BO41423 – HAVEN 6] en een pediatrisch onderzoek [BH29992 – HAVEN 2]), waarin in totaal 444 patiënten met hemofilie A minstens één dosis Hemlibra als routineprofylaxe ontvingen (zie rubriek 5.1). Driehonderdzeven (69,1%) deelnemers aan het klinisch onderzoek waren volwassen (waaronder 2 vrouwen), 61 (13,7%) waren adolescenten (≥ 12 tot < 18 jaar), 71 (16,0%) waren kinderen (≥ 2 tot < 12 jaar) en 5 (1,1%) waren baby’s en peuters (1 maand tot < 2 jaar). De mediane blootstellingsduur in de onderzoeken was 32 weken (bereik: 0,1 tot 94,3 weken).
Bijwerkingen uit de klinische fase III-onderzoeken en toezicht na het op de markt brengen, worden vermeld per MedDRA-systeem/orgaanklasse (tabel 2). De corresponderende frequentiecategorieën voor elke bijwerking zijn gebaseerd op de volgende conventie: zeer vaak (≥1/10), vaak (≥1/100, <1/10), soms (≥1/1.000, <1/100), zelden (1/10.000, <1/1.000), zeer zelden (<1/10.000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 2 Overzicht van bijwerkingen uit samengevoegde HAVEN klinische onderzoeken met Hemlibra en toezicht na het op de markt brengen
Systeem/orgaanklasse | Bijwerkingen | Frequentie |
Bloed- en lymfestelselaandoeningen | Trombotische microangiopathie | Soms |
Zenuwstelselaandoeningen | Hoofdpijn | Zeer vaak |
Bloedvataandoeningen | Oppervlakkige tromboflebitis | Soms |
Sinus cavernosus trombosea | Soms | |
Maagdarmstelselaandoeningen | Diarree | Vaak |
Huid- en onderhuidaandoeningen | Huidnecrose | Soms |
Angio-oedeem | Soms | |
Urticaria | Vaak | |
Rash | Vaak | |
Skeletspierstelsel- en bindweefselaandoeningen | Artralgie | Zeer vaak |
Myalgie | Vaak | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Injectieplaatsreactie | Zeer vaak |
Pyrexie | Vaak | |
Therapeutische respons verlaagdb | Soms | |
Immuunsysteemaandoeningen | Overgevoeligheid | Soms |
a Bloedvataandoeningen is een secundaire systeem/orgaanklasse voor sinus cavernosus trombose. | ||
Beschrijving van geselecteerde bijwerkingen
Trombotische microangiopathie
In de samengevoegde klinische fase III-onderzoeken zijn voorvallen van TMA gemeld bij minder dan 1% van de patiënten (3/444) en bij 9,7% van de patiënten (3/31) die minstens één dosis aPCC kregen tijdens behandeling met emicizumab. Alle 3 voorvallen van TMA traden op wanneer gemiddeld een cumulatieve hoeveelheid van > 100 E/kg/24 uur aPCC gedurende 24 uur of langer tijdens een behandeling werd toegediend (zie rubriek 4.4). Patiënten dienden zich aan met trombocytopenie, microangiopathische hemolytische anemie en acute nierschade, zonder ernstige deficiëntie van de ADAMTS13-activiteit. Eén patiënt hervatte de behandeling met Hemlibra na herstel van TMA zonder recidief.
Trombotische voorvallen
In de samengevoegde klinische fase III-onderzoeken zijn ernstige trombotische voorvallen gemeld bij minder dan 1% van de patiënten (2/444) en bij 6,5% van de patiënten (2/31) die minstens één dosis aPCC kregen tijdens behandeling met emicizumab. Beide ernstige trombotische voorvallen traden op wanneer een cumulatieve hoeveelheid aPCC van gemiddeld > 100 E/kg/24 uur gedurende 24 uur of langer tijdens een behandeling werd toegediend. Eén patiënt hervatte de behandeling met Hemlibra na herstel van het trombotische voorval zonder recidief (zie rubriek 4.4).
Karakterisering van de interactie tussen emicizumab en behandeling met aPCC in klinische hoofdonderzoeken
Er waren 82 gevallen van behandeling met aPCC* bij patiënten die profylaxe met Hemlibra ontvingen, waarbij er in acht gevallen (10%) sprake was van een gemiddelde cumulatieve hoeveelheid van 100 E/kg/24 uur aPCC gedurende 24 uur of meer; twee van de acht gevallen gingen gepaard met trombotische voorvallen en drie van de acht gevallen gingen gepaard met TMA (tabel 3). De overige gevallen van behandeling met aPCC gingen niet met TMA of trombotische voorvallen gepaard. Van alle gevallen van behandeling met aPCC ging het bij 68% om slechts één infusie < 100 E/kg.
Tabel 3 Karakterisering van behandeling met aPCC* in de samengevoegde klinische fase III-onderzoeken
Duur van behandeling met aPCC | Gemiddelde cumulatieve hoeveelheid aPCC gedurende 24 uur (E/kg/24 uur) | ||
<50 | 50–100 | >100 | |
<24 uur | 9 | 47 | 13 |
24–48 uur | 0 | 3 | 1b |
>48 uur | 1 | 1 | 7a,a,a,b |
* Een ‘geval van behandeling met aPCC’ wordt gedefinieerd als alle doses aPCC die door een patiënt zijn ontvangen, om welke reden dan ook, tot er een onderbreking van 36 uur zonder behandeling was. Dit omvat alle behandelingen met aPCC met uitzondering van die welke plaatsvonden gedurende de eerste 7 behandelingsdagen of 30 dagen na stopzetting van Hemlibra.
aTrombotische microangiopathie
bTrombotisch voorval
Injectieplaatsreacties
In de samengevoegde klinische fase III-onderzoeken werden injectieplaatsreacties (injection site reactions – ISR’s) zeer vaak (19,4%) gemeld. Alle ISR’s die in de klinische onderzoeken met Hemlibra werden waargenomen, werden als niet-ernstig gemeld en waren licht tot matig in intensiteit; 94,9% verdween zonder behandeling. De meest gemelde symptomen van ISR waren erytheem op de injectieplaats (10,6%), pijn op de injectieplaats (4,1%), pruritus op de injectieplaats (2,9%) en zwelling op de injectieplaats (2,7%).
Immunogeniteit
In de samengevoegde klinische fase III-onderzoeken met Hemlibra werd soms het ontstaan van neutraliserende anti‑emicizumab‑antilichamen geassocieerd met afnemende emicizumabconcentratie (zie rubriek 5.1). Eén patiënt, die neutraliserende anti‑emicizumab‑antilichamen ontwikkelde bij afnemende emicizumabconcentratie, kreeg na 5 weken behandeling verlies van werkzaamheid (zich manifesterend als doorbraakbloedingen) en heeft later de behandeling met Hemlibra gestaakt (zie rubriek 4.4 en 5.1).
Pediatrische patiënten
De onderzochte pediatrische populatie omvatte in totaal 137 patiënten, van wie er 5 (3,6%) baby’s en peuters waren (van 1 maand tot minder dan 2 jaar oud), 71 (51,8%) waren kinderen (van 2 tot minder dan 12 jaar oud) en 61 (44,5%) waren adolescenten (van 12 tot minder dan 18 jaar oud).
Het veiligheidsprofiel van Hemlibra was over het algemeen consistent tussen baby’s, kinderen, adolescenten en volwassenen.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden (zie hieronder voor details).
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Duitsland
8. NUMMERS VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Hemlibra 30mg/ml oplossing voor injectie
EU/1/18/1271/006 (12 mg/0,4 ml)
EU/1/18/1271/001 (30 mg/1 ml)
Hemlibra 150 mg/ml oplossing voor injectie
EU/1/18/1271/002 (60 mg/0,4 ml)
EU/1/18/1271/003 (105 mg/0,7 ml)
EU/1/18/1271/004 (150 mg/1 ml)
EU/1/18/1271/005 (300 mg/2 ml)
10. DATUM VAN HERZIENING VAN DE TEKST
27 maart 2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu/
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3747300 | HEMLIBRA 30MG/1,0ML OPL INJ FL INJ 1 +CNK 4125928 | B02BX06 | € 2296,95 | - | Ja | € 2 | € 1 |
| 3747318 | HEMLIBRA 150MG/1,0ML OPL INJ FL INJ 1 +CNK 4125928 | B02BX06 | € 11440,8 | - | Ja | € 2 | € 1 |
| 3747326 | HEMLIBRA 105MG/0,7ML OPL INJ FL INJ 1 +CNK 4125928 | B02BX06 | € 8011,86 | - | Ja | € 2 | € 1 |
| 3747334 | HEMLIBRA 60MG/0,4ML OPL INJ FL INJ 1 +CNK 4125928 | B02BX06 | € 4582,9 | - | Ja | € 2 | € 1 |