BIJLAGE I
SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
ONIVYDE pegylated liposomal 4,3 mg/ml concentraat voor dispersie voor infusie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Eén injectieflacon van 10 ml concentraat bevat 43 mg irinotecan watervrije vrije base (als irinotecansucrosofaatzout in gepegyleerde liposomale vorm).
Eén ml concentraat bevat 4,3 mg irinotecan watervrije vrije base (als irinotecansucrosofaatzout in gepegyleerde liposomale vorm).
Hulpstof met bekend effect
Eén ml concentraat bevat 0,144 mmol (3,31 mg) natrium.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Concentraat voor dispersie voor infusie.
Witte tot lichtgele, ondoorzichtige, isotone, liposomale dispersie.
Het concentraat heeft een pH‑waarde van 7,2 en een osmolaliteit van 295 mOsm/kg.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
ONIVYDE pegylated liposomal is geïndiceerd:
- in combinatie met oxaliplatine, 5‑fluorouracil (5‑FU) en leucovorine (LV) voor de eerstelijnsbehandeling van volwassen patiënten met gemetastaseerd adenocarcinoom van de pancreas,
-in combinatie met 5‑FU en LV voor de behandeling van gemetastaseerd adenocarcinoom van de pancreas bij volwassen patiënten bij wie de aandoening is verergerd na een behandeling op basis van gemcitabine.
4.2 Dosering en wijze van toediening
ONIVYDE pegylated liposomal dient aan de patiënt te worden voorgeschreven en toegediend door beroepsbeoefenaren in de gezondheidszorg die ervaring hebben met het geven van kankerbehandelingen.
ONIVYDE pegylated liposomal is niet equivalent aan niet‑liposomale vormen van irinotecan en mag hiermee niet worden verwisseld.
Dosering
ONIVYDE pegylated liposomal mag niet als monotherapie worden toegediend en dient te worden voortgezet tot ziekteprogressie of tot het niet meer door de patiënt wordt verdragen.
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
ONIVYDE pegylated liposomal oxaliplatine, LV en 5-FU dienen opeenvolgend te worden toegediend. De aanbevolen dosis ONIVYDE pegylated liposomal is 50 mg/m2 intraveneus in 90 minuten, gevolgd door oxaliplatine 60 mg/m2 intraveneus in 120 minuten, gevolgd door LV 400 mg/m2 intraveneus in 30 minuten, gevolgd door 5-FU 2.400 mg/m2 intraveneus in 46 uur. Dit schema dient elke 2 weken te worden toegediend.
Oxaliplatine kan worden gestaakt als het niet goed wordt verdragen en behandeling van ONIVYDE pegylated liposoma + 5-FU kan worden voortgezet.
De aanbevolen aanvangsdosis ONIVYDE pegylated liposomal bij patiënten van wie bekend is dat ze homozygoot zijn voor het UGT1A1*28-allel is ongewijzigd en blijft 50 mg/m2 intraveneus in 90 minuten toegediend (zie rubriek 5.1 en 5.2).
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
ONIVYDE pegylated liposomal, leucovorine en 5‑fluorouracil dienen na elkaar te worden toegediend. De aanbevolen dosering en het bijbehorende behandelingsschema voor ONIVYDE pegylated liposomal zijn als volgt: 70 mg/m2 intraveneus, verdeeld over 90 minuten, gevolgd door 400 mg/m2 LV intraveneus, verdeeld over 30 minuten, gevolgd door 2400 mg/m2 5‑FU intraveneus, verdeeld over 46 uur, om de 2 weken.
Voor patiënten van wie bekend is dat ze homozygoot zijn voor het UGT1A1*28‑allel, dient een lagere aanvangsdosis ONIVYDE pegylated liposomal (van 50 mg/m2 te worden overwogen (zie rubriek 4.8 en 5.1). Indien het middel in daaropvolgende cycli wordt verdragen, dient verhoging van de dosis ONIVYDE pegylated liposomal naar 70 mg/m2 te worden overwogen.
Premedicatie
Het verdient aanbeveling dat patiënten ten minste 30 minuten vóór de infusie met ONIVYDE pegylated liposomal premedicatie ontvangen met standaarddoses dexamethason (of een equivalente corticosteroïde) in combinatie met een 5‑HT3‑antagonist (of een ander anti‑emeticum).
Dosisaanpassingen
Voor alle dosisaanpassingen dient te worden uitgegaan van de ergste eerdere toxiciteit. De dosis LV hoeft niet te worden aangepast.
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
Tabel 1: Aanbevolen dosisaanpassingen voor ONIVYDE pegylated liposomal + oxaliplatine/5‑FU/LV
Graad van toxiciteit (waarde) volgens NCI CTCAE † | Aanpassingen van ONIVYDE pegylated liposomal/oxaliplatine/5‑FU
| |
Hematologische toxiciteiten | ||
Neutropenie | Een nieuwe behandelingscyclus mag pas beginnen wanneer de absolute neutrofielentelling ≥2.000/mm3 (2x109/l) is | |
Graad 3 of graad 4 (<1.000 cellen/mm3) of neutropene koorts | Eerste voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 80% van aanvankelijke dosis |
Tweede voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 65% van aanvankelijke dosis | |
Derde voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 50% van aanvankelijke dosis | |
Vierde voorval | Stoppen met de behandeling | |
Trombocytopenie Leukopenie | Een nieuwe behandelingscyclus mag pas beginnen wanneer de plaatjestelling ≥ 100.000/mm3 (100x109/l) is. | |
Niet‑hematologische toxiciteiten* | ||
Diarree | Een nieuwe behandelingscyclus mag pas beginnen wanneer diarree afneemt tot ≤ graad 1 (2 à 3 extra stoelgangen per dag vergeleken met de frequentie vóór de behandeling). | |
Graad 2 | Een nieuwe behandelingscyclus mag pas beginnen wanneer diarree afneemt tot ≤ graad 1 (2 à 3 extra stoelgangen per dag vergeleken met de frequentie vóór de behandeling). | |
Graad 3 of 4 | Eerste voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 80% van aanvankelijke dosis |
Tweede voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 65% van aanvankelijke dosis | |
Derde voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 50% van aanvankelijke dosis | |
Vierde voorval | Stoppen met de behandeling | |
Alle andere toxiciteiten* | Eerste voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 80% van aanvankelijke dosis |
Tweede voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 65% van aanvankelijke dosis | |
Derde voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 50% van aanvankelijke dosis | |
Vierde voorval | Stoppen met de behandeling | |
Voor nausea en braken van graad ≥ 3 | Verlaag de dosis alleen als dit ondanks optimale anti-emetische behandeling optreedt | |
Hand-voetsyndroom: graad 3 of 4 | Eerste voorval | Stoppen met de behandeling |
Neurocerebellaire toxiciteit van welke graad dan ook of cardiale toxiciteit van ≥ graad 2 | Eerste voorval | Stoppen met de behandeling |
Anafylactische reactie | Eerste voorval | Stoppen met de behandeling |
Interstitiële longziekte | Eerste voorval | Stoppen met de behandeling |
* Asthenie en anorexia zijn uitgesloten; | ||
Patiënten die homozygoot zijn voor het UGT1A1*28-allel dienen met dezelfde dosis ONIVYDE pegylated liposomal te beginnen en voor hen gelden dezelfde voorschriften voor dosisverlaging.
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
Voor patiënten die beginnen met 50 mg/m2 ONIVYDE pegylated liposomal en bij wie de dosis niet wordt verhoogd naar 70 mg/m2 is de aanbevolen eerste dosisverlaging naar 43 mg/m2 en de tweede dosisverlaging naar 35 mg/m2. Bij patiënten die een verdere dosisverlaging nodig hebben, dient de behandeling te worden gestopt.
Bij patiënten van wie bekend is dat ze homozygoot zijn voor het UGT1A1*28-allel en zonder geneesmiddelgerelateerde toxiciteiten tijdens de eerste behandelingscyclus (verlaagde dosis van 50 mg/m2) kan de dosis ONIVYDE pegylated liposomal in volgende cycli worden verhoogd naar een totale dosis van 70 mg/m2 op basis van de individuele verdraagbaarheid.
Tabel 2: Aanbevolen dosisaanpassingen voor ONIVYDE pegylated liposomal+5‑FU/LV bij toxiciteiten graad 3 tot 4 voor patiënten die niet homozygoot voor UGT1A1*28 zijn
Graad van toxiciteit (waarde) volgens NCI CTCAE1 | Aanpassing van ONIVYDE pegylated liposomal/5‑FU | |
Hematologische toxiciteiten | ||
Neutropenie | Een nieuwe behandelingscyclus mag pas beginnen wanneer de absolute neutrofielentelling ≥ 1.500 cellen/mm3 is | |
Graad 3 of graad 4 (< 1.000 cellen/mm3) of neutropene koorts | Eerste voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 50 mg/m2 |
Tweede voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 43 mg/m2 | |
Derde voorval | Stoppen met de behandeling | |
Trombocytopenie | Een nieuwe behandelingscyclus mag pas beginnen wanneer de plaatjestelling ≥ 100.000 bloedplaatjes/mm3 is | |
Niet‑hematologische toxiciteiten2 | ||
Diarree | Een nieuwe behandelingscyclus mag pas beginnen wanneer diarree afneemt tot ≤ graad 1 (2 à 3 extra stoelgangen per dag, vergeleken met de frequentie vóór de behandeling). | |
Graad 2 | Een nieuwe behandelingscyclus mag pas beginnen wanneer diarree afneemt tot ≤ graad 1 (2 à 3 extra stoelgangen per dag, vergeleken met de frequentie vóór de behandeling). | |
Graad 3 of 4 | Eerste voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 50 mg/m2 |
Tweede voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 43 mg/m2 | |
Derde voorval | Stoppen met de behandeling | |
Nausea/braken | Een nieuwe behandelingscyclus mag pas beginnen wanneer nausea/braken afneemt tot ≤ graad 1 of baseline | |
Graad 3 of 4 (ondanks anti‑emetische behandeling) | Eerste voorval | Anti‑emetische behandeling optimaliseren |
Tweede voorval | Anti‑emetische behandeling optimaliseren | |
Derde voorval | Stoppen met de behandeling | |
Hepatische, renale, respiratoire of andere2 toxiciteiten | Een nieuwe behandelingscyclus mag pas beginnen wanneer de bijwerking afneemt tot ≤ graad 1 | |
Eerste voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 50 mg/m2 | |
Tweede voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 43 mg/m2 | |
Derde voorval | Stoppen met de behandeling | |
Anafylactische reactie | Eerste voorval | Stoppen met de behandeling |
Interstitiële longziekte | Eerste voorval | Stoppen met de behandeling |
1 NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Events, huidige versie
2 Asthenie en anorexie zijn uitgesloten; bij asthenie en bij anorexie graad 3 is geen dosisaanpassing nodig
Tabel 3: Aanbevolen dosisaanpassingen voor ONIVYDE pegylated liposomal +5‑FU/LV voor toxiciteiten graad 3 tot 4 bij patiënten die homozygoot voor UGT1A1*28 zijn
Graad van toxiciteit (waarde) | Aanpassing van ONIVYDE pegylated liposomal/5‑FU | |
Bijwerkingen2 graad 3 of 4 | Een nieuwe behandelingscyclus mag pas beginnen wanneer de bijwerking afneemt tot ≤ graad 1 | |
Eerste voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 43 mg/m2 | |
Tweede voorval | Dosis ONIVYDE pegylated liposomal verlagen naar 35 mg/m2 | |
Derde voorval | Stoppen met de behandeling | |
Anafylactische reactie | Eerste voorval | Stoppen met de behandeling |
Interstitiële longziekte | Eerste voorval | Stoppen met de behandeling |
1 NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Events, huidige versie
2 Asthenie en anorexie zijn uitgesloten; bij asthenie en bij anorexie graad 3 is geen dosisaanpassing nodig
3 Indien bij verhoging van de dosis ONIVYDE pegylated liposomal naar 70 mg/m2 het middel in daaropvolgende cycli wordt verdragen, dienen de aanbevolen dosiswijzigingen conform Tabel 2 te zijn.
Speciale populaties
Leverfunctie afgenomen
Met ONIVYDE pegylated liposomal is geen specifiek onderzoek naar afgenomen leverfunctie uitgevoerd. Het gebruik van ONIVYDE pegylated liposomal dient te worden vermeden bij patiënten met een waarde voor bilirubine > 2,0 mg/dl, of voor aspartaataminotransferase (ASAT) en alanineaminotransferase (ALAT) > 2,5 maal de bovengrens van normaal of > 5 maal de bovengrens van normaal indien er een levermetastase aanwezig is (zie rubriek 4.4).
Nierfunctie verminderd
Met ONIVYDE pegylated liposomal is geen specifiek onderzoek naar nierfunctieverminderingen uitgevoerd. Bij patiënten met een lichte tot matig ernstige nierfunctievermindering wordt geen dosisaanpassing aanbevolen (zie rubriek 4.4 en 5.2). ONIVYDE pegylated liposomal wordt niet aanbevolen voor gebruik bij patiënten met een ernstige nierfunctiestoornis (CLcr < 30 ml/min).
Ouderen
Negenenveertig procent (49,6%) in NAPOLI-3 en eenenveertig procent (41%) in NAPOLI-1 van de patiënten die met ONIVYDE pegylated liposomal werden behandeld, was ≥ 65 jaar. Er wordt geen dosisaanpassing aanbevolen.
Pediatrische patiënten
De veiligheid en werkzaamheid van ONIVYDE pegylated liposomal bij kinderen en adolescenten in de leeftijd ≤ 18 jaar zijn nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
ONIVYDE pegylated liposomal is bestemd voor intraveneus gebruik. Het concentraat dient vóór toediening te worden verdund en dient in 90 minuten te worden gegeven als intraveneuze infusie. Voor meer informatie, zie rubriek 6.6.
Te nemen voorzorgen voorafgaand aan gebruik of toediening van het geneesmiddel
ONIVYDE pegylated liposomal is een cytotoxisch geneesmiddel. Het verdient aanbeveling om tijdens het gebruik of de toediening van ONIVYDE pegylated liposomal handschoenen, een bril en beschermende kleding te dragen. Zwangere personeelsleden mogen ONIVYDE pegylated liposomal niet hanteren.
4.3 Contra‑indicaties
Voorgeschiedenis van ernstige overgevoeligheid voor irinotecan of voor een van de in rubriek 6.1 vermelde hulpstof(fen).
Borstvoeding (zie rubriek 4.6).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine (NALIRIFOX)
De volgende bijwerkingen, gerelateerd aan de toediening van ONIVYDE pegylated liposomal, werden gemeld bij 370 patiënten die werden behandeld in combinatie met oxaliplatine/5-FU/LV, die niet eerder chemotherapie hadden gekregen voor gemetastaseerd pancreasadenocarcinoom.
De vaakst voorkomende bijwerkingen (incidentie ≥ 20%) waren diarree, nausea, braken, verminderde eetlust, vermoeidheid, asthenie, neutropenie, neutrofielentelling verlaagd en anemie. De vaakst voorkomende hevige bijwerkingen (≥ 5% graad 3 of 4) waren diarree, nausea, braken, verminderde eetlust, vermoeidheid, asthenie, neutropenie, neutrofielentelling verlaagd, anemie en hypokaliëmie. De vaakst voorkomende ernstige bijwerkingen (≥ 2%) waren diarree, nausea, braken en dehydratie.
De bij ONIVYDE pegylated liposomal waargenomen bijwerkingen die leidden tot permanente stopzetting traden op bij 9,5% van de patiënten. De vaakst voorkomende bijwerking die leidde tot stopzetting was neutropenie.
Dosisverlagingen van ONIVYDE pegylated liposomal als gevolg van bijwerkingen (ongeacht de beoordeling van causaliteit) vonden plaats bij 52,4% van de patiënten. De vaakst voorkomende bijwerkingen waarvoor dosisverlaging nodig was (≥ 5%) waren diarree, nausea, neutropenie en neutrofielentelling verlaagd.
ONIVYDE pegylated liposomal werd onthouden als gevolg van bijwerkingen (ongeacht de beoordeling van causaliteit) bij 1,9% van de patiënten. De vaakst voorkomende bijwerkingen waarvoor onderbreking nodig was, waren overgevoeligheid en infusiegerelateerde reacties die bij 0,5% van de patiënten optraden.
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
De onderstaande bijwerkingen, die verband houden met de toediening van ONIVYDE pegylated liposomal, werden gemeld bij 264 patiënten met gemetastaseerd pancreasadenocarcinoom die behandeld werden na ziekteprogressie na therapie op basis van gemcitabine.
De meest voorkomende bijwerkingen (incidentie ≥ 20%) van ONIVYDE pegylated liposomal+ 5‑FU/LV waren: diarree, nausea, braken, verminderde eetlust, neutropenie, vermoeidheid, asthenie, anemie, stomatitis en pyrexie. De meest voorkomende ernstige bijwerkingen (≥ 2%) van de behandeling met ONIVYDE pegylated liposomal waren diarree, braken, febriele neutropenie, nausea, pyrexie, sepsis, dehydratie, septische shock, pneumonie, acuut nierfalen en trombocytopenie.
De percentages bijwerkingen die leidden tot het staken van de behandeling waren 11% voor de ONIVYDE pegylated liposomal+5‑FU/LV‑arm.
De vaakst gemelde bijwerkingen die leidden tot het staken van de behandeling waren infectie en diarree voor de ONIVYDE pegylated liposomal+5‑FU/LV‑arm.
Tabel met bijwerkingen
De in deze paragraaf beschreven bijwerkingen zijn afgeleid van onderzoeksgegevens en postmarketingervaring van ONIVYDE pegylated liposomal.
De bijwerkingen die zich kunnen voordoen tijdens de behandeling met ONIVYDE pegylated liposomal zijn hieronder weergegeven, gerangschikt naar systeem/orgaanklasse en frequentie (tabel 4). Binnen elke systeem/orgaanklasse en frequentiecategorie zijn de bijwerkingen gerangschikt op volgorde van afnemende ernst. De frequentiecategorieën die voor bijwerkingen worden gebruikt, zijn: zeer vaak (≥1/10); vaak (≥1/100, <1/10); soms (≥1/1.000, <1/100), zelden (≥1/10.000, <1/1.000)* en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 4: Bijwerkingen gemeld bij patiënten die werden behandeld met ONIVYDE pegylated liposomal
Systeem/ orgaanklasse | In combinatie met oxaliplatine/5‑FU/LV | In combinatie met 5-FU/LV |
Infecties en parasitaire aandoeningen | ||
Vaak | Sepsis, urineweginfectie, Candida-infectie, nasofaryngitis | Septische shock, sepsis, pneumonie, febriele neutropenie, gastro-enteritis, orale candidiasis |
Soms | Diverticulitis, pneumonie, anaal abces, febriele infectie, gastro-enteritis, slijmvliesinfectie, orale schimmelinfectie, Clostridium difficile-infectie, conjunctivitis, furunkel, herpes simplex, laryngitis, periodontitis, pustuleuze rash, sinusitis, tandinfectie, vulvovaginale mycotische infectie | Biliaire sepsis |
Neoplasmata benigne, maligne en niet-gespecificeerd (inclusief cysten en poliepen) | ||
Soms | Peritumoraal oedeem |
|
Bloed- en lymfestelselaandoeningen | ||
Zeer vaak | Anemie, neutropenie, trombocytopenie | Neutropenie, leukopenie, anemie, trombocytopenie |
Vaak | Febriele neutropenie, leukopenie, lymfopenie | Lymfopenie |
Soms | Pancytopenie, hemolytische anemie |
|
Immuunsysteemaandoeningen | ||
Soms | Overgevoeligheid | Overgevoeligheid |
Niet bekend |
| Anafylactische/anafylactoïde reactie, angio-oedeem |
Voedings- en stofwisselingsstoornissen | ||
Zeer vaak | Hypokaliëmie, verminderde eetlust | Hypokaliëmie, hypomagnesiëmie, dehydratie, verminderde eetlust |
Vaak | Dehydratie, hyponatriëmie, hypofosfatemie, hypomagnesiëmie, hypoalbuminemie, hypocalciëmie | Hypoglykemie, hyponatriëmie, hypofosfatemie |
Soms | Elektrolytevenwichtstoornis, hypercalciëmie, celdood, hypochloremie, jicht, hyperglykemie, hyperkaliëmie, ijzerdeficiëntie, ondervoeding |
|
Psychische stoornissen | ||
Vaak |
| Insomnia |
Soms | Insomnia, verwarde toestand, depressie, neurose, |
|
Zenuwstelselaandoeningen | ||
Zeer vaak | Neuropathie perifeer, dysgeusie, paresthesie | Duizeligheid |
Vaak | Tremor, neurotoxiciteit, dysesthesie, cholinerg syndroom, hoofdpijn, duizeligheid | Cholinerg syndroom, dysgeusie |
Soms | Insult, cerebrale bloeding, cerebrale ischemie, ischemische beroerte, anosmie, ageusie, evenwichtsstoornis, hypersomnie, hypo-esthesie, intellectuele handicap, lethargie, geheugenvermindering, presyncope, syncope, transient ischaemic attack |
|
Oogaandoeningen | ||
Vaak | Gezichtsvermogen wazig |
|
Soms | Oogirritatie, scherpzien gereduceerd |
|
Evenwichtsorgaan- en ooraandoeningen | ||
Soms | Vertigo |
|
Hartaandoeningen | ||
Vaak | Tachycardie | Hypotensie |
Soms | Angina pectoris, acuut myocardinfarct, hartkloppingen |
|
Bloedvataandoeningen | ||
Vaak | Hypotensie, trombo-embolische voorvallen | Longembolie, trombo-embolische voorvallen |
Soms | Hypertensie, perifere koude, hematoom, flebitis |
|
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | ||
Vaak | Longembolie, hik, dyspneu, bloedneus | Dyspneu, dysfonie |
Soms | Orofaryngeale pijn, hoesten, hyperoxie, neusontsteking, atelectase, dysfonie, pneumonitis | Hypoxie, interstitiële longziekte (waaronder pneumonitis) |
Maagdarmstelselaandoeningen | ||
Zeer vaak | Diarree, nausea, braken, buikpijn/onwelbevinden, stomatitis | Diarree, braken, nausea, buikpijn, stomatitis |
Vaak | Colitis, enterocolitis, constipatie, droge mond, flatulentie, abdominale distensie, dyspepsie, gastro-oesofageale refluxziekte, hemorroïden, dysfagie | Colitis, hemorroïden |
Soms | Maag-darmtoxiciteit, duodenumobstructie, ontlastingsincontinentie, afte, orale dysesthesie, orale pijn, tongaandoening, anale fissuur, mondhoekcheilitis, dyschezie, paresthesie van de mond, tandcariës, oprisping, maagaandoening, gastritis, gingiva-aandoening, gingiva-pijn, bloederige faeces, hyperesthesie tanden, ileus paralytisch, lipzwelling, mondulceratie, oesofagusspasme, periodontale ziekte, rectale hemorragie | Oesofagitis, proctitis |
Lever- en galaandoeningen | ||
Vaak | Hyperbilirubinemie | Hypoalbuminemie |
Soms | Cholangitis, hepatitis toxisch, cholestase, hepatische cytolyse |
|
Huid- en onderhuidaandoeningen | ||
Zeer vaak | Alopecia | Alopecia |
Vaak | Droge huid, palmoplantair erytrodysesthesiesyndroom, rash, huidhyperpigmentatie | Pruritus |
Soms | Pruritus, hyperhidrose, bulleuze dermatitis, gegeneraliseerde exfoliatieve dermatitis, erytheem, nageltoxiciteit, papel, petechiae, psoriasis, gevoelige huid, huidexfoliatie, huidlaesie, telangiëctasieën, urticaria | Urticaria, rash, nagelverkleuring |
Niet bekend |
| Erytheem |
Skeletspierweefsel- en bindweefselaandoeningen | ||
Vaak | Spierzwakte, myalgie, spierspasmen |
|
Soms | Artralgie, pijn rug, botpijn, pijn in extremiteit, polyartritis |
|
Nier- en urinewegaandoeningen | ||
Vaak | Acuut nierletsel | Acuut nierfalen |
Soms | Nierfunctie verminderd, renaal falen, dysurie, proteïnurie |
|
Voortplantingsstelsel- en borstaandoeningen | ||
Soms | Vulvovaginale droogheid |
|
Algemene aandoeningen en toedieningsplaatsstoornissen | ||
Zeer vaak | Asthenie, slijmvliesontsteking | Pyrexie, perifeer oedeem, slijmvliesontsteking, asthenie |
Vaak | Pyrexie, oedeem, koude rillingen | Infusiegerelateerde reactie, oedeem |
Soms | Malaise, algemene deterioratie van lichamelijke gezondheid, ontsteking, multi-orgaandisfunctiesyndroom, influenza-achtige ziekte, niet-cardiale pijn op de borst, okselpijn, borstkaspijn, hypothermie, pijn, zwelling aangezicht, temperatuurintolerantie, xerose |
|
Onderzoeken | ||
Zeer vaak | Gewicht verlaagd | Gewicht verlaagd |
Vaak | Transaminasen (ALAT en ASAT) verhoogd, bloed alkalische fosfatase verhoogd, gamma-glutamyltransferase verhoogd, bloed creatinine verhoogd | Bilirubine verhoogd, transaminasen (ALAT en ASAT) verhoogd, internationale genormaliseerde ratio verhoogd |
Soms | Internationale genormaliseerde ratio verhoogd, eiwit totaal verlaagd, creatinineklaring renaal verlaagd, elektrocardiogram QT verlengd, monocytentelling verhoogd, troponine I verhoogd |
|
Letsels, intoxicaties en verrichtingscomplicaties | ||
Vaak | Infusiegerelateerde reactie |
|
* Zelden voorkomend, kan niet worden geschat uit het NAPOLI-1-onderzoek vanwege de kleine steekproefgrootte.
Beschrijving van geselecteerde bijwerkingen
Myelosuppressie
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
Fatale voorvallen waren febriele neutropenie of pancytopenie, die elk bij 0,3% van de patiënten in de NALIRIFOX-arm optraden.
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
Myelosuppressie (neutropenie/leukopenie, trombocytopenie en anemie) kwam vaker voor in de arm met ONIVYDE pegylated liposomal+5‑FU/LV dan in de controlearm met 5‑FU/LV.
Neutropenie/leukopenie
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
Leukopenie van graad 3 of 4 trad op bij 0,8% van de patiënten die NALIRIFOX kregen.
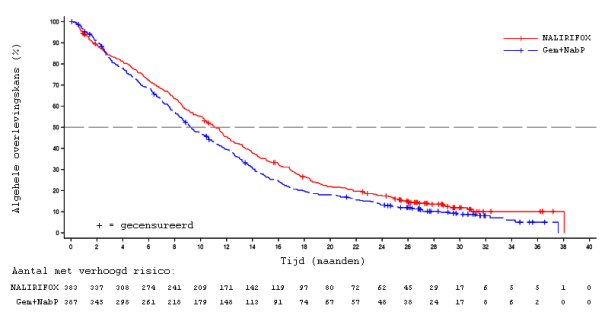
Tijdens NAPOLI-3, waarin ONIVYDE pegylated liposomal plus oxaliplatine/5‑FU/LV (NALIRIFOX) werd vergeleken met gemcitabine plus nab-paclitaxel (Gem+NabP), lieten de veiligheidsgegevens een hogere incidentie van neutropenie gemeld in de Gem+NabP-arm zien. Neutropenie van graad 3 of 4, neutrofielentelling verlaagd en febriele neutropenie traden op bij respectievelijk 14,1%, 9,7% en 1,9% van de patiënten die NALIRIFOX kregen.
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
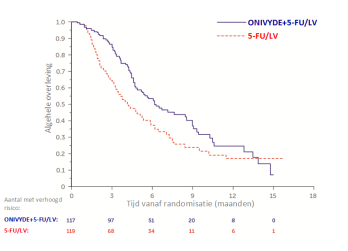
Neutropenie/leukopenie was de meest opvallende relevante hematologische toxiciteit. Neutropenie graad 3 of hoger kwam vaker voor bij patiënten die werden behandeld met ONIVYDE pegylated liposomal+5‑FU/LV (27,4%) dan bij patiënten die werden behandeld met 5‑FU/LV (1,5%). Neutropene koorts/sepsis kwam vaker voor in de arm die de combinatie ONIVYDE pegylated liposomal+5‑FU/LV kreeg (bij 4 patiënten, oftewel 3,4%) dan in de controlearm die 5‑FU/LV kreeg (bij 1 patiënt, oftewel 0,7%).
De mediane tijd tot nadir voor neutropenie ≥ graad 3 is 23 dagen (bereik: 8‑104 dagen) na de eerste dosis van de behandeling met ONIVYDE pegylated liposomal.
Trombocytopenie
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
Trombocytopenie graad 3 of 4 deed zich voor bij 0,5% van de patiënten die NALIRIFOX kregen.
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
Trombocytopenie graad 3 of hoger deed zich voor bij 2,6% van de patiënten die werden behandeld met ONIVYDE pegylated liposomal+5‑FU/LV en bij 0% van de patiënten die werden behandeld met 5‑FU/LV.
Anemie
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
Anemie graad 3 of 4 deed zich voor bij 7,3% van de patiënten die NALIRIFOX kregen.
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
Anemie graad 3 of hoger deed zich voor bij 10,3% van de patiënten die werden behandeld met ONIVYDE pegylated liposomal+5‑FU/LV en bij 6,7% van de patiënten die werden behandeld met 5‑FU/LV.
Acuut nierfalen
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
Tijdens NAPOLI-3 deed nierfunctie verminderd zich voor bij 0,3% van de patiënten en was graad 3 of 4, deed renaal falen van graad 1 tot 4 zich voor bij 0,5% van de patiënten en daarvan was 0,3% graad 3 of 4, deed acuut nierletsel van graad 1 tot 4 zich voor bij 1,1% van de patiënten en daarvan was 0,8% graad 3 of 4 bij patiënten die NALIRIFOX kregen, Bloedcreatinine verhoogd van graad 1 tot 4 deed zich voor bij 1,4% van de patiënten en daarvan was 0,3% graad 3 of 4, creatinineklaring renaal verlaagd van graad 1 of 2 deed zich voor bij 0,3% van de patiënten die NALIRIFOX kregen. Er was één geval (0,3%) van renaal falen met een fatale uitkomst in de NALIRIFOX-arm.
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
Tijdens NAPOLI-1 zijn nierfunctiestoornis en acuut nierfalen vastgesteld, doorgaans bij patiënten bij wie zich volumedepletie voordoet ten gevolge van nausea/braken en/of diarree. Acuut nierfalen werd gemeld bij 6 van de 117 patiënten (5,1%) in de arm met ONIVYDE pegylated liposomal+5‑FU/LV.
Diarree en gerelateerde bijwerkingen
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
Tijdens NAPOLI-3 toonden veiligheidsgegevens een hogere incidentie in de NALIRIFOX-arm voor alle graden en voor graad 3 of 4. Diarree van graad 1 tot 4 deed zich voor bij 64,3% van de patiënten en diarree van graad 3 of 4 deed zich voor bij 19,5% van de patiënten die NALIRIFOX kregen. Manifestaties van cholinerge reacties zoals rinitis, rinorroe, speekselhypersecretie, overmatig blozen, opvlieger en traanproductie verhoogd werden gemeld bij patiënten die NALIRIFOX kregen.
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
Tijdens NAPOLI-1 kwam diarree graad 3 of 4 voor bij 12,8% van de patiënten die ONIVYDE pegylated liposomal+5‑FU/LV kregen. Bij patiënten die late diarree kregen, was de mediane tijd tot de aanvang van late diarree 8 dagen, gerekend vanaf de vorige dosis ONIVYDE pegylated liposomal. Vroege diarree, doorgaans beginnend ≤ 24 uur na toediening van de dosis, kan zich voordoen en is gewoonlijk van voorbijgaande aard. Vroege diarree kan ook vergezeld gaan van cholinerge symptomen zoals rinitis, speekselhypersecretie, overmatig blozen, diaforese, bradycardie, miose en hyperperistaltiek, die buikkrampen kan veroorzaken. Vroege diarree deed zich voor bij 29,9% van de patiënten en cholinerge voorvallen deden zich voor bij 3,4% van de patiënten die ONIVYDE pegylated liposomal+5‑FU/LV kregen.
Infusiereactie
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
Tijdens NAPOLI-3 deed infusiegerelateerde reactie zich voor bij 1,4% van de patiënten die NALIRIFOX kregen, Al deze reacties waren licht of matig (graad 1 en 2).
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
Tijdens NAPOLI-1 werden acute infusiereacties gemeld bij 6,8% van de patiënten in de arm met ONIVYDE pegylated liposomal+5‑FU/LV.
Andere speciale populaties
Ouderen
Over het geheel genomen werden er wat veiligheid betreft geen grote klinische verschillen gemeld tussen patiënten ≥ 65 jaar en patiënten < 65 jaar.
ONIVYDE pegylated liposomal in combinatie met oxaliplatine, 5‑fluorouracil en leucovorine
In NAPOLI-3 was de mediane leeftijd 65 jaar (bereik: 20 tot 85), was 50,1% van de patiënten ten minste 65 jaar oud en 6,9% van de patiënten 75 jaar of ouder. De veiligheidsgegevens per leeftijdsgroep waren in lijn met de gegevens van de NALIRIFOX-arm in de gehele populatie.
ONIVYDE pegylated liposomal in combinatie met 5‑fluorouracil en leucovorine
In NAPOLI-1 werd een hogere frequentie van stopzetting van de behandeling opgemerkt bij patiënten van ≥ 65 jaar en < 65 jaar die met ONIVYDE pegylated liposomal+5‑FU/LV werden behandeld (respectievelijk 14,8% t.o.v. 7,9%) en verdwenen in sommige gevallen de bijwerkingen niet. Bijwerkingen graad 3 of hoger en ernstige door de behandeling veroorzaakte bijwerkingen kwamen vaker voor bij patiënten < 65 jaar (84,1% en 50,8%) dan bij patiënten ≥ 65 jaar (68,5% en 44,4%). Bij patiënten > 75 jaar (n=12) daarentegen was vaker sprake van ernstige bijwerkingen, dosisuitstel, dosisverlaging en staking van de behandeling dan bij patiënten ≤ 75 jaar (n=105) bij behandeling met ONIVYDE pegylated liposomal+5‑FU/LV tijdens het onderzoek naar pancreasadenocarcinoom.
Aziatische populatie
Tijdens NAPOLI-1 werd bij Aziatische patiënten vergeleken met Kaukasische patiënten een lagere incidentie van diarree gezien (14 van de 73 Kaukasische patiënten (19,2%) had diarree graad 3 of hoger en 1 van de 33 Aziatische patiënten (3,3%) had diarree graad 3 of hoger), maar een hogere incidentie en ernst van neutropenie. Wat betreft patiënten die ONIVYDE pegylated liposomal+5‑FU/LV kregen, was de incidentie van neutropenie graad 3 of hoger bij Aziatische patiënten hoger (18 van de 33, oftewel 55%) dan bij Kaukasische patiënten (13 van de 73, oftewel 18%). Neutropene koorts/neutropenische sepsis werd gemeld bij 6% van de Aziatische patiënten en bij 1% van de Kaukasische patiënten. Dit is consistent met de farmacokinetische populatieanalyse waaruit bij Aziaten een lagere blootstelling aan irinotecan bleek en een hogere blootstelling aan de actieve metaboliet SN‑38 dan bij Kaukasische patiënten.
Patiënten met een leverfunctie afgenomen
Tijdens klinische onderzoeken met niet‑liposomaal irinotecan dat volgens een wekelijks doseringsschema werd toegediend, hadden patiënten met matig verhoogde totaalbilirubine in serum bij baseline (1,0 à 2,0 mg/dl) een significant grotere kans op neutropenie graad 3 of 4 tijdens de eerste cyclus dan patiënten met bilirubinespiegels lager dan 1,0 mg/dl.
Patiënten met het UGT1A1‑allel
Personen die 7/7 homozygoot zijn voor het UGT1A1*28‑allel, hebben een verhoogde kans op neutropenie veroorzaakt door niet‑liposomaal irinotecan. Tijdens NAPOLI-1 was de frequentie van neutropenie graad 3 of hoger bij deze patiënten (2 van de 7, oftewel 28,6%) vergelijkbaar met de frequentie bij patiënten die niet homozygoot voor het UGT1A1*28‑allel waren en een aanvangsdosis ONIVYDE pegylated liposomal van 70 mg/m2 kregen (30 van de 110, oftewel 27,3%) (zie rubriek 5.1). Deze waarneming werd in NAPOLI-3 niet geëvalueerd.
Patiënten met ondergewicht (Quetelet‑index < 18,5 kg/m2)
Tijdens NAPOLI-1 deed zich bij 5 van de 8 patiënten met ondergewicht een bijwerking graad 3 of 4 voor, meestal myelosuppressie, terwijl bij 7 van de 8 patiënten een dosisaanpassing nodig was, zoals dosisuitstel, dosisverlaging of stoppen met de dosis (zie rubriek 4.4). Deze waarneming werd in NAPOLI-3 niet geëvalueerd.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via :
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website : www.eenbijwerkingmelden.be
E-mail : adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
Frankrijk
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/16/1130/001
10. DATUM VAN HERZIENING VAN DE TEKST
09/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3945714 | ONIVYDE 4,3MG/ML FL 1 X 10ML | L01CE02 | - | € 793,69 | Ja | - | - |