SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
IMFINZI 50 mg/ml concentraat voor oplossing voor infusie.
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke ml concentraat voor oplossing voor infusie bevat 50 mg durvalumab.
Eén injectieflacon van 2,4 ml concentraat bevat 120 mg durvalumab.
Eén injectieflacon van 10 ml concentraat bevat 500 mg durvalumab.
Durvalumab wordt geproduceerd in zoogdiercellen (ovariumcellen van de Chinese hamster) door DNA‑recombinatietechniek.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Concentraat voor oplossing voor infusie (steriel concentraat).
Heldere tot opalescente, kleurloze tot lichtgele oplossing, vrij van zichtbare deeltjes. De oplossing heeft een pH van ongeveer 6,0 en een osmolaliteit van ongeveer 400 mOsm/kg.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Niet‑kleincellige longkanker (NSCLC)
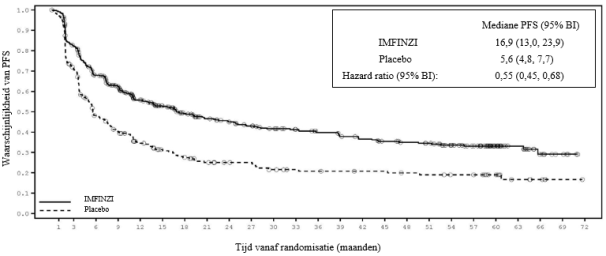
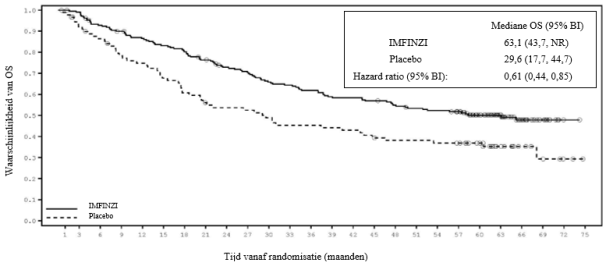
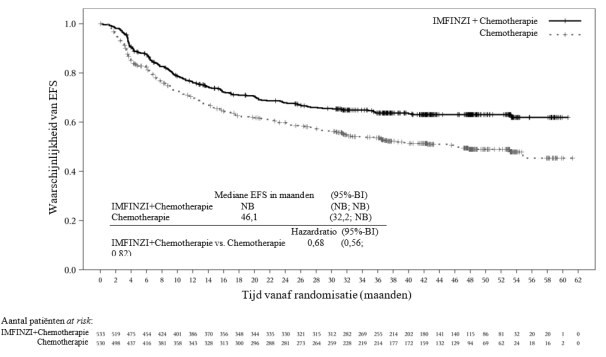
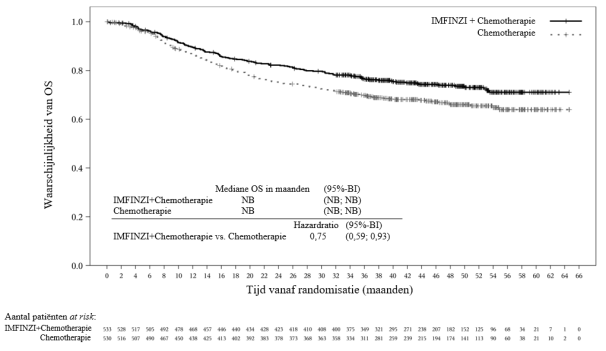
IMFINZI in combinatie met platinabevattende chemotherapie als neoadjuvante behandeling, gevolgd door IMFINZI-monotherapie als adjuvante behandeling, is geïndiceerd voor de behandeling van volwassenen met resectabel NSCLC met een hoog risico op recidief en geen EGFR-mutaties of ALK-herschikkingen (zie rubriek 5.1 voor de selectiecriteria).
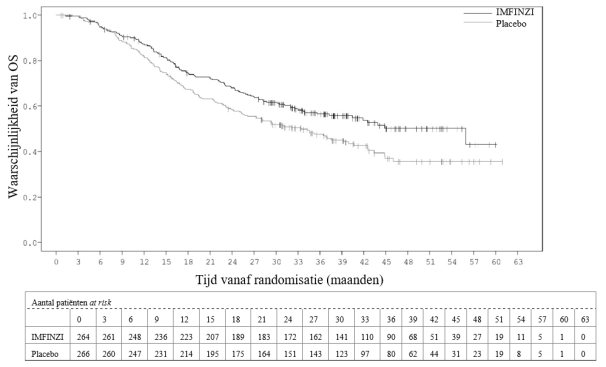
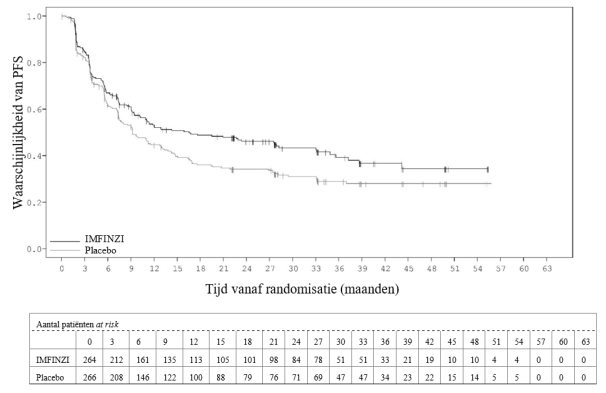
IMFINZI als monotherapie is geïndiceerd voor de behandeling van lokaal gevorderde, irresectabele niet‑kleincellige longkanker (non‑small‑cell lung cancer ‑ NSCLC) in volwassenen bij wie de tumoren PD‑L1 tot expressie brengen op ≥ 1% van de tumorcellen en bij wie de ziekte geen progressie heeft vertoond na platinabevattende chemotherapie met radiotherapie (RT) (zie rubriek 5.1).
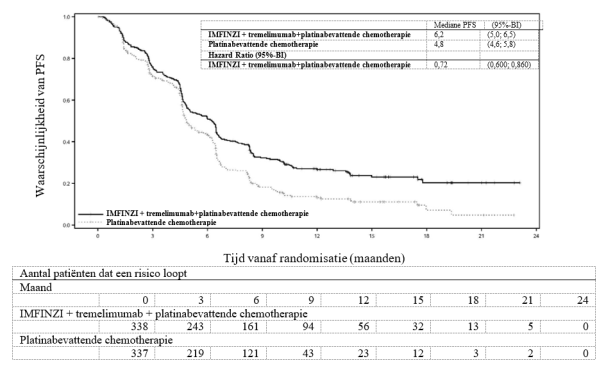
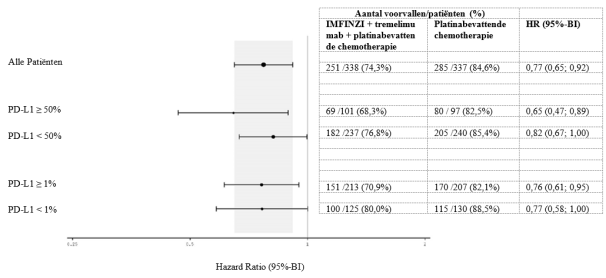
IMFINZI in combinatie met tremelimumab en platinabevattende chemotherapie is geïndiceerd voor de eerstelijnsbehandeling van volwassenen met gemetastaseerde NSCLC zonder sensibiliserende EGFR‑mutaties of ALK‑positieve mutaties.
Kleincellige longkanker (SCLC)
IMFINZI als monotherapie is geïndiceerd voor de behandeling van volwassenen met kleincellige longkanker in een beperkt stadium (LS-SCLC) bij wie de ziekte geen progressie heeft vertoond na platinabevattende chemotherapie met radiotherapie.
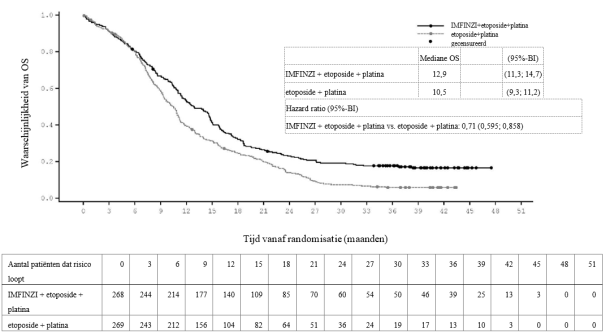
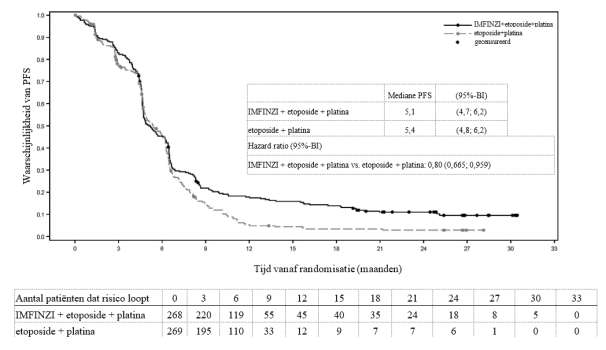
IMFINZI in combinatie met etoposide en carboplatine of cisplatine is geïndiceerd voor de eerstelijnsbehandeling van volwassenen met kleincellige longkanker in gevorderd stadium (extensive‑stage small cell lung cancer, ES-SCLC).
Galwegkanker (BTC)
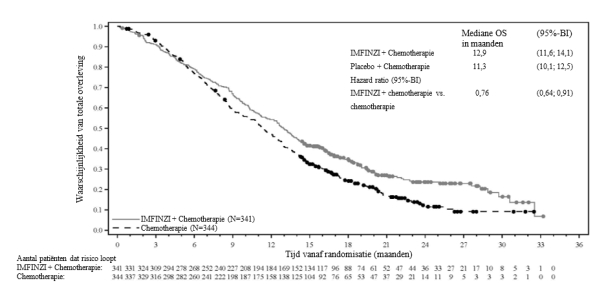
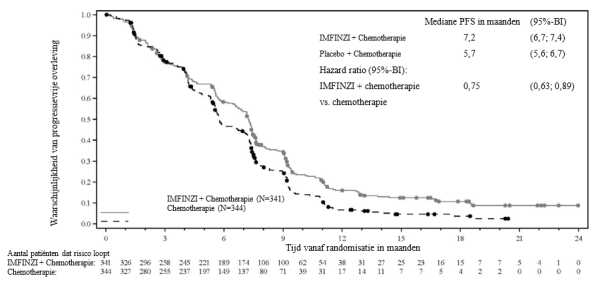
IMFINZI in combinatie met gemcitabine en cisplatine is geïndiceerd voor de eerstelijnsbehandeling van volwassenen met irresectabele of gemetastaseerde galwegkanker (biliary tract cancer, BTC).
Hepatocellulair carcinoom (HCC)
IMFINZI als monotherapie is geïndiceerd voor de eerstelijnsbehandeling van volwassenen met gevorderd of irresectabel hepatocellulair carcinoom (HCC).
IMFINZI in combinatie met tremelimumab is geïndiceerd voor de eerstelijnsbehandeling van volwassenen met gevorderd of irresectabel hepatocellulair carcinoom (HCC).
Endometriumcarcinoom
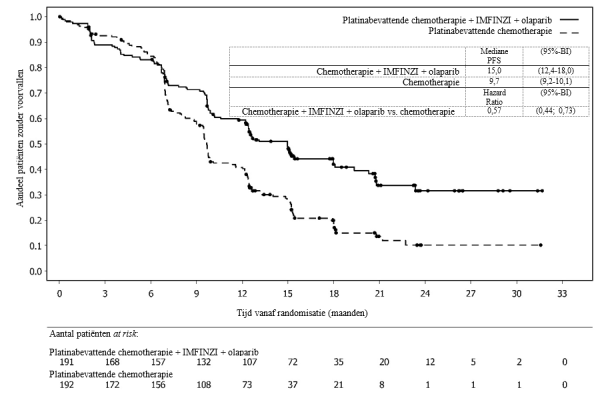
IMFINZI in combinatie met carboplatine en paclitaxel is geïndiceerd voor de eerstelijnsbehandeling van volwassenen met primair gevorderd of recidiverend endometriumcarcinoom die in aanmerking komen voor systemische therapie, gevolgd door onderhoudsbehandeling met:
- IMFINZI als monotherapie bij endometriumcarcinoom met een ‘mismatch repair’‑deficiëntie (dMMR)
- IMFINZI in combinatie met olaparib bij endometriumcarcinoom dat ‘mismatch repair’‑proficiënt (pMMR) is.
Spierinvasieve blaaskanker (MIBC)
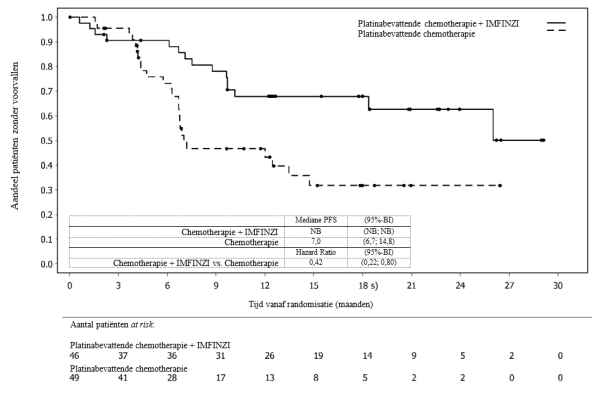
IMFINZI in combinatie met gemcitabine en cisplatine als neoadjuvante behandeling, gevolgd door IMFINZI-monotherapie als adjuvante behandeling na radicale cystectomie, is geïndiceerd voor de behandeling van volwassenen met resectabele spierinvasieve blaaskanker (Muscle Invasive Bladder Cancer - MIBC).
4.2 Dosering en wijze van toediening
De behandeling moet worden gestart en gecontroleerd door een arts met ervaring in de behandeling van kanker.
PD‑L1‑onderzoek voor patiënten met lokaal gevorderde NSCLC
Patiënten met lokaal gevorderde NSCLC moeten geëvalueerd worden voor behandeling op basis van de tumorexpressie van PD‑L1 bevestigd door een gevalideerde test (zie rubriek 5.1).
MMR-testen voor patiënten met endometriumcarcinoom
Patiënten met endometriumcarcinoom moeten geëvalueerd worden voor behandeling op basis van de tumor-MMR-status, bevestigd door een gevalideerde test (zie rubriek 5.1).
Dosering
De aanbevolen dosis voor IMFINZI‑monotherapie en IMFINZI combinatietherapie wordt getoond in tabel 1. IMFINZI wordt toegediend als een intraveneuze infusie gedurende 1 uur.
Wanneer IMFINZI wordt toegediend in combinatie met andere therapeutische middelen, raadpleeg dan de samenvatting van de productkenmerken (SPC) van deze therapeutische middelen voor meer informatie.
Tabel 1. Aanbevolen dosis IMFINZI monotherapie en combinatietherapie
Indicatie | Aanbevolen dosis IMFINZI | Duur van de behandeling |
Monotherapie |
|
|
Lokaal gevorderde NSCLC | 10 mg/kg elke 2 weken of 1.500 mg elke 4 wekena | Tot ziekteprogressie, onaanvaardbare toxiciteit of maximaal 12 maandenb |
LS-SCLC | 1.500 mg elke 4 wekena | Tot ziekteprogressie, onaanvaardbare toxiciteit of maximaal 24 maanden |
HCC | 1.500 mg elke 4 wekena | Tot ziekteprogressie of onaanvaardbare toxiciteit |
Combinatietherapie |
|
|
Resectabel NSCLC | 1.500 mgc in combinatie met platinabevattende chemotherapie elke 3 weken gedurende maximaal 4 cycli voorafgaand aan een operatie, | Neoadjuvante fase: tot ziekteprogressie die definitieve chirurgie uitsluit of tot onaanvaardbare toxiciteit. |
Gemetastaseerde NSCLC | Tijdens platinachemotherapie: | Tot ziekteprogressie of onaanvaardbare toxiciteit |
ES‑SCLC | 1.500 mgh in combinatie met chemotherapie elke 3 weken (21 dagen) gedurende 4 cycli, | Tot ziekteprogressie of onaanvaardbare toxiciteit |
BTC | 1.500 mgi in combinatie met chemotherapie elke 3 weken (21 dagen) tot maximaal 8 cycli, | Tot ziekteprogressie of onaanvaardbare toxiciteit |
HCC | IMFINZI 1.500 mgj toegediend in combinatie met 300 mgj tremelimumab als een enkele dosis bij cyclus 1/dag 1, | Tot ziekteprogressie of onaanvaardbare toxiciteit |
Endometriumcarcinoom | 1.120 mg in combinatie met carboplatine en paclitaxel elke 3 weken (21 dagen) gedurende minimaal 4 tot maximaal 6 cycli, | Tot ziekteprogressie of onaanvaardbare toxiciteit |
MIBC | 1.500 mg1 in combinatie met chemotherapie elke 3 weken gedurende 4 cycli voorafgaand aan een operatie, | Neoadjuvante fase: tot ziekteprogressie die definitieve chirurgie uitsluit of tot onaanvaardbare toxiciteit |
a Patiënten met een lichaamsgewicht van 30 kg of minder moeten dosering op basis van gewicht ontvangen equivalent aan 10 mg/kg IMFINZI elke 2 weken of 20 mg/kg elke 4 weken als monotherapie tot het gewicht toeneemt tot boven 30 kg.
b Het wordt aanbevolen om bij klinisch stabiele patiënten met initieel bewijs van ziekteprogressie door te gaan met de behandeling totdat ziekteprogressie is bevestigd.
c Patiënten met resectabel NSCLC met een lichaamsgewicht van 30 kg of minder moeten op basis van gewicht een dosering IMFINZI ontvangen van 20 mg/kg. In combinatie met platinabevattende chemotherapie moet dit een dosis met 20 mg/kg elke 3 weken (21 dagen) voorafgaand aan een operatie zijn, gevolgd door monotherapie met 20 mg/kg elke 4 weken na een operatie tot het gewicht toeneemt tot meer dan 30 kg.
d Patiënten met gemetastaseerde NSCLC met een lichaamsgewicht van 30 kg of minder moeten een dosering op basis van gewicht ontvangen. Zij moeten een dosering van 20 mg/kg IMFINZI krijgen tot het gewicht toeneemt tot boven 30 kg. Patiënten met een lichaamsgewicht van 34 kg of minder moeten een dosering op basis van gewicht ontvangen. Zij moeten een dosering van 1 mg/kg tremelimumab krijgen totdat het gewicht toeneemt tot boven 34 kg.
e Overweeg een onderhoudstoediening met pemetrexed voor patiënten met niet‑plaveiselceltumoren die tijdens de platinabevattende chemotherapiefase zijn behandeld met pemetrexed en carboplatine/cisplatine.
f In het geval van uitstellen van dosering(en) kan na week 16 een vijfde dosis tremelimumab worden gegeven, naast IMFINZI.
g Als patiënten minder dan 4 cycli van de platinabevattende chemotherapie krijgen, dan moeten de resterende cycli van tremelimumab (tot een totaal van 5) naast IMFINZI worden gegeven na de platinachemotherapiefase
h Patiënten met ES-SCLC met een lichaamsgewicht van 30 kg of minder moeten dosering op basis van gewicht ontvangen. Zij moeten een dosering van 20 mg/kg IMFINZI krijgen. In combinatie met chemotherapie elke 3 weken (21 dagen), gevolgd door 20 mg/kg elke 4 weken als monotherapie tot het gewicht toeneemt tot boven 30 kg.
i Patiënten met BTC met een lichaamsgewicht van 36 kg of minder moeten dosering op basis van gewicht ontvangen. Zij moeten een dosering van 20 mg/kg IMFINZI krijgen in combinatie met chemotherapie elke 3 weken (21 dagen), gevolgd door 20 mg/kg elke 4 weken als monotherapie tot het gewicht toeneemt tot boven 36 kg.
j Patiënten met HCC met een lichaamsgewicht van 30 kg of minder moeten een op het gewicht gebaseerde dosering ontvangen. Zij moeten een dosering van IMFINZI 20 mg/kg krijgen tot het gewicht toeneemt tot boven 30 kg. Patiënten met een lichaamsgewicht van 40 kg of minder moeten een op het gewicht gebaseerde dosering ontvangen. Zij moeten een dosering van tremelimumab 4 mg/kg krijgen tot het gewicht toeneemt tot boven 40 kg.
k Patiënten met endometriumcarcinoom met een lichaamsgewicht van 30 kg of minder moeten tijdens de onderhoudsfase een op gewicht gebaseerde dosering krijgen die gelijkwaardig is aan IMFINZI 20 mg/kg, tot het gewicht toeneemt tot boven 30 kg.
l MIBC-patiënten met een lichaamsgewicht van 30 kg of minder moeten dosering op basis van gewicht ontvangen. Zij moeten een dosering van 20 mg/kg IMFINZI krijgen.
Dosisescalatie of ‑vermindering wordt niet aanbevolen. Tijdelijk of permanent stoppen met de behandeling kan vereist zijn op basis van individuele veiligheid en verdraagbaarheid, zie tabel 2.
Richtlijnen voor de behandeling van immuungemedieerde en niet‑immuungemedieerde bijwerkingen worden beschreven in tabel 2 (raadpleeg rubriek 4.4 voor meer behandelingsaanbevelingen, monitoring- en evaluatie-informatie).
Tabel 2. Behandelingswijzigingen voor IMFINZI of IMFINZI in combinatie met andere producten
Bijwerkingen | Ernsta | Behandelingswijziging |
Immuungemedieerde bijwerkingen | ||
Immuungemedieerde pneumonitis/interstitiële longziekte | Graad 2 | Stop tijdelijk |
Graad 3 of 4 | Stop permanent | |
Immuungemedieerde hepatitis | ALAT of ASAT > 3 ‑ ≤ 5 x ULN of bilirubine totaal > 1,5 ‑ ≤ 3 x ULN | Stop tijdelijk |
ALAT of ASAT > 5 ‑ ≤ 10 x ULN | Stop IMFINZI tijdelijk en stop permanent met tremelimumab (indien van toepassing) | |
Gelijktijdig ALAT of ASAT > 3 x ULN en bilirubine totaal > 2 x ULNb | Stop permanent | |
ALAT of ASAT > 10 x ULN of bilirubine totaal > 3 x ULN | ||
Immuungemedieerde hepatitis bij HCC (of secundaire tumorbetrokkenheid van de lever met afwijkende waarden bij baseline)c | ALAT of ASAT > 2,5 ‑ ≤ 5 x BLV en ≤ 20 x ULN | Stop tijdelijk |
ALAT of ASAT > 5 ‑ 7 x BLV en ≤ 20 x ULN | Stop IMFINZI tijdelijk en stop tremelimumab permanent (indien van toepassing) | |
ALAT of ASAT > 7 x BLV of > 20 ULN wat zich het eerst voordoet of bilirubine > 3 X ULN | Stop permanent | |
Immuungemedieerde colitis of diarree | Graad 2 | Stop tijdelijk |
Graad 3 voor IMFINZI monotherapie | Stop tijdelijk | |
Graad 3 voor IMFINZI + tremelimumab | Stop tremelimumabd permanent | |
Graad 4 | Stop permanent | |
Intestinale perforatiee | Elke graad | Stop permanent |
Immuungemedieerde hyperthyreoïdie, thyreoïditis | Graad 2‑4 | Stop tijdelijk tot klinisch stabiel |
Immuungemedieerde | Graad 2‑4 | Geen wijzigingen |
Immuungemedieerde | Graad 2‑4 | Stop tijdelijk tot klinisch stabiel |
Immuungemedieerde | Graad 2‑4 | Geen wijzigingen |
Immuungemedieerde nefritis | Graad 2 met serumcreatinine > 1,5 ‑ 3 x (ULN of baseline) | Stop tijdelijk |
Graad 3 met serumcreatinine > 3 x baseline of > 3‑6 x ULN; graad 4 met serumcreatinine > 6 x ULN | Stop permanent | |
Immuungemedieerde rash of dermatitis (inclusief pemfigoïd) | Graad 2 gedurende > 1 week | Stop tijdelijk |
Graad 3 | ||
Graad 4 | Stop permanent | |
Immuungemedieerde myocarditis | Graad 2‑4 | Stop permanent |
Immuungemedieerde myositis/polymyositis/rabdomyolyse | Graad 2 of 3 | Stop tijdelijkf |
Graad 4 | Stop permanent | |
Infusiegerelateerde reacties | Graad 1 of 2 | Onderbreek of verlaag de infusiesnelheid |
Graad 3 of 4 | Stop permanent | |
Infectie | Graad 3 of 4 | Stop tijdelijk tot klinisch stabiel |
Immuungemedieerde myasthenia gravis | Graad 2‑4 | Stop permanent |
Immuungemedieerde myelitis transversa | Elke graad | Stop permanent |
Immuungemedieerde meningitis | Graad 2 | Stop tijdelijk |
Graad 3 of 4 | Stop permanent | |
Immuungemedieerde encefalitis | Graad 2‑4 | Stop permanent |
Immuungemedieerd Guillain-Barré-syndroom | Graad 2‑4 | Stop permanent |
Andere immuungemedieerde bijwerkingeng | Graad 2 of 3 | Stop tijdelijk |
Graad 4 | Stop permanent | |
Niet-immuungemedieerde bijwerkingen | ||
Zuivere rode bloedcelaplasie (PRCA)h | Elke graad | Stop permanent |
Andere niet‑immuungemedieerde bijwerkingen | Graad 2 en 3 | Stop tijdelijk tot ≤ graad 1 of herstel naar baseline |
Graad 4 | Stop permanenti | |
a Common Terminology Criteria for Adverse Events, versie 4.03. ALAT: alanineaminotransferase; ASAT: aspartaataminotransferase; ULN: bovengrens van normaal. BLV (baseline value): baselinewaarde.
b Volg voor patiënten met een alternatieve oorzaak de aanbevelingen voor ASAT‑ of ALAT‑verhogingen zonder gelijktijdige verhogingen van bilirubine.
c Als ASAT en ALAT bij baseline lager dan of gelijk aan de ULN zijn bij patiënten met leverbetrokkenheid, durvalumab tijdelijk of permanent stopzetten op basis van de aanbevelingen voor hepatitis zonder leverbetrokkenheid.
d Stop permanent met tremelimumab bij graad 3; de behandeling met durvalumab kan echter worden hervat zodra het voorval is verdwenen.
e Bijwerking wordt alleen in verband gebracht met IMFINZI in combinatie met tremelimumab.
f Stop permanent met IMFINZI indien de bijwerking niet binnen 30 dagen verbetert tot ≤ graad 1 of als er tekenen zijn van respiratoire insufficiëntie.
g Omvat immune trombocytopenie, pancreatitis, immuungemedieerde artritis, uveïtis, cystitis niet-infectieus en polymyalgia rheumatica.
h Bijwerking wordt alleen in verband gebracht met gevallen waarin olaparib als onderhoudsbehandeling wordt gebruikt in combinatie met IMFINZI, na een behandeling met IMFINZI in combinatie met platinabevattende chemotherapie.
i Met uitzondering van laboratoriumafwijkingen van graad 4, waarbij de beslissing om de behandeling te stoppen gebaseerd moet zijn op de begeleidende klinische tekenen/symptomen en het klinische oordeel.
Op basis van de ernst van de bijwerking moet IMFINZI en/of tremelimumab tijdelijk worden gestopt en moeten corticosteroïden worden toegediend (raadpleeg rubriek 4.4). Na het tijdelijk stoppen kan binnen 12 weken weer met IMFINZI en/of tremelimumab worden begonnen als de bijwerkingen zijn verbeterd tot ≤ graad 1 en de dosis corticosteroïd is verlaagd tot ≤ 10 mg prednison of equivalent per dag. IMFINZI en tremelimumab moet permanent gestopt worden bij terugkerende immuungemedieerde bijwerkingen van graad 3 (ernstig) en voor alle immuungemedieerde bijwerkingen van graad 4 (levensbedreigend), behalve voor endocrinopathieën die onder controle worden gehouden met hormoonvervanging.
Speciale populaties
Ouderen
Er is geen dosisaanpassing nodig bij oudere patiënten (≥ 65 jaar) (zie rubriek 5.1).
Nierinsufficiëntie
Dosisaanpassing van IMFINZI wordt niet aanbevolen bij patiënten met lichte of matige nierinsufficiëntie. De gegevens van patiënten met ernstige nierinsufficiëntie zijn te beperkt om conclusies te kunnen trekken over deze populatie (zie rubriek 5.2).
Leverinsufficiëntie
Dosisaanpassing van IMFINZI wordt niet aanbevolen bij patiënten met lichte of matige leverinsufficiëntie. Gegevens van patiënten met ernstige leverinsufficiëntie zijn te beperkt om conclusies te kunnen trekken over deze populatie (zie rubriek 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van IMFINZI bij kinderen en adolescenten onder 18 jaar zijn niet vastgesteld met betrekking tot NSCLC, SCLC, BTC en HCC. Er zijn geen gegevens beschikbaar. Buiten de goedgekeurde indicaties is IMFINZI in combinatie met tremelimumab onderzocht bij kinderen van 1 tot en met 17 jaar met neuroblastoom, solide tumor en sarcoom. Uit de resultaten van het onderzoek kon echter niet worden geconcludeerd dat de voordelen van dergelijk gebruik opwegen tegen de risico’s. De momenteel beschikbare gegevens worden beschreven in rubrieken 5.1 en 5.2.
Wijze van toediening
IMFINZI is bestemd voor intraveneus gebruik. Het moet worden toegediend als een intraveneuze infusie‑oplossing gedurende 1 uur (zie rubriek 6.6).
Voor instructies over verdunning van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6.
IMFINZI in combinatie met chemotherapie
Wanneer IMFINZI in combinatie met chemotherapie wordt toegediend, dien dan op dezelfde dag IMFINZI toe voorafgaand aan chemotherapie.
IMFINZI in combinatie met tremelimumab en platinabevattende chemotherapie
Wanneer IMFINZI wordt gegeven in combinatie met tremelimumab en platinabevattende chemotherapie, wordt op de dag van toediening eerst tremelimumab gegeven, gevolgd door IMFINZI en vervolgens platinabevattende chemotherapie.
Wanneer in week 16 IMFINZI wordt gegeven in combinatie met een vijfde dosis tremelimumab en onderhoudstherapie met pemetrexed, dan wordt op de dag van toediening eerst tremelimumab gegeven, gevolgd door IMFINZI en vervolgens onderhoudstherapie met pemetrexed.
IMFINZI, tremelimumab en platinabevattende chemotherapie worden toegediend als afzonderlijke intraveneuze infusies. IMFINZI en tremelimumab worden elk gedurende 1 uur gegeven. Voor platinabevattende chemotherapie, raadpleeg de SmPC voor toedieningsinformatie. Voor onderhoudstherapie met pemetrexed, raadpleeg de SmPC voor toedieningsinformatie. Voor elke infusie moeten afzonderlijke infuuszakken en filters worden gebruikt.
Tijdens cyclus 1 moet tremelimumab worden gevolgd door IMFINZI vanaf ongeveer 1 uur (maximaal 2 uur) na het einde van de tremelimumab‑infusie. De infusie met platinabevattende chemotherapie moet ongeveer 1 uur (maximaal 2 uur) na het einde van de infusie met IMFINZI beginnen. Als er tijdens cyclus 1 geen klinisch significante problemen zijn, dan kunnen naar oordeel van de arts, de volgende cycli van IMFINZI onmiddellijk na tremelimumab worden gegeven en kan de periode tussen het einde van de infusie met IMFINZI en het begin van de chemotherapie worden teruggebracht tot 30 minuten.
IMFINZI in combinatie met tremelimumab
Wanneer IMFINZI in combinatie met tremelimumab wordt toegediend bij uHCC, dien dan op dezelfde dag tremelimumab toe voorafgaand aan IMFINZI. IMFINZI en tremelimumab worden toegediend als afzonderlijke intraveneuze infusies. Raadpleeg de SmPC voor informatie over de dosering van tremelimumab.
4.3 Contra‑indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstof(fen).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
IMFINZI als monotherapie
De veiligheid van IMFINZI als monotherapie is gebaseerd op samengevoegde gegevens van 4.642 patiënten met verschillende tumortypes. IMFINZI werd toegediend in een dosis van 10 mg/kg elke 2 weken, 20 mg/kg elke 4 weken of 1.500 mg elke 4 weken. De meest voorkomende (> 10%) bijwerkingen waren hoest/productieve hoest (18,1%), diarree (15,1%), rash (15,0%), artralgie (12,4%), pyrexie (12,5%), buikpijn (11,8%), infecties van de bovenste luchtwegen (11,8%), pruritus (11,1%) en hypothyreoïdie (11,6%). De meest voorkomende (> 2%) bijwerkingen van NCI CTCAE graad ≥ 3 waren pneumonie (3,4%) en aspartaataminotransferase verhoogd/alanineaminotransferase verhoogd (2,5%).
IMFINZI werd stopgezet vanwege bijwerkingen bij 3,9% van de patiënten. De meest voorkomende bijwerkingen die leidden tot stopzetting van de behandeling waren pneumonitis (1,1%) en pneumonie (0,8%).
IMFINZI werd uitgesteld of onderbroken vanwege bijwerkingen bij 13,1% van de patiënten. De meest voorkomende bijwerkingen die leidden tot uitstel of onderbreking van de dosering waren pneumonie (2,3%) en aspartaataminotransferase verhoogd/alanineaminotransferase verhoogd (2,0%).
De veiligheid van IMFINZI als monotherapie bij patiënten die worden behandeld voor HCC is gebaseerd op gegevens van 492 patiënten en kwam overeen met het algehele veiligheidsprofiel in de IMFINZI-monotherapiepool (N = 4.642). De meest voorkomende (> 10%) bijwerkingen waren verhoogd ASAT/verhoogd ALAT (20,3%), buikpijn (17,9%), diarree (15,9%), pruritus (15,4%) en rash (15,2%). De meest voorkomende (> 2%) bijwerkingen van graad ≥ 3 waren verhoogd ASAT/verhoogd ALAT (8,1%) en buikpijn (2,2%).
IMFINZI werd stopgezet vanwege bijwerkingen bij 3,7% van de patiënten. De meest voorkomende bijwerkingen die leidden tot stopzetting van de behandeling waren verhoogd ASAT/verhoogd ALAT (0,8%) en hepatitis (0,6%).
IMFINZI werd uitgesteld of onderbroken vanwege bijwerkingen bij 11,6% van de patiënten. De meest voorkomende bijwerking die leidde tot uitstel of onderbreking van de dosis was verhoogd ASAT/verhoogd ALAT (5,9%).
IMFINZI in combinatie met chemotherapie
De veiligheid van IMFINZI in combinatie met chemotherapie is gebaseerd op samengevoegde gegevens van 1.769 patiënten uit 5 onderzoeken (TOPAZ‑1, CASPIAN, DUO-E, AEGEAN en NIAGARA). De meest voorkomende (> 10%) bijwerkingen waren neutropenie (41,7%), anemie (40,8%), nausea (40,1%), vermoeidheid (39,6%), constipatie (29,7%), verminderde eetlust (22,2%), trombocytopenie (21,5%), alopecia (19,7%), rash (19,7%), diarree (18,2%), braken (16,8%), buikpijn (16,7%), neuropathie perifeer (16,3%), leukopenie (14,8%), pyrexie (14,0%), pruritus (13,0%), hypothyreoïdie (11,9%), artralgie (11,5%), hoest/productieve hoest (11,0%) en aspartaataminotransferase verhoogd of alanineaminotransferase verhoogd (10,7%). De meest voorkomende (> 2%) bijwerkingen van NCI CTCAE graad ≥ 3 waren neutropenie (25,2%), anemie (13,7%), trombocytopenie (6,9%), leukopenie (4,5%), vermoeidheid (2,8%), pneumonie (2,4%) en febriele neutropenie (2,1%).
IMFINZI werd stopgezet vanwege bijwerkingen bij 6,2% van de patiënten. De meest voorkomende bijwerkingen die leidden tot stopzetting van de behandeling waren rash (0,7%), pneumonitis (0,7%) en vermoeidheid (0,6%).
IMFINZI werd uitgesteld of onderbroken vanwege bijwerkingen bij 29,2% van de patiënten. De meest voorkomende bijwerkingen die leidden tot uitstel of onderbreking van de toediening waren neutropenie (12,6%), trombocytopenie (4,5%), anemie (3,9%) en leukopenie (2,1%).
IMFINZI in combinatie met tremelimumab 75 mg en platinabevattende chemotherapie
De veiligheid van IMFINZI in combinatie met tremelimumab 75 mg en chemotherapie is gebaseerd op gegevens bij 330 patiënten met gemetastaseerde NSCLC. De meest voorkomende (> 20%) bijwerkingen waren anemie (49,7%), nausea (41,5%), neutropenie (41,2%), vermoeidheid (36,1%), rash (25,8%), trombocytopenie (24,5%) en diarree (21,5%). De meest voorkomende (> 2%) bijwerkingen van NCI CTCAE graad ≥ 3 waren neutropenie (23,9%), anemie (20,6%), pneumonie (9,4%), trombocytopenie (8,2%), leukopenie (5,5%), vermoeidheid (5,2%), lipase verhoogd (3,9%), amylase verhoogd (3,6%), febriele neutropenie (2,4%), colitis (2,1%) en aspartaataminotransferase verhoogd/alanineaminotransferase verhoogd (2,1%).
IMFINZI werd stopgezet vanwege bijwerkingen bij 8,5% van de patiënten. De meest voorkomende bijwerkingen die leidden tot stopzetting van de behandeling waren pneumonie (2,1%) en colitis (1,2%).
IMFINZI werd onderbroken als gevolg van bijwerkingen bij 49,4% van de patiënten. De meest voorkomende bijwerkingen die leidden tot het onderbreken van de behandeling waren neutropenie (16,1%), anemie (10,3%), trombocytopenie (7,3%), leukopenie (5,8%), pneumonie (5,2%), aspartaataminotransferase verhoogd / alanineaminotransferase verhoogd (4,8%), colitis (3,3%) en pneumonitis (3,3%).
IMFINZI in combinatie met tremelimumab 300 mg
De veiligheid van IMFINZI gegeven in combinatie met een enkele dosis tremelimumab 300 mg is gebaseerd op gepoolde gegevens (HCC‑pool) bij 462 HCC‑patiënten uit het HIMALAYA‑onderzoek en een ander onderzoek bij HCC‑patiënten, Studie 22. De meest voorkomende (> 10%) bijwerkingen waren rash (32,5%), pruritus (25,5%), diarree (25,3%), buikpijn (19,7%), aspartaataminotransferase verhoogd/alanineaminotransferase verhoogd (18,0%), pyrexie (13,9%), hypothyreoïdie (13,0%), hoesten/productieve hoest (10,8%), perifeer oedeem (10,4%) en lipase verhoogd (10,0%) (zie tabel 4). De meest voorkomende ernstige bijwerkingen (NCI CTCAE graad ≥ 3) waren aspartaataminotransferase verhoogd/alanineaminotransferase verhoogd (8,9%), lipase verhoogd (7,1%), amylase verhoogd (4,3%) en diarree (3,9%).
De meest voorkomende ernstige bijwerkingen waren colitis (2,6%), diarree (2,4%), pneumonie (2,2%) en hepatitis (1,7%).
De frequentie van stopzetting van de behandeling vanwege bijwerkingen was 6,5%. De meest voorkomende bijwerkingen die leidden tot stopzetting van de behandeling waren hepatitis (1,5%) en aspartaataminotransferase verhoogd/alanineaminotransferase verhoogd (1,3%).
De ernst van de bijwerkingen werd beoordeeld op basis van de CTCAE, met definitie graad 1 = licht, graad 2 = matig ernstig, graad 3 = ernstig, graad 4 = levensbedreigend en graad 5 = overlijden.
IMFINZI in combinatie met platinabevattende chemotherapie gevolgd door IMFINZI in combinatie met olaparib 300 mg tweemaal daags
De veiligheid van IMFINZI gegeven in combinatie met platinabevattende chemotherapie gevolgd door IMFINZI in combinatie met olaparib 300 mg tweemaal daags is gebaseerd op gegevens van 238 patiënten met endometriumcarcinoom. De meest voorkomende (> 20%) bijwerkingen waren anemie (61,8%), misselijkheid (54,6%), vermoeidheid (54,2%), perifere neuropathie (51,7%), alopecia (50,8%), neutropenie (39,5%), constipatie (32,8%), trombocytopenie (29,8%), diarree (28,2%), braken (25,6%), artralgie (24,4%), rash (23,5%), buikpijn (23,5%), verminderde eetlust (23,1%) en leukopenie (20,2%).
De meest voorkomende (> 2%) NCI CTCAE graad ≥ 3 bijwerkingen waren neutropenie (25,2%), anemie (23,5%), leukopenie (6,7%), trombocytopenie (5,9%), vermoeidheid (5,5%), febriele neutropenie (3,4%), misselijkheid (2,9%), aspartaataminotransferase verhoogd / alanineaminotransferase verhoogd (2,9%) en perifere neuropathie (2,5%).
IMFINZI werd stopgezet bij 4,6% van de patiënten. De meest voorkomende bijwerking die leidde tot stopzetting van de behandeling was pneumonitis (1,7%).
IMFINZI werd onderbroken bij 38,2% van de patiënten. De meest voorkomende bijwerkingen die tot onderbreking van de dosis leidden, waren anemie (13,4%), trombocytopenie (11,8%), neutropenie (10,1%), leukopenie (2,9%), hypothyreoïdie (2,1%) en infectie van de bovenste luchtwegen (2,1%).
Tabel met lijst van bijwerkingen
Tabel 3 geeft een overzicht van de incidentie van bijwerkingen van IMFINZI in de gepoolde veiligheidsgegevensset voor monotherapie (N=4.642), bij patiënten behandeld met IMFINZI in combinatie met chemotherapie (N=1.769) en bij patiënten behandeld met IMFINZI in combinatie met platinabevattende chemotherapie gevolgd door IMFINZI in combinatie met olaparib (platinabevattende chemotherapie + IMFINZI + olaparib) (N=238). Tenzij anders aangegeven, geeft tabel 4 een overzicht weer van de incidentie van bijwerkingen voor patiënten behandeld met IMFINZI in combinatie met tremelimumab 75 mg en platinabevattende chemotherapie in het POSEIDON‑onderzoek (N=330) en voor patiënten behandeld met IMFINZI in combinatie met een enkele dosis tremelimumab 300 mg in de HCC‑pool (N=462). Bijwerkingen worden vermeld volgens hun systeem/orgaanklasse in MedDRA. Binnen elke systeem/orgaanklasse worden de bijwerkingen gepresenteerd naar afnemende frequentie. De overeenkomstige frequentiecategorie voor elke bijwerking wordt als volgt gedefinieerd: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); zelden (≥ 1/10.000, < 1/1.000); zeer zelden (< 1/10.000); niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen elke frequentiegroep worden de bijwerkingen gerangschikt naar afnemende ernst.
Tabel 3. Bijwerkingen bij patiënten die werden behandeld met IMFINZI
| IMFINZI‑monotherapie | IMFINZI in combinatie met chemotherapie | Platinabevattende chemotherapie + IMFINZI + olaparib* |
Infecties en parasitaire aandoeningen | |||
Zeer vaak | Infectie van de bovenste luchtwegena |
| Infectie van de bovenste luchtwegena |
Vaak | Pneumonieb,c, Influenza, Orale candidiasis, Tand‑ en oralewekedeleninfectiesd | Pneumonieb,c, Infecties van de bovenste luchtwegena, Tand‑ en oralewekedelen infectiesd | Pneumonie, Orale candidiasis, Tand‑ en oralewekedeleninfectiesd |
Soms |
| Orale candidiasis, Influenza | Influenza |
Bloed‑ en lymfestelselaandoeningen | |||
Zeer vaak |
| Anemie, Leukopeniee, Neutropenief, Trombocytopenieg | Anemieh, Leukopenieh, Neutropenieh, Trombocytopenieh |
Vaak |
| Febriele neutropenie | Zuivere rode bloedcelaplasie, Febriele neutropenieh, Lymfopeniei |
Soms | Immune trombocytopeniec | Pancytopeniec | Pancytopenieh |
Zelden |
| Immune trombocytopenie |
|
Immuunsysteemaandoeningen | |||
Vaak |
|
| Overgevoeligheidi,j |
Endocriene aandoeningen | |||
Zeer vaak | Hypothyreoïdiek | Hypothyreoïdiek | Hypothyreoïdie |
Vaak | Hyperthyreoïdiel | Hyperthyreoïdiel | Hyperthyreoïdie, Thyreoïditis |
Soms | Thyreoïditism, Bijnierschorsinsufficiëntie, Hypofysitis/Hypopituïtarisme, Type 1 diabetes mellitus | Bijnierschorsinsufficiëntie, Diabetes mellitus type 1, Hypofysitis/Hypopituïtarisme, Thyreoïditism |
|
Zelden | Diabetes insipidus |
|
|
Oogaandoeningen | |||
Soms |
| Uveïtis | Uveïtis |
Zelden | Uveïtis |
|
|
Voedings‑ en stofwisselingsstoornissen |
| ||
Zeer vaak |
| Verminderde eetlust | Verminderde eetlusth |
Zenuwstelselaandoeningen | |||
Zeer vaak |
| Perifere neuropathien | Perifere neuropathie, Duizeligheidi, Hoofdpijni, Dysgeusiei,o |
Soms | Myasthenia gravis, Encefalitisc,p | Myasthenia gravis |
|
Zelden | Meningitis | Encefalitisp |
|
Niet bekend | Guillain‑Barré‑syndroom, Myelitis transversaq |
|
|
Bloedvataandoeningen | |||
Vaak |
|
| Veneuze trombo-embolische voorvalleni,r |
Hartaandoeningen | |||
Soms | Myocarditis | Myocarditisc |
|
Ademhalingsstelsel‑, borstkas‑ en mediastinumaandoeningen | |||
Zeer vaak | Hoesten/productieve hoest | Hoesten/productieve hoest | Hoesten/productieve hoest, Dyspneui,s |
Vaak | Pneumonitisc,t, Dysfonie | Pneumonitisc,t, Dysfonie | Pneumonitis, Dysfonie |
Soms | Interstitiële longziekte | Interstitiële longziektec | Interstitiële longziekte |
Maagdarmstelselaandoeningen | |||
Zeer vaak | Diarree, Buikpijnu | Diarree, Buikpijnu, Constipatie, Nausea, Braken | Diarree, Buikpijnu, Constipatieh, Nauseah, Brakenh, Stomatitish |
Vaak |
| Stomatitisv, Colitisw | Dyspepsiei, Colitisw |
Soms | Colitisc,w, Pancreatitisx | Pancreatitisx |
|
Zelden | Coeliakieq, Exocriene pancreasinsufficiëntie | Coeliakieq, Exocriene pancreasinsufficiëntie |
|
Lever‑ en galaandoeningen | |||
Zeer vaak |
| Aspartaataminotransferase verhoogd of Alanineaminotransferase verhoogdy | Aspartaataminotransferase verhoogd of Alanineaminotransferase verhoogd |
Vaak | Hepatitisc,z Aspartaataminotransferase verhoogd of Alanineaminotransferase | Hepatitisc,z |
|
Soms |
|
| Hepatitisz |
Huid‑ en onderhuidaandoeningen | |||
Zeer vaak | Rashaa, Pruritus | Rashaa, Alopecia, Pruritus | Rashaa, Alopeciah, Pruritus |
Vaak | Nachtzweten | Dermatitis | Dermatitisbb |
Soms | Dermatitis, Psoriasis, Pemfigoïdcc | Pemfigoïdcc, Nachtzweten, Psoriasis | Nachtzweten |
Skeletspierstelsel‑ en bindweefselaandoeningen | |||
Zeer vaak | Artralgie | Artralgie | Artralgieh, Myalgie |
Vaak | Myalgie | Myalgie |
|
Soms | Myositisdd, Immuungemedieerde artritisee | Immuungemedieerde artritisee, Myositisdd | Myositis |
Zelden | Polymyositisff | Polymyalgia rheumaticagg | Polymyalgia rheumaticagg |
Nier‑ en urinewegaandoeningen | |||
Zeer Vaak |
|
| Bloed creatinine verhoogd |
Vaak | Bloed creatinine verhoogd, Dysurie | Bloed creatinine verhoogd, Dysurie | Dysurie |
Soms | Nefritishh, Cystitis niet‑infectieus | Cystitis niet‑infectieus, Nefritishh | Cystitis niet‑infectieush |
Algemene aandoeningen en toedieningsplaatsstoornissen | |||
Zeer vaak | Pyrexie | Pyrexie, Vermoeidheidii | Pyrexie, Vermoeidheidh, Perifeer oedeem jj |
Vaak | Perifeer oedeemjj | Perifeer oedeemjj |
|
Letsels, intoxicaties en verrichtingscomplicaties | |||
Vaak | Infusiegerelateerde reactiekk | Infusiegerelateerde reactiekk | Infusiegerelateerde reactie |
De frequenties van bijwerkingen kunnen mogelijk niet volledig worden toegeschreven aan durvalumab alleen, maar kunnen bijdragen bevatten van de onderliggende ziekte of van andere geneesmiddelen die in een combinatie worden gebruikt.
* algeheel onderzoek met behandeling van maximaal zes cycli van 21 dagen met platinabevattende chemotherapie in combinatie met IMFINZI, gevolgd door IMFINZI in combinatie met olaparib.
a omvat laryngitis, nasofaryngitis, peritonsillair abces, faryngitis, rinitis, sinusitis, tonsillitis, tracheobronchitis en infectie van de bovenste luchtwegen.
b omvat Pneumocystis jiroveci‑pneumonie, pneumonie, adenovirale pneumonie, bacteriële pneumonie, cytomegalovirale pneumonie, Haemophilus‑pneumonie, pneumokokkenpneumonie, streptokokkenpneumonie, Candida‑pneumonie, Klebsiella-pneumonie en Legionella‑pneumonie.
c omvat fatale afloop.
d omvat gingivitis, orale infectie, periodontitis, dentale pulpitis, tandabces en tandinfectie.
e omvat leukopenie en een verlaagd aantal witte bloedcellen.
f omvat neutropenie en een verlaagd aantal neutrofielen.
g omvat trombocytopenie en een verlaagd aantal bloedplaatjes.
h bijwerking alleen van toepassing op bijwerkingen van chemotherapie in het DUO-E onderzoek.
i bijwerking alleen van toepassing op bijwerkingen van olaparib in het DUO-E onderzoek.
j omvat geneesmiddel overgevoeligheid en overgevoeligheid.
k omvat auto‑immune hypothyreoïdie, hypothyreoïdie, immuungemedieerde hypothyreoïdie, thyreoïd‑stimulerend hormoon in het bloed verhoogd.
l omvat hyperthyreoïdie, ziekte van Graves, immuungemedieerde hyperthyreoïdie en thyreoïd‑stimulerend hormoon in het bloed verlaagd.
m omvat auto‑immune thyreoïditis, immuungemedieerde thyreoïditis, thyreoïditis en subacute thyreoïditis.
n omvat neuropathie perifeer, paresthesie en perifere sensorische neuropathie.
o omvat dysgeusie en ageusie.
p omvat encefalitis, encefalitis auto-immuun, immuungemedieerde encefalitis en niet-infectieuze encefalitis.
q gevallen werden gerapporteerd op basis van gegevens die zijn verkregen na het in de handel brengen.
r omvat diep veneuze trombose, embolie, veneuze embolie, bekkenvene trombose, oppervlakkige veneuze trombose en trombose.
s omvat dyspneu en inspanningskortademigheid.
t omvat pneumonitis en immuungemedieerde longziekte.
u omvat buikpijn, pijn in de onderbuik, pijn in de bovenbuik en pijn in de zij.
v omvat stomatitis en slijmvliesontsteking.
w omvat colitis, enteritis, enterocolitis, immuungemedieerde enterocolitis en proctitis.
x omvat pancreatitis, acute pancreatitis en immuungemedieerde pancreatitis.
y omvat verhoogde alanineaminotransferase, verhoogde aspartaataminotransferase, verhoogde leverenzymen en verhoogde transaminases.
z omvat hepatitis, auto‑immune hepatitis, toxische hepatitis, acute hepatitis, hepatotoxiciteit, immuungemedieerde hepatitis en hepatische cytolyse.
aa omvat erythemateuze rash, gegeneraliseerde rash, maculaire rash, maculopapulaire rash, papulaire rash, pruritische rash, pustulaire rash, erytheem, eczeem en rash.
bb omvat dermatitis en immuungemedieerde dermatitis.
cc omvat pemfigoïd, bulleuze dermatitis en pemfigus. De gerapporteerde frequentie van voltooide en lopende onderzoeken is ‘soms’.
dd omvat myositis en rabdomyolyse.
ee omvat auto-immune artritis, immuungemedieerde artritis, polyartritis en reumatoïde artritis.
ff polymyositis (fataal) werd waargenomen bij een patiënt die met IMFINZI werd behandeld in een lopend gesponsord klinisch onderzoek buiten de samengevoegde gegevensset.
gg niet waargenomen in de IMFINZI+Chemotherapie-pool of de op platina gebaseerde chemotherapie+IMFINZI+olaparib-dataset, maar wel waargenomen in andere door AstraZeneca gesponsorde klinische onderzoeken.
hh omvat auto‑immuunnefritis, tubulo‑interstitiële nefritis, nefritis, glomerulonefritis, membraneuze glomerulonefritis en immuungemedieerde nefritis.
ii omvat vermoeidheid en asthenie.
jj omvat perifeer oedeem en perifere zwelling.
kk omvat infusiegerelateerde reacties en urticaria beginnend op de dag van toediening of 1 dag na toediening.
Tabel 4. Bijwerkingen bij patiënten behandeld met IMFINZI in combinatie met tremelimumab
| IMFINZI in combinatie met tremelimumab 75 mg en platinabevattende chemotherapie | IMFINZI in combinatie met tremelimumab 300 mg |
Infecties en parasitaire aandoeningen | ||
Zeer vaak | Infecties van de bovenste luchtwegena, Pneumonieb |
|
Vaak | Influenza, Orale candidiasis | Infecties van de bovenste luchtwegena, Pneumonieb, Influenza, Tand‑ en oralewekedeleninfectiesc |
Soms | Tand‑ en oralewerkedeleninfectiesc | Orale candidiasis |
Bloed‑ en lymfestelselaandoeningen | ||
Zeer vaak | Anemied, Neutropenied,e, Trombocytopenied,f, Leukopenied,g |
|
Vaak | Febriele neutropenied, Pancytopenied |
|
Soms | Immuuntrombocytopenie |
|
Niet bekend |
| Immune trombocytopenieh |
Endocriene aandoeningen | ||
Zeer vaak | Hypothyreoïdiei | Hypothyreoïdiei |
Vaak | Hyperthyreoïdiej, Bijnierinsufficiëntie, Hypopituïtarisme/Hypofysitis, Thyreoïditisk | Hyperthyreoïdiej, Thyreoïditisk, Bijnierinsufficiëntie |
Soms | Diabetes insipidus, Type 1‑diabetes mellitus | Hypopituïtarisme/Hypofysitis |
Niet bekend |
| Diabetes insipidush, Type 1‑diabetes mellitush |
Oogaandoeningen | ||
Soms | Uveïtis |
|
Zelden |
| Uveïtish |
Voedings‑ en stofwisselingsstoornissen | ||
Zeer vaak | Verminderde eetlustd |
|
Zenuwstelselaandoeningen | ||
Vaak | Neuropathie perifeerd,l |
|
Soms | Encefalitism | Myasthenia gravis, Meningitis |
Niet bekend | Myasthenia gravisn, Guillain‑Barré‑syndroomn, Meningitisn, Myelitis transversaO | Guillain‑Barré‑syndroomh, Encefalitish, Myelitis transversaO |
Hartaandoeningen | ||
Soms | Myocarditisp | Myocarditis |
Ademhalingsstelsel‑, borstkas‑ en mediastinumaandoeningen | ||
Zeer vaak | Hoesten/Productieve hoest | Hoesten/Productieve hoest |
Vaak | Pneumonitisq, Dysfonie | Pneumonitisq |
Soms | Interstitiële longziekte | Dysfonie, Interstitiële longziekte |
Maagdarmstelselaandoeningen | ||
Zeer vaak | Nausead, Diarree, Constipatied, Brakend | Diarree, Buikpijnr |
Vaak | Stomatitisd,s, Amylase verhoogd, Buikpijnr, Lipase verhoogd, Colitist, Pancreatitisu | Lipase verhoogd, Amylase verhoogd, Colitist, Pancreatitisu |
Zelden | Coeliakien | Coeliakieh |
Niet bekend | Intestinale perforatien, Dikkedarmperforatien | Intestinale perforatieh, Dikkedarmperforatieh |
Lever‑ en galaandoeningen | ||
Zeer vaak | Aspartaataminotransferase verhoogd/ Alanineaminotransferase verhoogdv | Aspartaataminotransferase verhoogd/ Alanineaminotransferase verhoogdv |
Vaak | Hepatitisw | Hepatitisw |
Huid‑ en onderhuidaandoeningen | ||
Zeer vaak | Alopeciad, Rashx, Pruritus | Rashx, Pruritus |
Vaak |
| Dermatitisy, Nachtzweten |
Soms | Dermatitis, Nachtzweten, Pemfigoïd | Pemfigoïd |
Skeletspierstelsel‑ en bindweefselaandoeningen | ||
Zeer vaak | Artralgie |
|
Vaak | Myalgie | Myalgie |
Soms | Myositisz, Polymyositisz, Immuungemedieerde artritisn | Myositisz, Polymyositisz, Immuungemedieerde artritis, Polymyalgia rheumatica |
Niet bekend | Polymyalgia rheumatican |
|
Nier‑ en urinewegaandoeningen | ||
Vaak | Bloedcreatinine verhoogd, Dysurie | Bloedcreatinine verhoogd, Dysurie |
Soms | Nefritis, Cystitis niet‑infectieus | Nefritisaa |
Niet bekend |
| Cystitis niet‑infectieush |
Algemene aandoeningen en toedieningsplaatsstoornissen | ||
Zeer vaak | Vermoeidheidd, Pyrexie | Pyrexie, Perifeer oedeembb |
Vaak | Perifeer oedeembb |
|
Letsels, intoxicaties en verrichtingscomplicaties | ||
Vaak | Infusiegerelateerde reactiecc | Infusiegerelateerde reactiecc |
a Omvat laryngitis, nasofaryngitis, faryngitis, rinitis, sinusitis, tonsillitis, tracheobronchitis en infecties van de bovenste luchtwegen.
b Omvat Pneumocystis jiroveci‑pneumonie, pneumonie en bacteriële pneumonie.
c Omvat periodontitis, tandpulpitis, tandabces en tandinfectie.
d Bijwerking is alleen van toepassing op bijwerkingen van chemotherapie in het POSEIDON‑onderzoek.
e Omvat neutropenie en verlaagd aantal neutrofielen.
f Omvat verlaagd aantal bloedplaatjes en trombocytopenie.
g Omvat leukopenie en verlaagd aantal witte bloedcellen.
h Bijwerking werd niet waargenomen in de HCC‑pool, maar werd gemeld bij patiënten die werden behandeld met IMFINZI of IMFINZI + tremelimumab in door AstraZeneca gesponsorde klinische onderzoeken.
i Omvat bloed thyreoïd‑stimulerend hormoon verhoogd, hypothyreoïdie en immuungemedieerde hypothyreoïdie.
j Omvat bloed thyreoïd‑stimulerend hormoon verlaagd en hyperthyreoïdie.
k Omvat auto‑immune thyreoïditis, immuungemedieerde thyreoïditis, thyreoïditis en subacute thyreoïditis.
l. Omvat neuropathie perifeer, paresthesie en perifere sensorische neuropathie
m Omvat encefalitis en auto‑immune encefalitis.
n Bijwerking werd niet waargenomen in het POSEIDON‑onderzoek, maar werd gemeld bij patiënten die werden behandeld met IMFINZI of IMFINZI+tremelimumab in klinische onderzoeken buiten de POSEIDON‑dataset.
o Gerapporteerd in studies buiten de POSEIDON-onderzoek en HCC-pool.
p Omvat auto‑immune myocarditis.
q Omvat immuungemedieerde pneumonitis en pneumonitis.
r Omvat buikpijn, buikpijn onder, buikpijn boven en flankpijn.
s Omvat slijmvliesontsteking en stomatitis.
t Omvat colitis, enteritis en enterocolitis.
u Omvat auto‑immune pancreatitis, pancreatitis en acute pancreatitis.
v Inclusief alanineaminotransferase verhoogd, aspartaataminotransferase verhoogd, leverenzym verhoogd en transaminasen verhoogd.
w Omvat auto‑immune hepatitis, hepatitis, hepatocellulair letsel, hepatotoxiciteit, acute hepatitis en immuungemedieerde hepatitis.
x Omvat eczeem, erytheem, rash, maculaire rash, maculopapulaire rash, papulaire rash, pruritische rash en pustulaire rash.
y Omvat dermatitis en immuungemedieerde dermatitis.
z Omvat rabdomyolyse, myositis en polymyositis.
aa Omvat auto‑immuunnefritis en immuungemedieerde nefritis.
bb Omvat perifeer oedeem en perifere zwelling.
cc Omvat infusiegerelateerde reactie en urticaria.
Beschrijving van bepaalde bijwerkingen
IMFINZI wordt in verband gebracht met immuungemedieerde bijwerkingen. De meeste daarvan, waaronder ernstige reacties, verdwenen na de start van passende medische behandeling en/of behandelingswijzigingen. De gegevens voor de volgende immuungemedieerde bijwerkingen komen uit de gecombineerde veiligheidsdatabase van IMFINZI monotherapie met 4.642 patiënten, waaronder de PACIFIC, HIMALAYA en ADRIATIC‑onderzoeken en aanvullende onderzoeken bij patiënten met verschillende solide tumoren in indicaties waarvoor durvalumab niet is goedgekeurd. In alle onderzoeken werd IMFINZI toegediend in een dosis van 10 mg/kg elke 2 weken, 20 mg/kg elke 4 weken of 1.500 mg elke 3 of 4 weken. Details voor de belangrijke bijwerkingen voor IMFINZI bij toediening in combinatie met chemotherapie worden weergegeven als er klinisch relevante verschillen in vergelijking met IMFINZI‑monotherapie werden opgemerkt.
De gegevens voor de volgende immuungemedieerde bijwerkingen zijn ook gebaseerd op 2.280 patiënten die elke 4 weken IMFINZI 20 mg/kg kregen in combinatie met tremelimumab 1 mg/kg of IMFINZI 1.500 mg in combinatie met tremelimumab 75 mg elke 4 weken. Details voor de belangrijke bijwerkingen voor IMFINZI bij toediening in combinatie met tremelimumab en platinabevattende chemotherapie worden weergegeven als er klinisch relevante verschillen in vergelijking met IMFINZI in combinatie met tremelimumab werden opgemerkt.
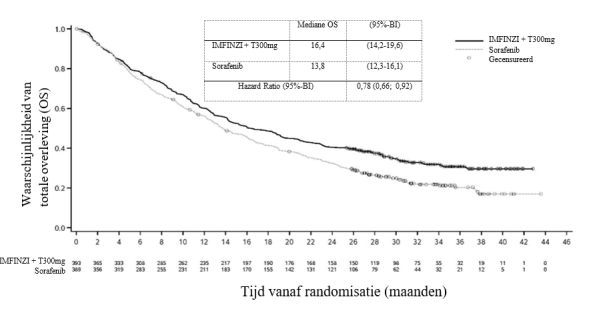
De gegevens voor de volgende immuungemedieerde bijwerkingen weerspiegelen ook de gecombineerde veiligheidsdatabase van IMFINZI in combinatie met tremelimumab 300 mg van 462 patiënten met HCC (de HCC‑pool). In deze twee onderzoeken werd IMFINZI toegediend in een dosis van 1.500 mg in combinatie met tremelimumab 300 mg elke 4 weken.
De richtlijnen voor de behandeling van deze bijwerkingen zijn beschreven in rubriek 4.2 en 4.4.
Immuungemedieerde pneumonitis
In de gecombineerde veiligheidsdatabase met IMFINZI als monotherapie, (n=4.642 meerdere tumortypen), trad immuungemedieerde pneumonitis op bij 147 (3,2%) patiënten, waaronder graad 3 bij 37 (0,8%) patiënten, graad 4 bij 2 (< 0,1%) patiënten en graad 5 bij 10 (0,2%) patiënten. De mediane tijd tot aanvang was 56 dagen (bereik: 1‑1.308 dagen). Honderdveertien van de 147 patiënten kregen een corticosteroïdbehandeling met hoge doses (minstens 40 mg prednison of een equivalent per dag) en 4 patiënten kregen ook andere immunosuppressiva waaronder infliximab en cyclosporine. IMFINZI werd bij 60 patiënten gestaakt. Herstel trad op bij 85 patiënten.
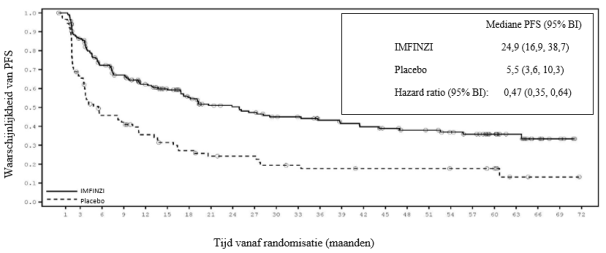
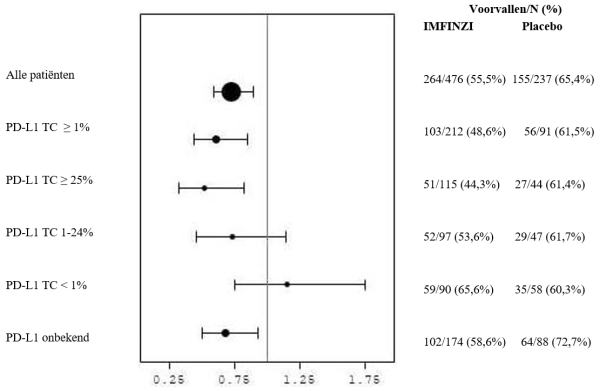
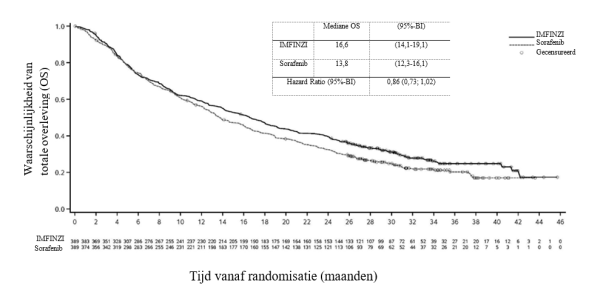
Immuungemedieerde pneumonitis trad vaker op bij patiënten in het PACIFIC‑onderzoek die de behandeling met gelijktijdige chemoradiatie hadden afgerond binnen 1 tot 42 dagen voor aanvang van de studiebehandeling (10,7%) dan bij de andere patiënten in de gecombineerde veiligheidsdatabase (1,0%).
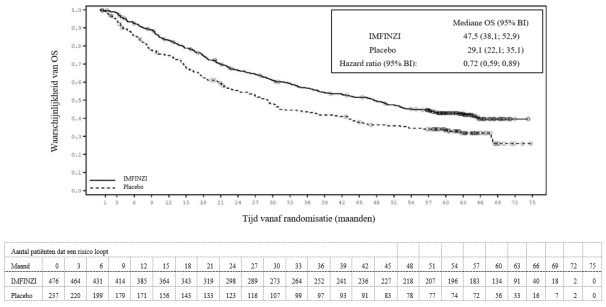
In het PACIFIC‑onderzoek, (n=475 in de IMFINZI‑arm, en n=234 in de placebo‑arm) trad immuungemedieerde pneumonitis op bij 47 (9,9%) patiënten in de met IMFINZI behandelde groep en 14 (6,0%) patiënten in de placebogroep, waaronder graad 3 bij 9 (1,9%) patiënten op IMFINZI vs. 6 (2,6%) patiënten op placebo en graad 5 (fataal) bij 4 (0,8%) patiënten op IMFINZI vs. 3 (1,3%) patiënten op placebo. De mediane tijd tot aanvang in de met IMFINZI behandelde groep was 46 dagen (bereik: 2‑342 dagen) vs. 57 dagen (bereik: 26‑253 dagen) in de placebogroep. In de met IMFINZI behandelde groep kregen alle patiënten systemische corticosteroïden, waaronder 30 patiënten die een corticosteroïdbehandeling met hoge doses kregen (minstens 40 mg prednison of een equivalent per dag) en 2 patiënten kregen ook infliximab. In de placebogroep kregen alle patiënten systemische corticosteroïden, waaronder 12 patiënten die een corticosteroïdbehandeling met hoge doses kregen en 1 patiënt kreeg ook cyclofosfamide en tacrolimus. Herstel trad op bij 29 patiënten in de met IMFINZI behandelde groep vs. 6 in de placebogroep.
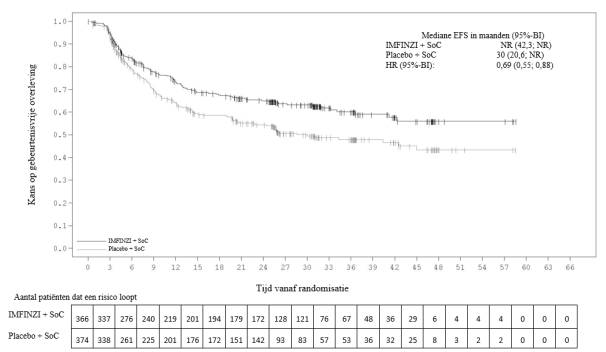
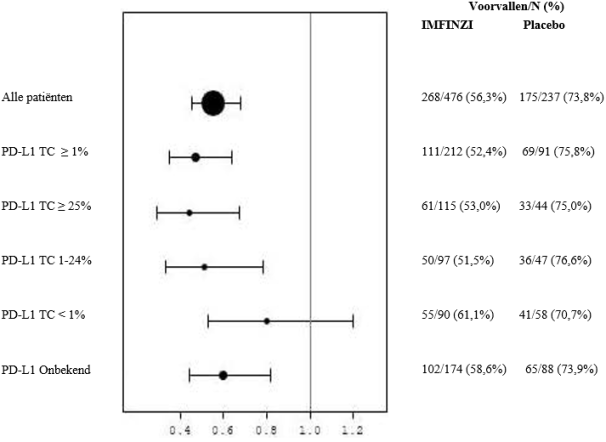
In het ADRIATIC-onderzoek trad bij patiënten met LS-SCLC (n=262 in de IMFINZI-arm en n=265 in de placebo-arm) immuungemedieerde pneumonitis op bij 31 (11,8%) patiënten in de met IMFINZI behandelde groep en 8 (3,0%) patiënten in de placebogroep, waaronder graad 3 bij 5 (1,9%) patiënten op IMFINZI vs. 1 (0,4%) patiënten op placebo en graad 5 (fataal) bij 1 (0,4%) patiënt op IMFINZI. De mediane tijd tot aanvang in de met IMFINZI behandelde groep was 55 dagen (bereik: 1-375 dagen) vs. 65,5 dagen (bereik: 24‑124 dagen) in de placebogroep. In de met IMFINZI behandelde groep kregen alle patiënten systemische corticosteroïden, waaronder 25 patiënten die een corticosteroïdbehandeling met hoge doses kregen (minstens 40 mg prednison of een equivalent per dag) en 1 patiënt kreeg ook infliximab. In de placebogroep kregen alle patiënten systemische corticosteroïden, waaronder 7 patiënten die een corticosteroïdbehandeling met hoge doses kregen. Herstel trad op bij 18 patiënten in de met IMFINZI behandelde groep vs. 3 in de placebogroep.
In de gecombineerde veiligheidsdatabase van IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde pneumonitis op bij 86 (3,8%) patiënten, waaronder graad 3 bij 30 (1,3%) patiënten, graad 4 bij 1 (< 0,1%) patiënt en graad 5 (fataal) bij 7 (0,3%) patiënten. De mediane tijd tot aanvang was 57 dagen (bereik: 8 ‑ 912 dagen). Alle patiënten kregen systemische corticosteroïden en 79 van de 86 patiënten kregen een hoge dosis corticosteroïdbehandeling (minstens 40 mg prednison of equivalent per dag). Zeven patiënten kregen ook andere immunosuppressiva. De behandeling werd gestaakt bij 39 patiënten. Herstel trad op bij 51 patiënten.
In de HCC‑pool (n=462) trad immuungemedieerde pneumonitis op bij 6 (1,3%) patiënten, waaronder graad 3 bij 1 (0,2%) patiënt en graad 5 (fataal) bij 1 (0,2%) patiënt. De mediane tijd tot aanvang was 29 dagen (bereik: 5‑774 dagen). Zes patiënten kregen systemische corticosteroïden, en 5 van de 6 patiënten kregen een behandeling met hoge doses corticosteroïden (minstens 40 mg prednison of een equivalent per dag). Eén patiënt kreeg ook andere immunosuppressiva. Bij 2 patiënten werd de behandeling stopgezet. Herstel trad op bij 3 patiënten.
Van de 238 patiënten in het DUO-E onderzoek die waren behandeld met platinabevattende chemotherapie in combinatie met IMFINZI, gevolgd door IMFINZI in combinatie met olaparib (platinabevattende chemotherapie + IMFINZI + olaparib-arm) trad immuungemedieerde pneumonitis op bij 5 (2,1%) patiënten, waaronder graad 3 bij 3 (1,3%) patiënten. De mediane tijd tot aanvang was 85 dagen (bereik: 65‑321 dagen). Vijf patiënten kregen systemische corticosteroïden, onder wie 4 patiënten die een behandeling met hoge doses corticosteroïden kregen (minstens 40 mg prednison of equivalent per dag). Herstel trad op bij alle vijf patiënten.
Immuungemedieerde hepatitis
In de gecombineerde veiligheidsdatabase met IMFINZI als monotherapie, trad immuungemedieerde hepatitis op bij 120 (2,6%) patiënten, waaronder graad 3 bij 70 (1,5%) patiënten, graad 4 bij 9 (0,2%) patiënten en graad 5 (fataal) bij 6 (0,1%) patiënten. De mediane tijd tot aanvang was 36 dagen (bereik: 1‑644 dagen). Vierennegentig van de 120 patiënten kregen een corticosteroïdbehandeling met hoge doses (minstens 40 mg prednison of een equivalent per dag). Negen patiënten kregen ook andere immunosuppressiva waaronder behandeling met mycofenolaat. IMFINZI werd bij 30 patiënten gestaakt. Herstel trad op bij 56 patiënten.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde hepatitis op bij 80 (3,5%) patiënten, waaronder graad 3 bij 48 (2,1%) patiënten, graad 4 bij 8 (0,4%) patiënten en graad 5 (fataal) bij 2 (< 0,1%) patiënten. De mediane tijd tot aanvang was 36 dagen (bereik: 1 ‑ 533 dagen). Alle patiënten kregen systemische corticosteroïden en 68 van de 80 patiënten kregen een hoge dosis corticosteroïdbehandeling (minstens 40 mg prednison of equivalent per dag). Acht patiënten kregen ook andere immunosuppressiva. De behandeling werd gestaakt bij 27 patiënten. Herstel trad op bij 47 patiënten.
In de HCC‑pool (n=462) kwam immuungemedieerde hepatitis voor bij 34 (7,4%) patiënten, waaronder graad 3 bij 20 (4,3%) patiënten, graad 4 bij 1 (0,2%) patiënt en graad 5 (fataal) bij 3 (0,6%) patiënten. De mediane tijd tot aanvang was 29 dagen (bereik: 13‑313 dagen). Alle patiënten kregen systemische corticosteroïden, en 32 van de 34 patiënten kregen een behandeling met hoge doses corticosteroïden (minstens 40 mg prednison of equivalent per dag). Negen patiënten kregen ook andere immunosuppressiva. Bij 10 patiënten werd de behandeling gestaakt. Herstel trad op bij 13 patiënten.
Immuungemedieerde colitis
In de gecombineerde veiligheidsdatabase met IMFINZI als monotherapie, trad immuungemedieerde colitis of diarree op bij 79 (1,7%) patiënten, waaronder graad 3 bij 15 (0,3%) patiënten en graad 4 bij 2 (< 0,1%) patiënten. De mediane tijd tot aanvang was 72 dagen (bereik: 1‑920 dagen). Vijfenvijftig van de 79 patiënten kregen een corticosteroïdbehandeling met hoge doses (minstens 40 mg prednison of een equivalent per dag). Vijf patiënten kregen ook andere immunosuppressiva waaronder behandeling met infliximab en mycofenolaat. IMFINZI werd bij 15 patiënten gestaakt. Herstel trad op bij 54 patiënten.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde colitis of diarree op bij 167 (7,3%) patiënten, waaronder graad 3 bij 76 (3,3%) patiënten en graad 4 bij 3 (0,1%) patiënten. De mediane tijd tot aanvang was 57 dagen (bereik: 3 ‑ 906 dagen). Alle patiënten kregen systemische corticosteroïden en 151 van de 167 patiënten kregen een hoge dosis corticosteroïdbehandeling (ten minste 40 mg prednison of equivalent per dag). Tweeëntwintig patiënten kregen ook andere immunosuppressiva. De behandeling werd gestaakt bij 54 patiënten. Herstel trad op bij 141 patiënten.
Intestinale perforatie en dikkedarmperforatie werden soms gemeld bij patiënten die IMFINZI kregen in combinatie met tremelimumab.
In de HCC‑pool (n=462) trad immuungemedieerde colitis of diarree op bij 31 (6,7%) patiënten, waaronder graad 3 bij 17 (3,7%) patiënten. De mediane tijd tot het optreden was 23 dagen (bereik: 2‑479 dagen). Alle patiënten kregen systemische corticosteroïden, en 28 van de 31 patiënten kregen een behandeling met hoge doses corticosteroïden (minstens 40 mg prednison of equivalent per dag). Vier patiënten kregen ook andere immunosuppressiva. Bij 5 patiënten werd de behandeling gestaakt. Herstel trad op bij 29 patiënten.
Intestinale perforatie werd waargenomen bij patiënten die IMFINZI kregen in combinatie met tremelimumab (zelden) in onderzoeken buiten de HCC‑pool.
Immuungemedieerde endocrinopathieën
Immuungemedieerde hypothyreoïdie
In de gecombineerde veiligheidsdatabase met IMFINZI‑monotherapie trad immuungemedieerde hypothyreoïdie op bij 384 (8,3%) patiënten, waaronder graad 3 bij 7 (0,2%) patiënten. De mediane tijd tot aanvang was 90,5 dagen (bereik: 1‑951 dagen). Van de 384 patiënten kregen 379 patiënten hormoonvervangende therapie en 7 patiënten hooggedoseerde corticosteroïden (minstens 40 mg per dag prednison of een equivalent) voor immuungemedieerde hypothyreoïdie. Eén patiënt stopte met IMFINZI als gevolg van immuungemedieerde hypothyreoïdie. Herstel trad op bij 79 patiënten.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde hypothyreoïdie op bij 209 (9,2%) patiënten, waaronder graad 3 bij 6 (0,3%) patiënten. De mediane tijd tot aanvang was 85 dagen (bereik: 1 ‑ 624 dagen). Dertien patiënten kregen systemische corticosteroïden en 8 van de 13 kregen een hoge dosis corticosteroïdbehandeling (minstens 40 mg prednison of equivalent per dag). De behandeling werd gestaakt bij 3 patiënten. Herstel trad op bij 52 patiënten. Immuungemedieerde hypothyreoïdie werd voorafgegaan door immuungemedieerde hyperthyreoïdie bij 25 patiënten of immuungemedieerde thyreoïditis bij 2 patiënten.
In de HCC‑pool (n=462) trad immuungemedieerde hypothyreoïdie op bij 46 (10,0%) patiënten. De mediane tijd tot aanvang was 85 dagen (bereik: 26‑763 dagen). Eén patiënt werd behandeld met een hoge dosis corticosteroïden (minstens 40 mg prednison of equivalent per dag). Alle patiënten hadden andere therapie nodig, waaronder hormoonvervangingstherapie. Herstel trad op bij 6 patiënten. Immuungemedieerde hypothyreoïdie werd voorafgegaan door immuungemedieerde hyperthyreoïdie bij 4 patiënten.
Immuungemedieerde hyperthyreoïdie
In de gecombineerde veiligheidsdatabase met IMFINZI‑monotherapie trad immuungemedieerde hyperthyreoïdie op bij 76 (1,6%) patiënten. De mediane tijd tot aanvang was 43 dagen (bereik: 1‑253 dagen). Eenenzeventig van de 76 patiënten kregen medische therapie (thiamazol, carbimazol, propylthiouracil, perchloraat, calciumkanaalblokker of bètablokker), 15 patiënten kregen systemische corticosteroïden en 8 van de 15 patiënten kregen hooggedoseerde systemische behandeling met corticosteroïden (minstens 40 mg per dag prednison of een equivalent). Eén patiënt stopte met IMFINZI omwille van immuungemedieerde hyperthyreoïdie. Herstel trad op bij 62 patiënten. Eenendertig patiënten kregen hypothyreoïdie na hyperthyreoïdie.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde hyperthyreoïdie op bij 62 (2,7%) patiënten, waaronder graad 3 bij 5 (0,2%) patiënten. De mediane tijd tot aanvang was 33 dagen (bereik: 4‑176 dagen). Achttien patiënten kregen systemische corticosteroïden en 11 van de 18 patiënten kregen een hoge dosis corticosteroïdbehandeling (minstens 40 mg prednison of equivalent per dag). Drieënvijftig patiënten hadden andere therapie nodig (thiamazol, carbimazol, propylthiouracil, perchloraat, calciumantagonist of bètablokker). Eén patiënt staakte de behandeling vanwege hyperthyreoïdie. Herstel trad op bij 47 patiënten.
In de HCC‑pool (n=462) trad immuungemedieerde hyperthyreoïdie op bij 21 (4,5%) patiënten, waaronder graad 3 bij 1 (0,2%) patiënt. De mediane tijd tot het optreden was 30 dagen (bereik: 13‑60 dagen). Vier patiënten kregen systemische corticosteroïden, en alle vier de patiënten kregen een behandeling met hoge doses corticosteroïden (ten minste 40 mg prednison of een equivalent per dag). Twintig patiënten hadden een andere therapie nodig (thiamazol, carbimazol, propylthiouracil, perchloraat, calciumkanaalblokker of bètablokker). Eén patiënt stopte met de behandeling vanwege hyperthyreoïdie. Herstel trad op bij 17 patiënten.
Immuungemedieerde thyreoïditis
In de gecombineerde veiligheidsdatabase met IMFINZI‑monotherapie trad immuungemedieerde thyreoïditis op bij 21 (0,5%) patiënten, inclusief graad 3 bij 2 (< 0,1%) patiënten. De mediane tijd tot aanvang was 57 dagen (bereik: 14‑217 dagen). Van de 21 patiënten kregen 18 patiënten hormoonvervangende therapie en 3 patiënten hooggedoseerde corticosteroïden (minstens 40 mg per dag prednison of een equivalent). Eén patiënt stopte met IMFINZI omwille van immuungemedieerde thyreoïditis. Herstel trad op bij 8 patiënten. Vijf patiënten kregen hypothyreoïdie na thyreoïditis.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde thyreoïditis op bij 15 (0,7%) patiënten, waaronder graad 3 bij 1 (< 0,1%) patiënt. De mediane tijd tot aanvang was 57 dagen (bereik: 22‑141 dagen). Vijf patiënten kregen systemische corticosteroïden en 2 van de 5 patiënten kregen een hoge dosis corticosteroïdbehandeling (minstens 40 mg prednison of equivalent per dag). Dertien patiënten hadden andere therapie nodig, waaronder hormoonvervangingstherapie, thiamazol, carbimazol, propylthiouracil, perchloraat, calciumantagonist of bètablokker. Geen van de patiënten staakte de behandeling vanwege immuungemedieerde thyreoïditis. Herstel trad op bij 5 patiënten.
In de HCC‑pool (n=462) trad immuungemedieerde thyreoïditis op bij 6 (1,3%) patiënten. De mediane tijd tot aanvang was 56 dagen (bereik: 7‑84 dagen). Twee patiënten kregen systemische corticosteroïden, en 1 van de 2 patiënten kreeg een behandeling met hoge doses corticosteroïden (ten minste 40 mg prednison of een equivalent per dag). Alle patiënten hadden een andere therapie nodig, waaronder hormoonvervangingstherapie. Herstel trad op bij 2 patiënten.
Immuungemedieerde bijnierinsufficiëntie
In de gecombineerde veiligheidsdatabase met IMFINZI‑monotherapie trad immuungemedieerde bijnierinsufficiëntie op bij 24 (0,5%) patiënten, inclusief graad 3 bij 8 (0,2%) patiënten. De mediane tijd tot aanvang was 157,5 dagen (bereik: 20‑547 dagen). Alle 24 patiënten kregen systemische corticosteroïden; 8 van de 24 patiënten kregen hooggedoseerde behandeling met corticosteroïden (minstens 40 mg per dag prednison of een equivalent). Eén patiënt stopte met IMFINZI omwille van immuungemedieerde bijnierinsufficiëntie. Herstel trad op bij 6 patiënten.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde bijnierinsufficiëntie op bij 33 (1,4%) patiënten, waaronder graad 3 bij 16 (0,7%) patiënten en graad 4 bij 1 (< 0,1%) patiënt. De mediane tijd tot aanvang was 105 dagen (bereik: 20 ‑ 428 dagen). Tweeëndertig patiënten kregen systemische corticosteroïden en 10 van de 32 patiënten kregen een hoge dosis corticosteroïdbehandeling (ten minste 40 mg prednison of equivalent per dag). Bij één patiënt werd de behandeling gestaakt. Herstel trad op bij 11 patiënten.
In de HCC‑pool (n=462) trad immuungemedieerde bijnierinsufficiëntie op bij 6 (1,3%) patiënten, waaronder graad 3 bij 1 (0,2%) patiënt. De mediane tijd tot het optreden was 64 dagen (bereik: 43‑504 dagen). Alle patiënten kregen systemische corticosteroïden, en 1 van de 6 patiënten kreeg een behandeling met hoge doses corticosteroïden (ten minste 40 mg prednison of een equivalent per dag). Herstel trad op bij 2 patiënten.
Immuungemedieerde diabetes mellitus type 1
In de gecombineerde veiligheidsdatabase met IMFINZI‑monotherapie trad immuungemedieerde diabetes mellitus type 1 op bij 5 (0,1%) patiënten, waaronder graad 3 bij 3 (0,1%) patiënten en graad 4 bij 1 (< 0,1%) patiënt. De tijd tot aanvang was 43 dagen (bereik: 29‑631 dagen). Alle vijf de patiënten hadden insulinebehandeling nodig. Bij één patiënt werd IMFINZI definitief stopgezet. Eén patiënt herstelde en één patiënt herstelde met restverschijnselen.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) kwam immuungemedieerde diabetes mellitus type 1 voor bij 6 (0,3%) patiënten, waaronder graad 3 bij 1 (< 0,1%) patiënt en graad 4 bij 2 (< 0,1%) patiënten. De mediane tijd tot aanvang was 58 dagen (bereik: 7‑220 dagen). Alle patiënten hadden insuline nodig. De behandeling werd gestaakt voor 1 patiënt. Herstel trad op bij 1 patiënt.
Immuungemedieerde hypofysitis/hypopituïtarisme
In de gecombineerde veiligheidsdatabase met IMFINZI‑monotherapie trad immuungemedieerde hypofysitis/hypopituïtarisme op bij 6 (0,1%) patiënten, waaronder graad 3 bij 5 (0,1%) patiënten. De tijd tot aanvang van de voorvallen was 85 dagen (bereik: 44‑225 dagen). Drie patiënten kregen hooggedoseerde behandeling met corticosteroïden (minstens 40 mg per dag prednison of een equivalent), drie patiënten stopten met IMFINZI omwille van immuungemedieerde hypofysitis/hypopituïtarisme en herstel trad op bij 1 patiënt.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde hypofysitis/hypopituïtarisme op bij 16 (0,7%) patiënten, waaronder graad 3 bij 8 (0,4%) patiënten. De mediane tijd tot optreden van de voorvallen was 123 dagen (bereik: 63 ‑ 388 dagen). Alle patiënten kregen systemische corticosteroïden en 8 van de 16 patiënten kregen een hoge dosis corticosteroïdbehandeling (minstens 40 mg prednison of equivalent per dag). Vier patiënten hadden ook endocriene therapie nodig. De behandeling werd gestaakt bij 2 patiënten. Herstel trad op bij 7 patiënten.
In de HCC‑pool (n=462) trad immuungemedieerde hypofysitis/hypopituïtarisme op bij 5 (1,1%) patiënten. De mediane tijd tot optreden van de voorvallen was 149 dagen (bereik: 27‑242 dagen). Vier patiënten kregen systemische corticosteroïden, en 1 van de 4 patiënten kreeg een behandeling met hoge doses corticosteroïden (ten minste 40 mg prednison of een equivalent per dag). Drie patiënten hadden ook endocriene therapie nodig. Herstel trad op bij 2 patiënten.
Immuungemedieerde nefritis
In de gecombineerde veiligheidsdatabase met IMFINZI‑monotherapie trad immuungemedieerde nefritis op bij 17 (0,4%) patiënten, inclusief graad 3 bij 4 (0,1%) patiënten en graad 4 bij 1 (< 0,1%) patiënt. De mediane tijd tot aanvang was 84 dagen (bereik: 4‑393 dagen). Twaalf patiënten kregen hooggedoseerde behandeling met corticosteroïden (minstens 40 mg per dag prednison of een equivalent) en 1 patiënt kreeg ook mycofenolaat. IMFINZI werd stopgezet bij 7 patiënten. Herstel trad op bij 8 patiënten.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde nefritis op bij 9 (0,4%) patiënten, waaronder graad 3 bij 1 (< 0,1%) patiënt. De mediane tijd tot aanvang was 79 dagen (bereik: 39‑183 dagen). Alle patiënten kregen systemische corticosteroïden en 7 patiënten kregen een behandeling met een hoge dosis corticosteroïden (minstens 40 mg prednison of equivalent per dag). De behandeling werd gestaakt bij 3 patiënten. Herstel trad op bij 5 patiënten.
In de HCC‑pool (n=462) trad immuungemedieerde nefritis op bij 4 (0,9%) patiënten, waaronder graad 3 bij 2 (0,4%) patiënten. De mediane tijd tot aanvang was 53 dagen (bereik: 26‑242 dagen). Alle patiënten kregen systemische corticosteroïden, en 3 van de 4 kregen een behandeling met hoge doses corticosteroïden (ten minste 40 mg prednison of een equivalent per dag). Bij 2 patiënten werd de behandeling stopgezet. Herstel trad op bij 3 patiënten.
Immuungemedieerde rash
In de gecombineerde veiligheidsdatabase met IMFINZI‑monotherapie trad immuungemedieerde rash of dermatitis (inclusief pemfigoïd) op bij 74 (1,6%) patiënten, inclusief graad 3 bij 20 (0,4%) patiënten. De mediane tijd tot aanvang was 56 dagen (bereik: 4‑600 dagen). Zevenendertig van de 74 patiënten kregen hooggedoseerde behandeling met corticosteroïden (minstens 40 mg per dag prednison of een equivalent). IMFINZI werd stopgezet bij 5 patiënten. Herstel trad op bij 46 patiënten.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) trad immuungemedieerde rash of dermatitis (inclusief pemfigoïd) op bij 112 (4,9%) patiënten, waaronder graad 3 bij 17 (0,7%) patiënten. De mediane tijd tot aanvang was 35 dagen (bereik: 1‑778 dagen). Alle patiënten kregen systemische corticosteroïden en 57 van de 112 patiënten kregen een hoge dosis corticosteroïdbehandeling (minstens 40 mg prednison of equivalent per dag). De behandeling werd gestaakt bij 10 patiënten. Herstel trad op bij 65 patiënten.
In de HCC‑pool (n=462) trad immuungemedieerde rash of dermatitis (inclusief pemfigoïd) op bij 26 (5,6%) patiënten, waaronder graad 3 bij 9 (1,9%) patiënten en graad 4 bij 1 (0,2%) patiënt. De mediane tijd tot aanvang was 25 dagen (bereik: 2‑933 dagen). Alle patiënten kregen systemische corticosteroïden en 14 van de 26 patiënten kregen een behandeling met hoge doses corticosteroïden (ten minste 40 mg prednison of equivalent per dag). Eén patiënt kreeg andere immunosuppressiva. Bij 3 patiënten werd de behandeling stopgezet. Herstel trad op bij 19 patiënten.
Van de 238 patiënten in het DUO-E onderzoek die waren behandeld met platinabevattende chemotherapie in combinatie met IMFINZI, gevolgd door IMFINZI in combinatie met olaparib (platinabevattende chemotherapie + IMFINZI + olaparib-arm) trad immuungemedieerde rash op bij 8 (3,4%) patiënten, waaronder graad 3 bij 2 (0,8%) patiënten. De mediane tijd tot aanvang was 155 dagen (bereik: 2-308 dagen). Alle patiënten kregen een behandeling met hoge doses corticosteroïden (minstens 40 mg prednison of equivalent per dag). Herstel trad op bij alle 8 patiënten.
Infusiegerelateerde reacties
In de gecombineerde veiligheidsdatabase met IMFINZI‑monotherapie traden infusiegerelateerde reacties op bij 70 (1,5%) patiënten, waaronder graad 3 bij 6 (0,1%) patiënten. Er waren geen voorvallen van graad 4 of 5.
In de gecombineerde veiligheidsdatabase met IMFINZI in combinatie met tremelimumab (n=2.280) traden infusiegerelateerde reacties op bij 45 (2,0%) patiënten, waaronder graad 3 bij 2 (< 0,1%) patiënten. Er waren geen voorvallen van graad 4 of 5.
Van de 238 patiënten in het DUO-E onderzoek die waren behandeld met platinabevattende chemotherapie in combinatie met IMFINZI, gevolgd door IMFINZI in combinatie met olaparib (platinabevattende chemotherapie + IMFINZI + olaparib-arm) traden infusiegerelateerde reacties op bij 13 (5,5%) patiënten, waaronder graad 3 bij 1 (0,4%) patiënt. Er waren geen voorvallen van graad 4 of 5.
Zuivere rode bloedcelaplasie
Zuivere rode bloedcelaplasie (PRCA; Pure Red Cell Aplasia) is gemeld bij gebruik van IMFINZI in combinatie met olaparib. In een klinisch onderzoek bij patiënten met endometriumcarcinoom die werden behandeld met IMFINZI in combinatie met olaparib, was de incidentie van PRCA 1,6%. Alle voorvallen waren van CTCAE-graad 3 of 4. De voorvallen konden worden behandeld na stopzetting van zowel IMFINZI als olaparib. Het merendeel van de voorvallen werd behandeld met bloedtransfusie en immunosuppressie en herstel trad op; er waren geen fatale gebeurtenissen. Voor behandeling zie rubriek 4.4.
Laboratoriumafwijkingen
Bij patiënten behandeld met IMFINZI monotherapie was het aandeel patiënten bij wie ten opzichte van baseline een verandering tot een laboratoriumafwijking van graad 3 of 4 optrad, als volgt: 3,7% voor verhoogde alanineaminotransferase, 5,7% voor verhoogde aspartaataminotransferase, 0,9% voor verhoogde bloedcreatinine, 4,8% voor verhoogde amylase en 8,2% voor verhoogde lipase. Het aandeel patiënten bij wie ten opzichte van baseline een TSH‑verandering optrad van ≤ ULN tot enige graad > ULN was 20% en het aandeel patiënten bij wie ten opzichte van baseline een TSH‑verandering optrad van ≥ LLN tot enige graad < LLN was 18,2%.
Bij patiënten behandeld met IMFINZI in combinatie met chemotherapie was het aandeel patiënten bij wie ten opzichte van baseline een verandering tot een laboratoriumafwijking van graad 3 of 4 optrad, als volgt: 4,6% voor verhoogde alanineaminotransferase, 3,9% voor verhoogde aspartaataminotransferase, 4,6% voor verhoogde bloedcreatinine, 5,7% voor verhoogde amylase, 10,2% voor verhoogde lipase en 3,0% voor verhoogde bilirubine. Het aandeel patiënten bij wie ten opzichte van baseline een TSH‑verandering optrad van ≤ ULN tot enige graad > ULN was 23,1% en het aandeel patiënten bij wie ten opzichte van baseline een TSH‑verandering optrad van ≥ LLN tot enige graad < LLN was 21,6%.
Bij patiënten die werden behandeld met IMFINZI in combinatie met tremelimumab en platinabevattende chemotherapie, was het percentage patiënten dat een verschuiving van baseline naar een laboratoriumafwijking van graad 3 of 4 ondervond, als volgt: 6,2% voor alanineaminotransferase verhoogd, 5,2% voor aspartaataminotransferase verhoogd, 4,0% voor bloedcreatinine verhoogd, 9,4% voor amylase verhoogd en 13,6% voor lipase verhoogd. Het percentage patiënten bij wie ten opzichte van de baseline een TSH‑verandering optrad van ≤ ULN tot enige graad > ULN was 24,8% en het percentage dat een TSH‑verandering ervoer van een baselinewaarde ≥ LLN naar < LLN was 32,9%.
Bij patiënten die werden behandeld met IMFINZI in combinatie met tremelimumab was het percentage patiënten dat een verandering van baseline naar een laboratoriumafwijking van graad 3 of 4 ondervond, als volgt: 5,1% voor alanineaminotransferase verhoogd, 5,8% voor aspartaataminotransferase, 1,0% voor bloedcreatinine verhoogd, 5,9% voor amylase verhoogd en 11,3% voor lipase verhoogd. Het percentage patiënten bij wie ten opzichte van baseline een TSH‑verandering optrad van ≤ ULN naar > ULN was 4,2% en het percentage patiënten bij wie ten opzichte van baseline een TSH‑verandering optrad van ≥ LLN naar < LLN was 17,2%.
Bij patiënten die werden behandeld met platinabevattende chemotherapie in combinatie met IMFINZI, gevolgd door IMFINZI in combinatie met olaparib (platinabevattende chemotherapie + IMFINZI + olaparib-arm), is het percentage patiënten bij wie een verandering ten opzichte van baseline van een laboratoriumafwijking van graad 3 of 4 optrad, als volgt: 3,8% voor alanineaminotransferase verhoogd, 3,4% voor aspartaataminotransferase verhoogd en 1,7% voor bloedcreatinine verhoogd. Het percentage patiënten bij wie, ten opzichte van baseline, een TSH-verandering optrad van ≤ ULN naar > ULN was 28,6% en het percentage patiënten bij wie, ten opzichte van baseline, een TSH‑verandering optrad van ≥ LLN naar < LLN was 20,1%.
Immunogeniciteit
Immunogeniciteit van IMFINZI als monotherapie is gebaseerd op samengevoegde gegevens van 3.069 patiënten behandeld met IMFINZI 10 mg/kg elke 2 weken of 20 mg/kg elke 4 weken als een afzonderlijk middel en beoordeelbaar voor de aanwezigheid van antilichamen tegen het geneesmiddel (ADA’s). Vierentachtig patiënten (2,7%) testten positief op tijdens de behandeling optredende ADA’s. Neutraliserende antilichamen (nAb) tegen durvalumab werden gedetecteerd bij 0,5% (16/3.069) van de patiënten. De aanwezigheid van ADA’s had geen klinisch relevant effect op de farmacokinetiek of de veiligheid. Het aantal patiënten is onvoldoende om de impact van ADA op de werkzaamheid te kunnen bepalen.
In verschillende fase III‑onderzoeken met IMFINZI in combinatie met andere therapeutische middelen, ontwikkelde 0% tot 10,1% van de patiënten ADA’s tijdens de behandeling. Neutraliserende antilichamen tegen durvalumab werden gedetecteerd bij 0% tot 1,7% van de patiënten die werden behandeld met IMFINZI in combinatie met andere therapeutische middelen. De aanwezigheid van ADA's had geen duidelijk effect op de farmacokinetiek of veiligheid.
Ouderen
Er werden geen verschillen in veiligheid gerapporteerd tussen oudere (≥ 65 jaar) en jongere patiënten.
In de onderzoeken PACIFIC, ADRIATIC, CASPIAN, TOPAZ‑1, HIMALAYA en NIAGARA zijn de gegevens over veiligheid voor patiënten van 75 jaar en ouder te beperkt om een conclusie te trekken voor deze populatie.
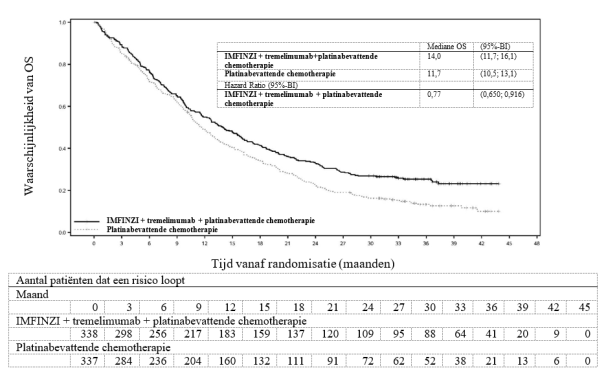
Bij eerstelijnspatiënten met gemetastaseerde NSCLC in het POSEIDON‑onderzoek werden enkele verschillen in veiligheid gemeld tussen oudere (≥ 65 jaar) en jongere patiënten. De veiligheidsgegevens van patiënten van 75 jaar of ouder zijn beperkt tot in totaal 74 patiënten. Bij 35 patiënten van 75 jaar of ouder die werden behandeld met IMFINZI in combinatie met tremelimumab en platinabevattende chemotherapie, was er een hogere frequentie van ernstige bijwerkingen en een hoger percentage stopzettingen van enige studiebehandeling als gevolg van bijwerkingen (respectievelijk 45,7% en 28,6% ) ten opzichte van 39 patiënten van 75 jaar of ouder die alleen platinabevattende chemotherapie kregen (respectievelijk 35,9% en 20,5%).
Bij patiënten met resectabel NSCLC in het AEGEAN-onderzoek zijn enkele verschillen in de veiligheid gerapporteerd tussen oudere (≥ 65 jaar) en jongere patiënten. De veiligheidsgegevens van patiënten van 75 jaar of ouder zijn beperkt tot 86 patiënten in beide behandelingsgroepen. Er was een hogere frequentie van ernstige bijwerkingen bij patiënten van 75 jaar of ouder die IMFINZI in combinatie met chemotherapie kregen in vergelijking met patiënten die alleen chemotherapie kregen (respectievelijk 26,5% vs. 10,8%). Er was een hogere frequentie van stopzetting van elke studiebehandeling vanwege bijwerkingen bij patiënten van 75 jaar of ouder die IMFINZI in combinatie met chemotherapie kregen in vergelijking met patiënten die alleen chemotherapie kregen (respectievelijk 16,3% vs. 8,1%).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
AstraZeneca AB
SE‑151 85 Södertälje
Zweden
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/18/1322/002 120 mg injectieflacon
EU/1/18/1322/001 500 mg injectieflacon
10. DATUM VAN HERZIENING VAN DE TEKST
07/2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu/.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3687514 | IMFINZI 120MG OPL INF IV VIAL 1 120MG/2,4ML | L01FF03 | - | € 597,05 | Ja | - | - |
| 3687522 | IMFINZI 500MG OPL INF IV VIAL 1 500MG/10ML | L01FF03 | - | € 2487,69 | Ja | - | - |