SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Nucala 100 mg poeder voor oplossing voor injectie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke injectieflacon bevat 100 mg mepolizumab. Na reconstitutie bevat elke ml oplossing 100 mg mepolizumab.
Mepolizumab is een gehumaniseerd monoklonaal antilichaam dat met behulp van DNA-recombinatietechniek is vervaardigd in ovariumcellen van Chinese hamsters.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder voor oplossing voor injectie
Gelyofiliseerd wit poeder.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Ernstig eosinofiel astma
Nucala is geïndiceerd als aanvullende behandeling voor ernstig refractair eosinofiel astma bij volwassenen, adolescenten en kinderen vanaf 6 jaar (zie rubriek 5.1).
Chronische rinosinusitis met neuspoliepen (CRSwNP)
Nucala is geïndiceerd als aanvullende behandeling bij intranasale corticosteroïden voor de behandeling van volwassen patiënten met ernstige CRSwNP voor wie een behandeling met systemische corticosteroïden en/of chirurgie geen adequate ziektecontrole biedt.
Eosinofiele granulomatose met polyangiitis (EGPA)
Nucala is geïndiceerd als aanvullende behandeling voor patiënten van 6 jaar en ouder met recidiverende of refractaire eosinofiele granulomatose met polyangiitis (EGPA).
Hypereosinofiel syndroom (HES)
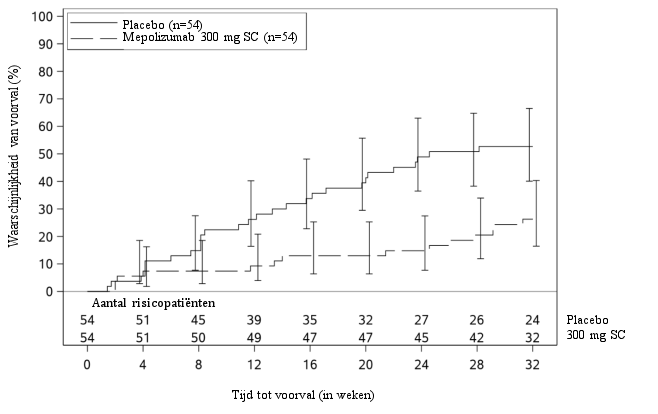
Nucala is geïndiceerd als aanvullende behandeling voor volwassen patiënten met inadequaat gecontroleerd hypereosinofiel syndroom zonder een identificeerbare niet‑hematologische secundaire oorzaak (zie rubriek 5.1).
4.2 Dosering en wijze van toediening
Nucala dient voorgeschreven te worden door artsen die ervaring hebben met de diagnose en behandeling van ernstig refractair eosinofiel astma, CRSwNP, EGPA of HES.
Dosering
Ernstig eosinofiel astma
Volwassenen en adolescenten in de leeftijd van 12 jaar en ouder
De aanbevolen dosering mepolizumab is 100 mg subcutaan toegediend eens per 4 weken.
Kinderen in de leeftijd van 6 tot en met 11 jaar
De aanbevolen dosering mepolizumab is 40 mg subcutaan toegediend eens per 4 weken.
Nucala is bedoeld voor een langetermijnbehandeling. De noodzaak om de behandeling voort te zetten dient ten minste jaarlijks overwogen te worden op basis van een door een arts te maken beoordeling van de ziekte‑ernst van de patiënt en de mate van beheersing van exacerbaties.
CRSwNP
Volwassenen
De aanbevolen dosering mepolizumab is 100 mg subcutaan toegediend eens per 4 weken.
Nucala is bedoeld voor een langetermijnbehandeling. Andere behandelingen kunnen overwogen worden bij patiënten die na 24 weken niet op de behandeling voor CRSwNP hebben gereageerd. Sommige patiënten die in eerste instantie een gedeeltelijke respons laten zien, kunnen daarna verbeteren met voortgezette behandeling na 24 weken.
EGPA
Volwassenen en adolescenten in de leeftijd van 12 jaar en ouder
De aanbevolen dosering mepolizumab is 300 mg subcutaan toegediend eens per 4 weken.
De dosering van mepolizumab bij kinderen en adolescenten van 6 tot en met 17 jaar oud met EGPA werd ondersteund door modelleer- en simulatiegegevens (zie rubriek 5.2).
Kinderen in de leeftijd van 6 tot en met 11 jaar die ≥ 40 kg wegen
De aanbevolen dosering mepolizumab is 200 mg subcutaan toegediend eens per 4 weken.
Kinderen in de leeftijd van 6 tot en met 11 jaar die < 40 kg wegen
De aanbevolen dosering mepolizumab is 100 mg subcutaan toegediend eens per 4 weken.
Nucala is bedoeld voor een langetermijnbehandeling. De noodzaak om de behandeling voort te zetten dient ten minste jaarlijks getoetst te worden op basis van een door een arts te maken beoordeling van de ziekte‑ernst van de patiënt en verbetering van de symptoomcontrole.
Bij patiënten die levensbedreigende vormen van EGPA ontwikkelen, dient de noodzaak om de behandeling voort te zetten ook beoordeeld te worden, omdat Nucala bij deze populatie niet onderzocht is.
HES
Volwassenen
De aanbevolen dosering mepolizumab is 300 mg subcutaan toegediend eens per 4 weken.
Nucala is bedoeld voor een langetermijnbehandeling. De noodzaak om de behandeling voort te zetten dient ten minste jaarlijks getoetst te worden op basis van een door een arts te maken beoordeling van de ziekte‑ernst van de patiënt en het niveau van symptoomcontrole.
Bij patiënten die levensbedreigende vormen van HES ontwikkelen, dient de noodzaak om de behandeling voort te zetten ook beoordeeld te worden, omdat Nucala bij deze populatie niet onderzocht is.
Speciale populaties
Oudere patiënten
Er is geen dosisaanpassing nodig voor oudere patiënten (zie rubriek 5.2).
Nier‑ en leverfunctiestoornis
Er is geen dosisaanpassing nodig voor patiënten met een nier‑ of leverfunctiestoornis (zie rubriek 5.2).
Pediatrische patiënten
Ernstig eosinofiel astma
Kinderen in de leeftijd tot 6 jaar
De veiligheid en werkzaamheid van mepolizumab bij kinderen jonger dan 6 jaar oud zijn nog niet vastgesteld.
Er zijn geen gegevens beschikbaar.
Kinderen in de leeftijd van 6 tot en met 17 jaar
De dosering van mepolizumab bij kinderen en adolescenten van 6 tot en met 17 jaar oud met ernstig refractair eosinofiel astma is bepaald op basis van beperkte werkzaamheids-, farmacokinetiek- en farmacodynamiekonderzoeken en wordt ondersteund met modelleer- en simulatiegegevens (zie rubriek 5.1 en 5.2).
CRSwNP bij kinderen in de leeftijd tot 18 jaar
De veiligheid en werkzaamheid bij kinderen jonger dan 18 jaar oud met CRSwNP zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
EGPA bij kinderen in de leeftijd tot 6 jaar
De veiligheid en werkzaamheid van mepolizumab bij kinderen jonger dan 6 jaar oud zijn niet vastgesteld.
Er zijn geen gegevens beschikbaar.
HES bij kinderen in de leeftijd tot 18 jaar
De veiligheid en werkzaamheid van mepolizumab bij kinderen en adolescenten jonger dan 18 jaar oud zijn nog niet vastgesteld.
De momenteel beschikbare gegevens worden beschreven in rubrieken 4.8, 5,1 en 5.2, maar er kan geen doseringsadvies worden gegeven.
Wijze van toediening
Nucala is uitsluitend bestemd voor subcutane injectie en moet worden toegediend door een beroepsbeoefenaar in de gezondheidszorg. Het kan worden geïnjecteerd in de bovenarm, het bovenbeen of de buik.
Voor doses waarvoor meer dan één injectie nodig is, wordt aangeraden dat iedere injectie ten minste 5 cm uit elkaar toegediend wordt.
Het poeder moet voor toediening worden opgelost en de gereconstitueerde oplossing moet direct gebruikt worden. Voor instructies over reconstitutie van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6.
Elke mepolizumab-injectieflacon mag maar voor één patiënt gebruikt worden en het eventuele restant van de injectieflacon moet worden weggegooid.
4.3 Contra‑indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Ernstig eosinofiel astma
In placebogecontroleerde onderzoeken bij volwassen en adolescente patiënten met ernstig refractair eosinofiel astma, waren de meest frequent gemelde bijwerkingen tijdens de behandeling hoofdpijn (20%), reacties op de injectieplaats (8%) en rugpijn (6%).
CRSwNP
In een placebogecontroleerd onderzoek bij patiënten met CRSwNP waren de meest frequent gemelde bijwerkingen tijdens de behandeling hoofdpijn (18%) en rugpijn (7%).
EGPA
In een placebogecontroleerd onderzoek bij patiënten met EGPA waren de meest frequent gemelde bijwerkingen tijdens de behandeling hoofdpijn (32%), reacties op de injectieplaats (15%) en rugpijn (13%). Systemische allergische/overgevoeligheidsreacties werden gemeld door 4% van de EGPA-patiënten.
HES
In een placebogecontroleerd onderzoek bij patiënten met HES waren de meest frequent gemelde bijwerkingen tijdens de behandeling hoofdpijn (13%), urineweginfectie (9%), reacties op de injectieplaats en pyrexie (beide 7%).
Lijst van bijwerkingen in tabelvorm
In de tabel hieronder staan de bijwerkingen vermeld uit placebogecontroleerde onderzoeken naar ernstig eosinofiel astma van patiënten die subcutaan (SC) 100 mg mepolizumab (n=263) kregen, uit een gerandomiseerd, dubbelblind, placebogecontroleerd onderzoek van 52 weken bij patiënten met CRSwNP die 100 mg mepolizumab SC (n=206) kregen, uit dubbelblind, placebogecontroleerd onderzoek van 52 weken bij patiënten met EGPA die 300 mg mepolizumab SC (n=68) kregen, uit een dubbelblind placebogecontroleerd onderzoek van 32 weken bij patiënten met HES die 300 mg mepolizumab SC (n=54) kregen en van spontane postmarketingmeldingen. Veiligheidsgegevens zijn ook beschikbaar van ‘open label’-extensieonderzoeken bij patiënten met ernstig refractair eosinofiel astma (n=998) die gedurende een mediane periode van 2,8 jaar (bereik 4 weken tot 4,5 jaar) werden behandeld. Het veiligheidsprofiel van mepolizumab bij patiënten met HES (n=102) die meededen aan een ‘open label’-extensieonderzoek van 20 weken was vergelijkbaar met het veiligheidsprofiel van patiënten in het placebogecontroleerde hoofdonderzoek.
De frequentie van bijwerkingen wordt gedefinieerd volgens de volgende conventie: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen iedere frequentiegroep worden bijwerkingen gerangschikt naar afnemende ernst.
Systeem/orgaanklasse | Bijwerkingen | Frequentie |
Infecties en parasitaire aandoeningen | Onderste luchtweginfectie | Vaak |
Immuunsysteemaandoeningen | Overgevoeligheidsreacties (systemisch allergisch)* | Vaak |
Zenuwstelselaandoeningen | Hoofdpijn | Zeer vaak |
Ademhalingsstelsel‑, borstkas‑ en mediastinumaandoeningen | Neusverstopping | Vaak |
Maagdarmstelselaandoeningen | Pijn in bovenbuik | Vaak |
Huid‑ en onderhuidaandoeningen | Eczeem | Vaak |
Skeletspierstelsel‑ en bindweefselaandoeningen | Rugpijn | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | Reacties in verband met de toediening (systemisch niet-allergisch)*** | Vaak |
* Systemische reacties, waaronder overgevoeligheid, zijn gemeld met een totale incidentie vergelijkbaar met die van placebo in de onderzoeken naar ernstig eosinofiel astma. Zie rubriek 4.4 voor voorbeelden van de gemelde samenhangende symptomen en een beschrijving van de tijd tot optreden.
**Afkomstig uit spontane postmarketing meldingen.
*** De meest voorkomende symptomen die samenhingen met meldingen van systemische niet‑allergische toedieningsgerelateerde reacties door patiënten in de onderzoeken naar ernstig eosinofiel astma waren uitslag, overmatig blozen en myalgie; deze symptomen werden zelden gemeld en bij < 1% van de patiënten die 100 mg mepolizumab subcutaan toegediend kregen.
Beschrijving van geselecteerde bijwerkingen
Systemische reacties, waaronder overgevoeligheidsreacties, bij CRSwNP
In het placebogecontroleerde onderzoek van 52 weken werden systemische allergische reacties (overgevoeligheidsreacties van type I) gemeld bij 2 patiënten (< 1%) in de groep die 100 mg mepolizumab kreeg en bij geen van de patiënten in de placebogroep. Andere systemische reacties werden gemeld door geen van de patiënten die mepolizumab 100 mg kregen en door 1 patiënt (< 1%) in de placebogroep.
Systemische reacties, waaronder overgevoeligheidsreacties, bij EGPA
In het placebogecontroleerde onderzoek van 52 weken was het percentage patiënten dat last kreeg van systemische (allergische en niet‑allergische) reacties 6% in de groep die 300 mg mepolizumab kreeg en 1% in de placebogroep. Systemische allergische/overgevoeligheidsreacties werden gemeld door 4% van de patiënten in de groep die 300 mg mepolizumab kreeg en 1% van de patiënten in de placebogroep. Systemische niet‑allergische reacties (angio-oedeem) werden gemeld door 1 patiënt (1%) in de groep die 300 mg mepolizumab kreeg en door geen van de patiënten in de placebogroep.
Systemische reacties, waaronder overgevoeligheidsreacties, bij HES
In het placebogecontroleerde onderzoek van 32 weken meldde 1 patiënt (2%) een systemische (andere) reactie in de groep die 300 mg mepolizumab kreeg (multifocale huidreactie) en geen van de patiënten in de placebogroep.
Lokale reacties op de injectieplaats
Ernstig eosinofiel astma
In placebogecontroleerde onderzoeken was de incidentie van lokale reacties op de injectieplaats met mepolizumab 100 mg subcutaan en placebo respectievelijk 8% en 3%. Deze bijwerkingen waren allemaal niet ernstig, licht tot matig in intensiteit en het merendeel verdween binnen een paar dagen. Lokale reacties op de injectieplaats traden vooral op aan het begin van de behandeling en bij de eerste 3 injecties en er waren minder meldingen bij daaropvolgende injecties. De meest frequent gemelde symptomen waren onder andere pijn, erytheem, zwelling, jeuk en een branderig gevoel.
CRSwNP
In het placebogecontroleerde onderzoek traden lokale reacties op de injectieplaats (bijv. erytheem, pruritus) op bij 2% van de patiënten die mepolizumab 100 mg kregen vergeleken met < 1% van de patiënten die placebo kregen.
EGPA
In het placebogecontroleerd onderzoek traden lokale reacties op de injectieplaats (bijv. pijn, erytheem, zwelling) op bij 15% van de patiënten die mepolizumab 300 mg kregen vergeleken met 13% van de patiënten die placebo kregen.
HES
In het placebogecontroleerde onderzoek traden lokale reacties op de injectieplaats (bijv. branderig gevoel, jeuk) op bij 7% van de patiënten die mepolizumab 300 mg kregen in vergelijking met 4% van de patiënten die placebo kregen.
Pediatrische patiënten
Ernstig eosinofiel astma
Zevenendertig adolescenten (leeftijd van 12-17 jaar oud) namen deel aan vier placebogecontroleerde onderzoeken (25 met mepolizumab intraveneus of subcutaan toegediend) met een duur van 24 tot 52 weken. Zesendertig pediatrische patiënten (leeftijd van 6-11 jaar oud) kregen subcutaan mepolizumab gedurende 12 weken in een ‘open label’-onderzoek. Na een onderbreking van de behandeling van 8 weken, kregen 30 van deze patiënten mepolizumab gedurende nogmaals 52 weken. Het veiligheidsprofiel was vergelijkbaar met dat bij volwassenen. Er zijn geen additionele bijwerkingen geïdentificeerd.
HES
Vier adolescenten van 12 tot en met 17 jaar deden mee aan het placebogecontroleerde onderzoek 200622, één adolescent kreeg 300 mg mepolizumab en 3 adolescenten kregen placebo gedurende 32 weken. Alle 4 adolescenten gingen verder met het 20 weken ‘open label’-extensieonderzoek 205203 (zie rubriek 5.1).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
GlaxoSmithKline Trading Services Limited
12 Riverwalk
Citywest Business Campus
Dublin 24
Ierland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/15/1043/001
EU/1/15/1043/002
10. DATUM VAN HERZIENING VAN DE TEKST
27/06/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3434750 | NUCALA PDR VOOR OPL VOOR OPL INJ FL 1 X 100MG | R03DX09 | € 1110,06 | - | Ja | € 12,5 | € 8,3 |
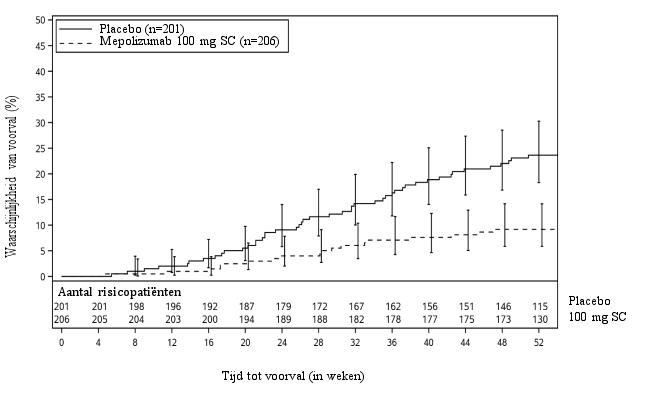 Figuur 1: Kaplan-Meiercurve voor tijd tot eerste operatie vanwege neuspoliepen
Figuur 1: Kaplan-Meiercurve voor tijd tot eerste operatie vanwege neuspoliepen