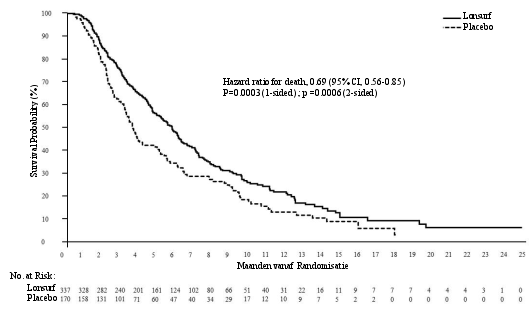
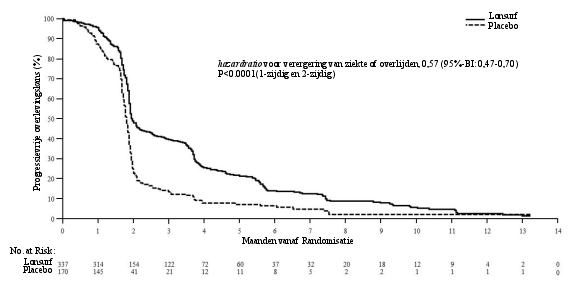
BIJLAGE I
SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Lonsurf 15 mg/6,14 mg filmomhulde tabletten
Lonsurf 20 mg/8,19 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Lonsurf 15 mg/6,14 mg filmomhulde tabletten
Elke filmomhulde tablet bevat 15 mg trifluridine en 6,14 mg tipiracil (in de vorm van hydrochloride).
Hulpstof met bekend effect
Elke filmomhulde tablet bevat 90,735 mg lactosemonohydraat.
Lonsurf 20 mg/8,19 mg filmomhulde tabletten
Elke filmomhulde tablet bevat 20 mg trifluridine en 8,19 mg tipiracil (in de vorm van hydrochloride).
Hulpstof met bekend effect
Elke filmomhulde tablet bevat 120,980 mg lactosemonohydraat.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet (tablet).
Lonsurf 15 mg/6,14 mg filmomhulde tabletten
Lonsurf 15 mg/6,14 mg is een witte, biconvexe, ronde, filmomhulde tablet met een diameter van 7,1 mm en een dikte van 2,7 mm, die is voorzien van een opdruk in grijze inkt van ‘15’ aan de ene zijde en ‘102’ en ‘15 mg’ aan de andere zijde.
Lonsurf 20 mg/8,19 mg filmomhulde tabletten
Lonsurf 20 mg/8,19 mg is een lichtrode, biconvexe, ronde, filmomhulde tablet met een diameter van 7,6 mm en een dikte van 3,2 mm, die is voorzien van een opdruk in grijze inkt van ‘20’ aan de ene zijde en ‘102’ en ‘20 mg’ aan de andere zijde.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Colorectaal carcinoom
Lonsurf is geïndiceerd in combinatie met bevacizumab voor de behandeling van volwassen patiënten met gemetastaseerd colorectaal carcinoom (CRC) die eerder twee kankerbehandelschema’s hebben gekregen, waaronder chemotherapie op basis van fluorpyrimidine, oxaliplatine en irinotecan, anti-VEGF-middelen en/of anti-EGFR-middelen.
Lonsurf is geïndiceerd als monotherapie voor de behandeling van volwassen patiënten met gemetastaseerd colorectaal carcinoom die eerder zijn behandeld met of niet in aanmerking komen voor bestaande therapieën, waaronder chemotherapie op basis van fluorpyrimidine, oxaliplatine en irinotecan, behandeling met anti-VEGF-middelen en behandeling met anti-EGFR-middelen.
Maagcarcinoom
Lonsurf is geïndiceerd als monotherapie voor de behandeling van volwassen patiënten met gemetastaseerd maagcarcinoom, met inbegrip van adenocarcinoom van de gastro-oesofageale junctie, die eerder zijn behandeld met ten minste twee eerdere systemische behandelingsschema’s voor gevorderde ziekte (zie rubriek 5.1).
4.2 Dosering en wijze van toediening
Lonsurf moet worden voorgeschreven door artsen die ervaring hebben met de toepassing van antikankerbehandelingen.
Dosering
De aanbevolen startdosis van Lonsurf bij volwassenen, als monotherapie of in combinatie met bevacizumab, is 35 mg/m²/dosis, oraal en tweemaal daags in te nemen op Dag 1 tot en met 5 en Dag 8 tot met 12 van elke 28-daagse cyclus tot ziekteprogressie of totdat onacceptabele toxiciteit optreedt (zie rubriek 4.4).
Wanneer Lonsurf in combinatie met bevacizumab wordt gebruikt voor de behandeling van gemetastaseerd CRC, is de dosis bevacizumab 5 mg/kg lichaamsgewicht eens per 2 weken. Zie de volledige productinformatie voor bevacizumab.
De dosis wordt berekend aan de hand van het lichaamsoppervlak (zie tabel 1). De dosis mag niet hoger zijn dan 80 mg/dosis.
De patiënt mag een vergeten of overgeslagen dosis niet inhalen.
Tabel 1 – Berekening van startdosis aan de hand van lichaamsoppervlak
Startdosis | Lichaamsoppervlak | Dosis in mg | Tabletten per dosis | Totale dagelijkse dosis (mg) | |
15 mg / 6,14 mg | 20 mg / 8,19 mg | ||||
35 mg/m² | < 1,07 | 35 | 1 | 1 | 70 |
1,07 - 1,22 | 40 | 0 | 2 | 80 | |
1,23 - 1,37 | 45 | 3 | 0 | 90 | |
1,38 - 1,52 | 50 | 2 | 1 | 100 | |
1,53 - 1,68 | 55 | 1 | 2 | 110 | |
1,69 - 1,83 | 60 | 0 | 3 | 120 | |
1,84 - 1,98 | 65 | 3 | 1 | 130 | |
1,99 - 2,14 | 70 | 2 | 2 | 140 | |
2,15 - 2,29 | 75 | 1 | 3 | 150 | |
≥ 2,30 | 80 | 0 | 4 | 160 | |
Aanbevolen dosisaanpassingen
Ten behoeve van de individuele veiligheid en verdraagbaarheid kan het nodig zijn de dosering aan te passen.
Maximaal 3 dosisverlagingen zijn toegestaan tot een minimumdosis van 20 mg/m² tweemaal daags. Na verlaging van de dosis mag deze niet meer worden verhoogd.
In geval van hematologische en/of niet-hematologische toxiciteit moet de patiënt de behandeling aan de hand van de in tabel 2, 3 en 4 genoemde criteria onderbreken en later hervatten met een verlaagde dosis.
Tabel 2 – Criteria voor onderbreking en hervatting van de behandeling bij
hematologische toxiciteit samenhangend met myelosuppressie
Parameter | Onderbrekingscriteria | Hervattingscriteriaa |
Neutrofielen | <0,5 109/l | 1,5 109/l |
Bloedplaatjes | <50 109/l | 75 109/l |
a Hervattingscriteria toe te passen aan het begin van de volgende cyclus voor alle patiënten ongeacht of is voldaan aan de onderbrekingscriteria.
Tabel 3 – Aanbevolen dosisaanpassingen voor Lonsurf in geval van
hematologische en niet-hematologische bijwerkingen
Bijwerking | Aanbevolen dosisaanpassing |
|
|
* Algemeen gebruikte terminologiecriteria voor bijwerkingen
Tabel 4 – Dosisverlagingen aan de hand van lichaamsoppervlak
Verlaagde dosis | Lichaamsoppervlak | Dosis in mg | Tabletten per dosis | Totale dagelijkse dosis (mg) | ||
15 mg / 6,14 mg | 20 mg / 8,19 mg | |||||
Dosisverlaging niveau 1: Van 35 mg/m² tot 30 mg/m² | ||||||
30 mg/m² | <1,09 | 30 | 2 | 0 | 60 | |
1,09 - 1,24 | 35 | 1 | 1 | 70 | ||
1,25 - 1,39 | 40 | 0 | 2 | 80 | ||
1,40 - 1,54 | 45 | 3 | 0 | 90 | ||
1,55 - 1,69 | 50 | 2 | 1 | 100 | ||
1,70 - 1,94 | 55 | 1 | 2 | 110 | ||
1,95 - 2,09 | 60 | 0 | 3 | 120 | ||
2,10 - 2,28 | 65 | 3 | 1 | 130 | ||
≥2,29 | 70 | 2 | 2 | 140 | ||
Dosisverlaging niveau 2: Van 30 mg/m² tot 25 mg/m² | ||||||
25 mg/m² | <1,10 | 25a | 2a | 1a | 50a | |
1,10 - 1,29 | 30 | 2 | 0 | 60 | ||
1,30 - 1,49 | 35 | 1 | 1 | 70 | ||
1,50 - 1,69 | 40 | 0 | 2 | 80 | ||
1,70 - 1,89 | 45 | 3 | 0 | 90 | ||
1,90 - 2,09 | 50 | 2 | 1 | 100 | ||
2,10 - 2,29 | 55 | 1 | 2 | 110 | ||
≥2,30 | 60 | 0 | 3 | 120 | ||
Dosisverlaging niveau 3: Van 25 mg/m² tot 20 mg/m² | ||||||
20 mg/m² | <1,14 | 20 | 0 | 1 | 40 | |
1.14 - 1.34 | 25a | 2a | 1a | 50a | ||
1,35 - 1,59 | 30 | 2 | 0 | 60 | ||
1,60 - 1,94 | 35 | 1 | 1 | 70 | ||
1,95 - 2,09 | 40 | 0 | 2 | 80 | ||
2,10 - 2,34 | 45 | 3 | 0 | 90 | ||
≥2,35 | 50 | 2 | 1 | 100 | ||
a Bij een totale dagelijkse dosis van 50 mg dient de patiënt 's ochtends 1 tablet van 20 mg/8,19 mg in te nemen en 's avonds 2 tabletten van 15 mg/6,14 mg.
Speciale populaties
Nierinsufficiëntie
- Lichte nierinsufficiëntie (creatinineklaring [CrCl] van 60 tot 89 ml/min) of matige nierinsufficiëntie (CrCl van 30 tot 59 ml/min)
Aanpassing van de startdosis wordt niet aanbevolen bij patiënten met lichte of matige nierinsufficiëntie (zie rubriek 4.4 en 5.2).
- Ernstige nierinsufficiëntie (CrCl 15 tot 29 ml/min)
Voor patiënten met ernstige nierinsufficiëntie wordt een startdosis van 20 mg/m² tweemaal daags aanbevolen (zie rubriek 4.4 en 5.2). Eén dosisverlaging tot een minimumdosis van 15 mg/m² tweemaal daags is toegestaan op basis van individuele veiligheid en verdraagbaarheid (zie tabel 5). Na verlaging van de dosis mag deze niet meer worden verhoogd. In geval van hematologische en/of niet-hematologische toxiciteit moet de patiënt de behandeling aan de hand van de in tabel 2, 3 en 5 genoemde criteria onderbreken en later hervatten met een verlaagde dosis.
Tabel 5 – Startdosis en dosisverlaging bij patiënten met ernstige nierinsufficiëntie aan de hand van lichaamsoppervlak
Verlaagde dosis | Lichaamsoppervlak | Dosis in mg | Tabletten per dosis | Totale dagelijkse | |
15 mg/6,14 mg | 20 mg/8,19 mg | ||||
Startdosis | |||||
20 mg/m² | < 1,14 | 20 | 0 | 1 | 40 |
1,14 – 1,34 | 25a | 2a | 1a | 50a | |
1,35 – 1,59 | 30 | 2 | 0 | 60 | |
1,60 – 1,94 | 35 | 1 | 1 | 70 | |
1,95 – 2,09 | 40 | 0 | 2 | 80 | |
2,10 – 2,34 | 45 | 3 | 0 | 90 | |
≥ 2,35 | 50 | 2 | 1 | 100 | |
Dosisverlaging: van 20 mg/m² naar 15 mg/m² | |||||
15 mg/m² | < 1,15 | 15 | 1 | 0 | 30 |
1,15 – 1,49 | 20 | 0 | 1 | 40 | |
1,50 – 1,84 | 25a | 2a | 1a | 50a | |
1,85 – 2,09 | 30 | 2 | 0 | 60 | |
2,10 – 2,34 | 35 | 1 | 1 | 70 | |
≥ 2,35 | 40 | 0 | 2 | 80 | |
a Bij een totale dagelijkse dosis van 50 mg dienen patiënten ’s ochtends 1 x 20 mg/8,19 mg tablet en ’s avonds 2 x 15 mg/6,14 mg tabletten in te nemen.
- Nierziekte in het laatste stadium (CrCl minder dan 15 ml/min of dialyse vereist)
Toediening wordt niet aanbevolen bij patiënten met een nierziekte in het laatste stadium aangezien er van dit soort patiënten geen gegevens beschikbaar zijn (zie rubriek 4.4).
Leverinsufficiëntie
- Lichte leverinsufficiëntie
Aanpassing van de startdosis wordt niet aanbevolen bij patiënten met lichte leverinsufficiëntie (zie rubriek 5.2).
- Matige of ernstige leverinsufficiëntie
Toediening van dit geneesmiddel wordt niet aanbevolen bij patiënten met matige of ernstige leverinsufficiëntie bij aanvang (criteriumgroep C en D van het National Cancer Institute [NCI] gedefinieerd als totaal bilirubine > 1,5 x ULN), aangezien een hogere incidentie van hyperbilirubinemie van graad 3 of 4 wordt waargenomen bij patiënten met matige leverinsufficiëntie bij aanvang, hoewel dit op zeer beperkte gegevens is gebaseerd (zie rubriek 4.4 en 5.2).
Oudere patiënten
Aanpassing van de startdosis is niet nodig bij patiënten van 65 jaar of ouder (zie rubriek 4.8, 5.1 en 5.2).
De hoeveelheid beschikbare werkzaamheids- en veiligheidsgegevens bij patiënten van ouder dan 75 jaar is beperkt.
Pediatrische patiënten
Er is geen relevante toepassing van Lonsurf bij pediatrische patiënten voor de indicaties van gemetastaseerd colorectaal carcinoom en gemetastaseerd maagcarcinoom.
Ras
Aanpassing van de startdosis is niet nodig op basis van het ras van de patiënt (zie rubriek 5.1 en 5.2). Er zijn beperkte gegevens beschikbaar over Lonsurf bij negroïde/Afro-Amerikaanse patiënten, maar er zijn geen biologische redenen om enig verschil te verwachten tussen deze subgroep en de populatie als geheel.
Wijze van toediening
Lonsurf is bestemd voor oraal gebruik. De tabletten moeten worden ingenomen met een glas water binnen 1 uur na beëindiging van het ontbijt en de avondmaaltijd.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stoffen of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De ernstigste bijwerkingen die werd waargenomen bij patiënten die Lonsurf innamen zijn beenmergsuppressie en gastro-intestinale toxiciteit (zie rubriek 4.4).
Lonsurf als monotherapie
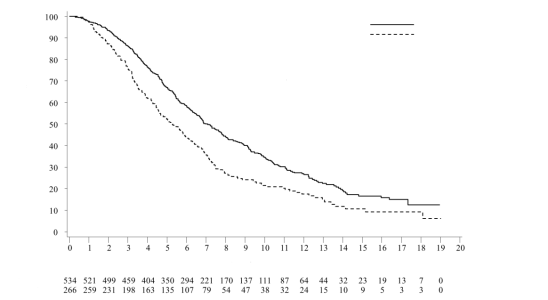
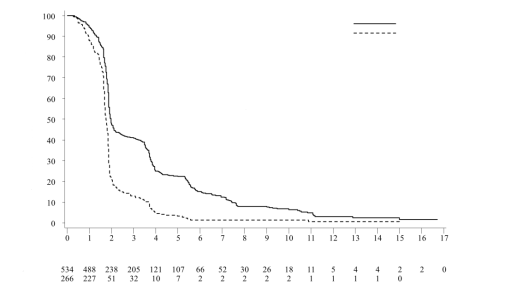
Het veiligheidsprofiel van Lonsurf als monotherapie is gebaseerd op gepoolde gegevens van 1.114 patiënten met gemetastaseerd colorectaal of maagcarcinoom in gecontroleerde klinische fase III-studies.
De vaakst voorkomende bijwerkingen (≥ 30%) zijn neutropenie (53% [34% ≥ graad 3]), misselijkheid (31% [1% ≥ graad 3]), vermoeidheid (31% [4% ≥ graad 3]) en anemie (30% [11% ≥ graad 3]).
De vaakst voorkomende bijwerkingen (≥ 2%) die resulteerden in onderbreking van de behandeling, dosisverlaging en uitstel of onderbreking van de dosisinname waren neutropenie, anemie, vermoeidheid, leukopenie, trombocytopenie, diarree en misselijkheid.
Lonsurf in combinatie met bevacizumab
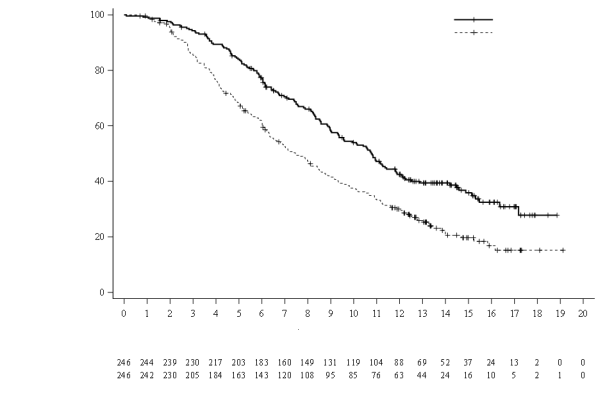
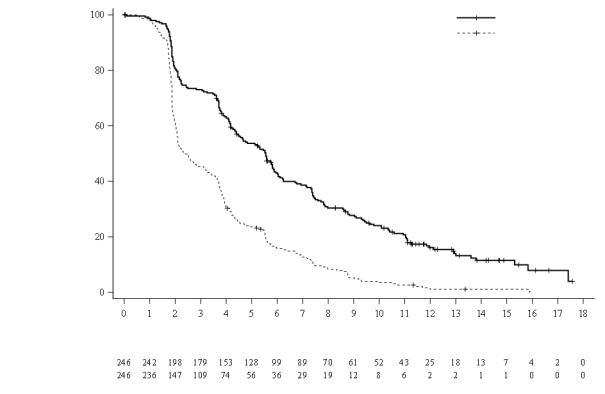
Het veiligheidsprofiel van Lonsurf in combinatie met bevacizumab is gebaseerd op de gegevens van 246 patiënten met gemetastaseerd colorectaal carcinoom in de gecontroleerde klinische fase III-studie SUNLIGHT.
De vaakst voorkomende bijwerkingen (≥ 30%) zijn neutropenie (69% [48% ≥ graad 3]), vermoeidheid (35% [3% ≥ graad 3]) en misselijkheid (33% [1% ≥ graad 3]).
De vaakst voorkomende bijwerkingen (≥ 2%) die resulteerden in onderbreking van de behandeling, dosisverlaging en uitstel of onderbreking van de dosisinname van Lonsurf gebruikt in combinatie met bevacizumab waren neutropenie, vermoeidheid, trombocytopenie, misselijkheid en anemie.
Wanneer Lonsurf in combinatie met bevacizumab werd gebruikt, was de frequentie van de volgende bijwerkingen verhoogd ten opzichte van Lonsurf als monotherapie: neutropenie (69% vs. 53%), ernstige neutropenie (48% vs. 34%), trombocytopenie (24% vs. 16%), stomatitis (11% vs. 6%).
Lijst van bijwerkingen (in tabelvorm)
Tabel 6 geeft een overzicht van de bijwerkingen waargenomen bij de 533 behandelde patiënten met gemetastaseerd colorectaal carcinoom in een placebogecontroleerde, klinische fase III-studie (RECOURSE), de 335 behandelde patiënten met gemetastaseerd maagcarcinoom in de placebogecontroleerde, klinische fase III-studie (TAGS), de 246 patiënten die met Lonsurf als monotherapie werden behandeld en de 246 patiënten die met Lonsurf in combinatie met bevacizumab werden behandeld voor gemetastaseerd colorectaal carcinoom in de gecontroleerde klinische fase III-studie SUNLIGHT. Deze bijwerkingen zijn geclassificeerd volgens de systeem/orgaanklasse (SOC: system organ class) en voor de beschrijving van de soort bijwerkingen, synoniemen ervan en gerelateerde aandoeningen zijn de van toepassing zijnde termen uit de Medical Dictionary for Regulatory Activities (MedDRA) gebruikt.
De bijwerkingen waarvan bekend is dat ze met Lonsurf alleen of met bevacizumab optreden, kunnen tijdens behandeling met deze geneesmiddelen in combinatie optreden, ook al werden deze reacties niet gerapporteerd in klinische studies met combinatietherapie.
De bijwerkingen zijn naar frequentie gegroepeerd. De frequentiegroepen zijn als volgt gedefinieerd: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100) en zelden (≥ 1/10.000, < 1/1.000).
Binnen elke frequentiegroep zijn de bijwerkingen gerangschikt op volgorde van afnemende ernst.
Tabel 6 - Bijwerkingen gerapporteerd in klinische studies door patiënten die behandeld werden met Lonsurf
Systeem/orgaanklasse | Bijwerkingen | Frequentie | |
| Monotherapie | Combinatie met bevacizumab | |
Infecties en parasitaire aandoeningen | Onderste luchtweginfectie | Vaak | - |
Neutropenische sepsis | Soms | - | |
| Galweginfectie | Soms | - |
| Infectie | Soms | Vaak |
| Urineweginfectie | Soms | Soms |
| Bacteriële infectie | Soms | - |
| Candida-infectie | Soms | - |
| Conjunctivitis | Soms | - |
| Herpes zoster | Soms | - |
| Influenza | Soms | - |
| Bovenste luchtweginfectie | Soms | - |
| Enteritis infectiosa | Zelden | - |
| Septische shockb | Zelden | - |
| Gingivitis | Zelden | Soms |
| Tinea pedis | Zelden | - |
Neoplasmata, benigne, maligne en niet-gespecificeerd | Kankerpijn | Soms | - |
Bloed- en lymfestelselaandoeningen | Anemie | Zeer vaak | Zeer vaak |
Neutropenie | Zeer vaak | Zeer vaak | |
| Leukopenie | Zeer vaak | Vaak |
| Trombocytopenie | Zeer vaak | Zeer vaak |
| Febriele neutropenie | Vaak | Soms |
| Lymfopenie | Vaak | Vaak |
| Pancytopenie | Soms | Soms |
| Erytropenie | Soms | - |
| Leukocytose | Soms | - |
| Monocytopenie | Soms | - |
| Monocytose | Soms | - |
| Granulocytopenie | Zelden | - |
Voedings- en stofwisselingsstoornissen | Verminderde eetlust | Zeer vaak | Zeer vaak |
Hypoalbuminemie | Vaak | Soms | |
| Dehydratie | Soms | - |
| Hyperglykemie | Soms | Soms |
| Hyperkaliëmie | Soms | - |
| Hypocalciëmie | Soms | - |
| Hypokaliëmie | Soms | - |
| Hyponatriëmie | Soms | - |
| Hypofosfatemie | Soms | - |
| Jicht | Zelden | - |
| Hypernatriëmie | Zelden | - |
Psychische stoornissen | Angst | Soms | - |
| Insomnie | Soms | - |
Zenuwstelselaandoeningen | Dysgeusie | Vaak | Vaak |
| Duizeligheid | Soms | Vaak |
| Hoofdpijn | Soms | Vaak |
| Perifere neuropathie | Soms | Soms |
| Paresthesie | Soms | Soms |
| Lethargie | Soms | - |
| Neurotoxiciteit | Soms | - |
| Brandend gevoel | Zelden | - |
| Dysesthesie | Zelden | - |
| Hyperesthesie | Zelden | - |
| Hypo-esthesie | Zelden | - |
| Syncope | Zelden | - |
Oogaandoeningen | Cataract | Zelden | - |
| Diplopie | Zelden | - |
| Droge ogen | Zelden | - |
| Wazig zien | Zelden | - |
| Verminderde gezichtsscherpte | Zelden | - |
Evenwichtsorgaan- en ooraandoeningen | Vertigo | Soms | - |
Oorklachten | Zelden | - | |
Hartaandoeningen | Angina pectoris | Soms | - |
| Arrhythmia | Soms | - |
| Palpitaties | Soms | - |
Bloedvataandoeningen | Hypertensie | Soms | Vaak |
| Flush | Soms | - |
| Hypotensie | Soms | - |
| Embolisatie | Zelden | - |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Dyspneu | Vaak | Vaak |
Longembolieb | Soms | - | |
| Dysfonie | Soms | Soms |
| Hoesten | Soms | - |
| Epistaxis | Soms | - |
| Rinorroe | Zelden | Soms |
| Orofaryngeale pijn | Zelden | - |
| Pleurale effusie | Zelden | - |
Maagdarmstelselaandoeningen | Diarree | Zeer vaak | Zeer vaak |
| Braken | Zeer vaak | Zeer vaak |
| Nausea | Zeer vaak | Zeer vaak |
| Buikpijn | Vaak | Vaak |
| Stomatitis | Vaak | Zeer vaak |
| Constipatie | Vaak | Vaak |
| Ileus | Soms | - |
| Gastro-intestinale hemorragie | Soms | - |
| Colitis | Soms | Soms |
| Zweervorming in de mond | Soms | Vaak |
| Afwijkingen in de mond | Soms | Vaak |
| Abdominale distensie | Soms | Soms |
| Anale ontsteking | Soms | Soms |
| Dyspepsie | Soms | Soms |
| Flatulentie | Soms | Soms |
| Gastritis | Soms | - |
| Gastro-oesofageale refluxziekte | Soms | - |
| Glossitis | Soms | - |
| Vertraagde maaglediging | Soms | - |
| Kokhalzen | Soms | - |
| Tandproblemen | Soms | - |
| Ascites | Zelden | - |
| Acute pancreatitis | Zelden | - |
| Subileus | Zelden | - |
| Slechte adem | Zelden | - |
| Buccale poliep | Zelden | - |
| Hemorragische enterocolitis | Zelden | - |
| Tandvleesbloeding | Zelden | - |
| Oesofagitis | Zelden | - |
| Periodontale ziekte | Zelden | - |
| Proctalgie | Zelden | - |
| Reflux gastritis | Zelden | - |
Lever- en galaandoeningen | Hyperbilirubinemie | Vaak | Vaak |
| Hepatotoxemie | Soms | - |
| Biliaire dilatatie | Zelden | - |
Huid- en onderhuidaandoeningen | Alopecia | Vaak | Vaak |
Droge huid | Vaak | Vaak | |
| Pruritus | Vaak | Soms |
| Rash | Vaak | Soms |
| Nagelafwijkingen | Soms | Soms |
| Palmair-plantaire erytrodysesthesiesyndroomc | Soms | Soms |
| Acne | Soms | - |
| Hyperhidrose | Soms | - |
| Urticaria | Soms | - |
| Blister | Zelden | - |
| Erytheem | Zelden | - |
| Lichtgevoelige reactie | Zelden | - |
| Exfoliatie van de huid | Zelden | - |
Skeletspierstelsel- en bindweefselaandoeningen | Artralgie | Soms | Vaak |
Myalgie | Soms | Vaak | |
| Spierzwakte | Soms | Soms |
| Pijn in ledematen | Soms | Soms |
| Botpijn | Soms | - |
| Ledematenongemak | Soms | - |
| Spierspasmen | Soms | - |
| Gezwollen gewrichten | Zelden | - |
Nier- en urinewegaandoeningen | Proteïnurie | Vaak | Soms |
Nierfalen | Soms | - | |
| Hematurie | Soms | - |
| Stoornis van de urinelozing | Soms | - |
| Niet-infectieuze cystitis | Zelden | - |
| Leukocyturie | Zelden | - |
Voortplantingsstelsel- en borstaandoeningen | Stoornis van de menstruatiecyclus | Zelden | Soms |
Algemene aandoeningen en toedieningsplaatsstoornissen | Vermoeidheid | Zeer vaak | Zeer vaak |
Pyrexie | Vaak | Soms | |
| Mucositis | Vaak | Soms |
| Malaise | Vaak | - |
| Oedeem | Vaak | - |
| Verslechtering van de algemene lichamelijke gezondheid | Soms | - |
| Pijn | Soms | Soms |
| Gevoel van veranderde lichaamstemperatuur | Soms | - |
| Xerose | Zelden | - |
Onderzoeken | Gewichtsafname | Vaak | Vaak |
| Verhoogd leverenzym | Vaak | Vaak |
| Verhoogde concentratie alkalische fosfatase in het bloed | Vaak | Soms |
| Verhoogde lactaatdehydrogenase-concentratie in het bloed | Soms | - |
| Verhoogd C-reactief proteïne | Soms | - |
| Verhoogde creatinine-concentratie in het bloed | Soms | - |
| Verhoogd bloedureum | Soms | - |
| Verlaagd hematocriet | Soms | - |
| Verhoogde INR (International normalised ratio) | Soms | - |
| Verlengde geactiveerde partiële tromboplastinetijd | Zelden | - |
| QT-verlenging in elektrocardiogram | Zelden | - |
| Verlaagd totaaleiwit | Zelden | - |
- Verschillende voorkeurstermen van MedDRA die klinisch als hetzelfde werden beschouwd, zijn samengevat in één enkele term.
- Er zijn fatale gevallen gerapporteerd.
- Reactie van de huid op handen en voeten.
Oudere patiënten
Bij patiënten van 65 jaar en ouder die Lonsurf als monotherapie kregen kwamen de volgende behandelingsgerelateerde bijwerkingen vaker (≥ 5%) voor dan bij patiënten jonger dan 65 jaar: neutropenie (58,9% vs. 48,2%), ernstige neutropenie (41,3% vs. 27,9%), anemie (36,5% vs. 25,2%), ernstige anemie (14,1% vs. 8,9%), verminderde eetlust (22,6% vs. 17,4%) en trombocytopenie (21,4% vs. 12,1%).
Wanneer Lonsurf in combinatie met bevacizumab werd gebruikt, kwamen de volgende behandelingsgerelateerde bijwerkingen bij patiënten van 65 jaar en ouder vaker (≥ 5%) voor dan bij patiënten jonger dan 65 jaar: neutropenie (75,0% vs. 65,1%), ernstige neutropenie (57,0% vs. 41,8%), vermoeidheid (39,0% vs. 32,2%), trombocytopenie (28,0% vs. 20,5%) en stomatitis (14,0% vs. 8,9%).
Infecties
In de placebogecontroleerde klinische fase III-studies kwamen behandelingsgerelateerde infecties vaker voor bij patiënten die met Lonsurf werden behandeld (5,8%) dan bij patiënten die placebo kregen (1,8%).
In de klinische studie in combinatie met bevacizumab traden behandelingsgerelateerde infecties ongeveer even vaak op bij patiënten die Lonsurf met bevacizumab kregen (2,8%) als bij patiënten die met Lonsurf werden behandeld (2,4%).
Proteïnurie
In de placebogecontroleerde klinische fase III-studies trad behandelingsgerelateerde proteïnurie vaker op bij patiënten die werden behandeld met Lonsurf (1,8%) dan bij hen die placebo kregen (0,9%); in alle gevallen ging het om proteïnurie graad 1 of 2 (zie rubriek 4.4).
In de klinische studie in combinatie met bevacizumab werd een behandelingsgerelateerde proteïnurie van graad 2 gemeld bij één patiënt die Lonsurf met bevacizumab kreeg (0,4%) en bij geen van de patiënten die met Lonsurf werden behandeld (zie rubriek 4.4).
Radiotherapie
De incidentie van alle hematologische en myelosuppressiegerelateerde bijwerkingen was bij patiënten die eerder radiotherapie ondergingen iets hoger dan bij patiënten die in de RECOURSE-studie geen radiotherapie hadden ondergaan (respectievelijk 54,6% en 49,2%). De incidentie van febriele neutropenie was hoger bij met Lonsurf behandelde patiënten die eerder radiotherapie ondergingen dan bij de patiënten die geen radiotherapie hadden gehad.
In de klinische studie in combinatie met bevacizumab werd geen verhoogde incidentie van alle hematologische en myelosuppressiegerelateerde bijwerkingen waargenomen bij patiënten die eerder radiotherapie ondergingen in vergelijking met patiënten zonder eerdere radiotherapie in beide groepen van SUNLIGHT: Lonsurf met bevacizumab (73,7% vs. 77,4%) en bij met Lonsurf behandelde patiënten (64,7% vs. 67,7%).
Ervaringen met het reeds op de markt gebrachte product bij patiënten met gevorderd en niet-operabel of terugkomend colorectaal carcinoom
Interstitiële longziekte is waargenomen bij patiënten die Lonsurf kregen nadat het middel goedgekeurd was.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico's van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website : www.eenbijwerkingmelden.be
e-mail : adr@fagg-afmps.be
Luxemburg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Les Laboratoires Servier
50 rue Carnot
92284 Suresnes Cedex
Frankrijk
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/16/1096/001-006
10. DATUM VAN HERZIENING VAN DE TEKST
07/2023
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3434818 | LONSURF 15MG/6,14MG FILMOMH TABL 20 | L01BC59 | - | € 575 | Ja | - | - |
| 3434883 | LONSURF 20MG/8,19MG FILMOMH TABL 20 | L01BC59 | - | € 766,67 | Ja | - | - |