SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Gazyvaro 1.000 mg concentraat voor oplossing voor infusie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Eén injectieflacon van 40 ml concentraat bevat 1.000 mg obinutuzumab, overeenkomend met een concentratie voor verdunning van 25 mg/ml.
Obinutuzumab is een type II gehumaniseerd anti-CD20 monoklonaal antilichaam van de subklasse IgG1, afgeleid door humanisering van het parentale muizenantilichaam B-Ly1 en door middel van recombinant-DNA-techniek geproduceerd in een ovariumcellijn van de Chinese hamster.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Concentraat voor oplossing voor infusie.
Heldere, kleurleuze tot lichtbruine vloeistof.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Chronische lymfatische leukemie (CLL)
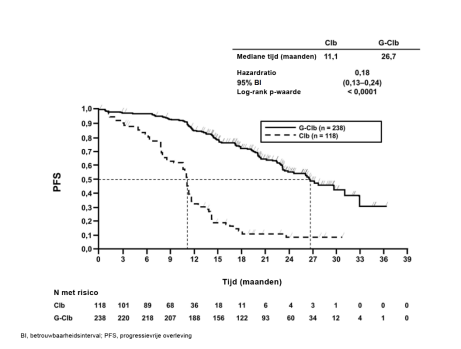
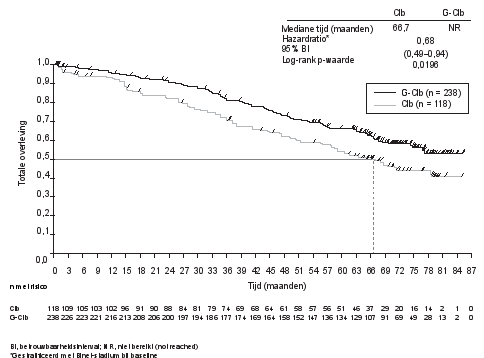
Gazyvaro in combinatie met chloorambucil is geïndiceerd voor de behandeling van volwassen patiënten met nog niet eerder behandelde chronische lymfatische leukemie (CLL) en met co-morbiditeiten waardoor zij niet in aanmerking komen voor een behandeling op basis van een volledige dosis fludarabine (zie rubriek 5.1).
Folliculair lymfoom (FL)
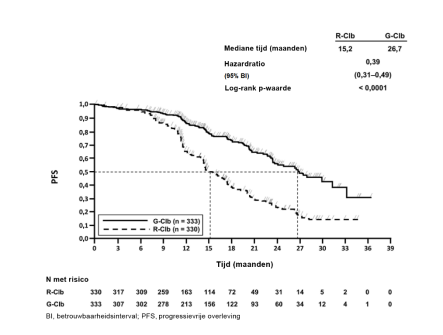
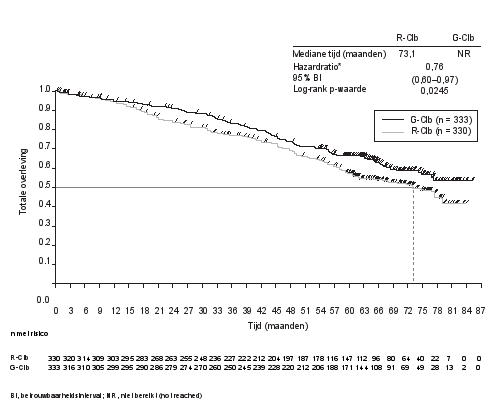
Gazyvaro in combinatie met chemotherapie, gevolgd door een Gazyvaro onderhoudsbehandeling bij patiënten die een respons bereiken, is geïndiceerd voor de behandeling van patiënten met nog niet eerder behandeld gevorderd folliculair lymfoom (zie rubriek 5.1).
Gazyvaro in combinatie met bendamustine, gevolgd door een Gazyvaro onderhoudsbehandeling is geïndiceerd voor de behandeling van patiënten met folliculair lymfoom (FL) die niet reageerden of progressie vertoonden tijdens of tot 6 maanden na rituximab of een rituximab-bevattende behandeling.
Lupus nefritis (LN)
Gazyvaro in combinatie met mycofenolaatmofetil (MMF) is geïndiceerd voor de behandeling van volwassen patiënten met actieve lupus nefritis (LN) van klasse III of IV, met of zonder gelijktijdige klasse V.
4.2 Dosering en wijze van toediening
Gazyvaro moet worden toegediend onder nauwlettend toezicht van een ervaren arts in een omgeving waar volledige reanimatiefaciliteiten direct beschikbaar zijn.
Dosering
Profylaxe en premedicatie tegen tumorlysissyndroom (TLS)
Patiënten met een hoge tumorlast en/of een hoog aantal circulerende lymfocyten (> 25 x 109/l) en/of een verminderde nierfunctie (CrCl < 70 ml/min) worden beschouwd als risicopatiënten voor TLS en moeten profylaxe krijgen. Profylaxe moet, volgens de standaardprocedures, bestaan uit adequate hydratie en toediening van uricostatica (bijv. allopurinol), of een geschikte alternatieve behandeling zoals bijvoorbeeld uraatoxidase (bijv. rasburicase), te starten 12–24 uur vóór de start van de infusie met Gazyvaro (zie rubriek 4.4). Patiënten moeten herhaalde profylaxe blijven krijgen voorafgaand aan iedere volgende infusie, indien dit noodzakelijk wordt geacht.
Profylaxe en premedicatie tegen infusiegerelateerde reacties (IRR's)
Premedicatie om het risico op infusiegerelateerde reacties te verlagen, staat vermeld in tabel 1 (zie ook rubriek 4.4). Premedicatie met een corticosteroïde wordt aanbevolen voor patiënten met FL en is vereist voor CLL-patiënten in de eerste cyclus en voor patiënten met LN (zie tabel 1). Premedicatie voor volgende infusies en andere premedicatie moet worden toegediend zoals hieronder beschreven.
Hypotensie, als symptoom van IRR's, kan optreden tijdens intraveneuze infusies met Gazyvaro. Daarom moet worden overwogen om geen antihypertensieve behandelingen te geven gedurende 12 uur vóór en tijdens elke infusie met Gazyvaro, en gedurende het eerste uur na de toediening (zie rubriek 4.4).
Tabel 1 Premedicatie toe te dienen vóór infusie met Gazyvaro om het risico op IRR's te verminderen (zie rubriek 4.4)
Indicatie/Dag van behandeling/Cyclus | Patiënten die premedicatie nodig hebben | Premedicatie | Toediening | |
Cyclus 1: | Alle patiënten | Intraveneus corticosteroïde1,4 | Afgerond ten minste 1 uur vóór de infusie met Gazyvaro | |
Oraal analgeticum/antipyreticum2 | Ten minste 30 minuten vóór de infusie met Gazyvaro | |||
Antihistaminicum3 | ||||
Cyclus 1: | Alle patiënten | Intraveneus corticosteroïde1 | Afgerond ten minste 1 uur vóór de infusie met Gazyvaro | |
Oraal analgeticum/antipyreticum2 | Ten minste 30 minuten vóór de infusie met Gazyvaro | |||
Antihistaminicum3 | ||||
Alle volgende infusies voor CLL en FL | Patiënten zonder IRR tijdens het vorige infuus | Oraal analgeticum/antipyreticum2 | Ten minste 30 minuten vóór de infusie met Gazyvaro | |
Patiënten met een IRR (graad 1 of 2) bij het vorige infuus | Oraal analgeticum/antipyreticum2 | |||
Patiënten met een graad 3 IRR bij het vorige infuus OF | Intraveneus corticosteroïde1,4 | Afgerond ten minste 1 uur vóór de infusie met Gazyvaro | ||
Oraal analgeticum/antipyreticum2 | Ten minste 30 minuten vóór de infusie met Gazyvaro | |||
LN | Alle patiënten | Intraveneus corticosteroïde5 | Afgerond tussen 30 en 60 minuten vóór de infusie met Gazyvaro | |
Oraal analgeticum/antipyreticum6 | ||||
Antihistaminicum3 | ||||
1 100 mg prednison/prednisolon of 20 mg dexamethason of 80 mg methylprednisolon. Hydrocortison mag niet worden gebruikt omdat het niet effectief was in het verminderen van het aantal IRR’s.
2 bijv. 1.000 mg acetaminofen/paracetamol
3 bijv. 50 mg difenhydramine
4 Wanneer een corticosteroïde-bevattende chemotherapie op dezelfde dag als Gazyvaro wordt toegediend, kan de corticosteroïde oraal worden toegediend mits deze ten minste 60 minuten vóór Gazyvaro wordt gegeven. In dat geval is er geen aanvullende intraveneuze toediening van corticosteroïde als premedicatie nodig.
5 80 mg IV methylprednisolon
6 650-1.000 mg acetaminofen/paracetamol
Dosis
Chronische lymfatische leukemie (CLL, in combinatie met chloorambucil1)
Voor patiënten met CLL is de aanbevolen dosis Gazyvaro in combinatie met chloorambucil vermeld in tabel 2.
Cyclus 1
De aanbevolen dosis Gazyvaro in combinatie met chloorambucil is 1.000 mg toegediend op dag 1 en 2 (of op dag 1, vervolg), en op dag 8 en dag 15 van de eerste 28-daagse behandelcyclus.
Er moeten twee infusiezakken worden klaargemaakt voor de infusie op dag 1 en 2 (100 mg voor dag 1 en 900 mg voor dag 2). Indien de eerste zak zonder wijzigingen in de infusiesnelheid of zonder onderbrekingen in zijn geheel kon worden toegediend, mag de tweede zak op dezelfde dag worden toegediend (geen uitstel van de dosis nodig, geen herhaling van de premedicatie) op voorwaarde dat voldoende tijd, juiste omstandigheden en medisch toezicht beschikbaar zijn gedurende de hele infusie. Indien er wijzigingen worden aangebracht in de infusiesnelheid of onderbrekingen zijn tijdens de eerste 100 mg, moet de tweede zak op de volgende dag worden toegediend.
Cycli 2–6
De aanbevolen dosis Gazyvaro in combinatie met chloorambucil is 1.000 mg toegediend op dag 1 van elke cyclus.
Tabel 2 De dosis Gazyvaro toe te dienen gedurende 6 behandelcycli van elk 28 dagen voor patiënten met CLL
Cyclus | Behandeldag | Dosis Gazyvaro |
Cyclus 1 | Dag 1 | 100 mg |
Dag 2 | 900 mg | |
Dag 8 | 1.000 mg | |
Dag 15 | 1.000 mg | |
Cycli 2–6 | Dag 1 | 1.000 mg |
1 Zie rubriek 5.1 voor informatie over chloorambucilgebruik
Behandelingsduur
Zes behandelcycli van elk 28 dagen.
Uitgestelde of gemiste doses
Wanneer een geplande dosis Gazyvaro wordt gemist, moet deze zo snel mogelijk worden toegediend. Wacht niet tot de volgende geplande dosis. Tussen de doses moet het geplande doseringsinterval voor Gazyvaro worden gehandhaafd.
Folliculair lymfoom
Voor patiënten met FL is de aanbevolen dosis Gazyvaro in combinatie met chemotherapie vermeld in tabel 3.
Patiënten met nog niet eerder behandeld folliculair lymfoom
Inductie (in combinatie met chemotherapie2)
Gazyvaro moet met chemotherapie als volgt worden toegediend:
Zes 28-dagen cycli in combinatie met bendamustine2 of,
Zes 21-dagen cycli in combinatie met cyclofosfamide, doxorubicine, vincristine, prednisolon (CHOP), gevolgd door 2 additionele cycli van alleen Gazyvaro of,
Acht 21-dagen cycli in combinatie met cyclofosfamide, vincristine en prednison/prednisolon/methylprednisolon (CVP).
Onderhoudsbehandeling
Patiënten met een complete of gedeeltelijke respons op de inductiebehandeling met Gazyvaro in combinatie met chemotherapie (CHOP of CVP of bendamustine) moeten eenmaal per 2 maanden gedurende 2 jaar of tot ziekteprogressie (afhankelijk van wat zich het eerst voordoet), 1.000 mg Gazyvaro als monotherapie blijven ontvangen als onderhoudsbehandeling.
Patiënten met folliculair lymfoom die niet reageerden of progressie vertoonden tijdens of tot 6 maanden na rituximab of een rituximab-bevattende behandeling
Inductie (in combinatie met bendamustine2)
Gazyvaro moet in zes 28-dagen cycli in combinatie met bendamustine2 worden toegediend.
Onderhoudsbehandeling
Patiënten met een complete of gedeeltelijke respons op de inductiebehandeling (d.w.z. de eerste 6 behandelcycli) met Gazyvaro in combinatie met bendamustine of bij wie de ziekte stabiel is, moeten Gazyvaro monotherapie 1.000 mg blijven ontvangen als onderhoudsbehandeling eenmaal per 2 maanden gedurende 2 jaar of tot ziekteprogressie (afhankelijk van wat zich het eerst voordoet).
Tabel 3 Folliculair lymfoom: De dosis Gazyvaro toe te dienen gedurende inductiebehandeling, gevolgd door onderhoudsbehandeling
Cyclus | Behandeldag | Dosis Gazyvaro |
Cyclus 1 | Dag 1 | 1.000 mg |
Dag 8 | 1.000 mg | |
Dag 15 | 1.000 mg | |
Cycli 2–6 | Dag 1 | 1.000 mg |
Onderhoudsbehandeling | Elke 2 maanden gedurende 2 jaar of tot ziekteprogressie (afhankelijk van wat zich het eerst voordoet) | 1.000 mg |
2 Zie rubriek 5.1 voor informatie over bendamustinegebruik
Behandelingsduur
Inductiebehandeling van ongeveer zes maanden (zes behandelcycli met Gazyvaro van elk 28 dagen wanneer in combinatie met bendamustine, of acht behandelcycli met Gazyvaro van elk 21 dagen wanneer in combinatie met CHOP of CVP) gevolgd door onderhoudsbehandeling eenmaal per 2 maanden gedurende 2 jaar of tot ziekteprogressie (afhankelijk van wat zich het eerst voordoet).
Uitgestelde of gemiste doses
Wanneer een geplande dosis Gazyvaro wordt gemist, moet deze zo snel mogelijk worden toegediend. Sla de dosis niet over of wacht niet tot de volgende geplande dosis.
Wanneer toxiciteit optreedt vóór cyclus 1 dag 8 of cyclus 1 dag 15, waardoor uitstel van behandeling nodig is, dan moeten deze doses na het verhelpen van de toxiciteit worden toegediend. Door de opgelopen vertraging in Cyclus 1 worden in zulke gevallen de vervolgafspraken en de start van Cyclus 2 opgeschoven.
Volg gedurende de onderhoudsbehandeling het originele doseringsschema voor de vervolgdoseringen.
Lupus nefritis
De aanbevolen dosering van Gazyvaro is 1.000 mg intraveneus toegediend (zie tabel 4).
Gazyvaro moet worden gebruikt in combinatie met mycofenolaatmofetil.
Tabel 4 Dosis Gazyvaro voor patiënten met lupus nefritis
Dosisnummer | Tijdstip van behandeling | Dosis Gazyvaro |
1 | Eerste infusie | 1.000 mg |
2 | Week 2 | 1.000 mg |
3 | Week 24 | 1.000 mg |
4 | Week 26 | 1.000 mg |
5* en daaropvolgend | Elke 6 maanden | 1.000 mg |
*Dosis 5 moet zes maanden na dosis 4 worden toegediend
De conditie en respons van de patiënt moeten in week 76 en daarna worden geëvalueerd, en een adequate risico-batenanalyse moet worden gemaakt voor de beslissing over de voortzetting van de behandeling.
Uitgestelde of gemiste doses
Wanneer een geplande dosis Gazyvaro wordt gemist, moet deze zo snel mogelijk worden toegediend. Wacht niet tot de volgende geplande dosis. Het toedieningsschema moet worden aangepast zodat het juiste interval tussen de doses wordt aangehouden.
Dosiswijzigingen tijdens de behandeling (alle indicaties)
Er worden geen dosisverlagingen voor Gazyvaro aanbevolen.
Voor de behandeling van symptomatische bijwerkingen (waaronder IRR’s), zie de alinea hieronder (“Behandeling van IRR’s” of rubriek 4.4).
Speciale populaties
Ouderen
Er zijn geen dosisaanpassingen nodig bij oudere patiënten (zie rubriek 5.2). De veiligheid en werkzaamheid van Gazyvaro bij patiënten ouder dan 65 jaar met LN zijn niet vastgesteld.
Verminderde nierfunctie
Er is geen dosisaanpassing nodig bij patiënten met een lichte tot matig ernstig verminderde nierfunctie (creatinineklaring [CrCl] 30–89 ml/min) (zie rubriek 5.2). De veiligheid en werkzaamheid van Gazyvaro bij patiënten met een ernstig verminderde nierfunctie (CrCl < 30 ml/min) zijn niet vastgesteld (zie rubriek 4.8 en 5.2).
Verminderde leverfunctie
De veiligheid en werkzaamheid van Gazyvaro bij patiënten met een verminderde leverfunctie zijn niet vastgesteld. Er kunnen geen specifieke dosisaanbevelingen worden gegeven.
Pediatrische patiënten
De veiligheid en werkzaamheid van Gazyvaro bij kinderen en jongeren onder 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Gazyvaro is bestemd voor intraveneus gebruik. Het moet, na verdunning, worden toegediend als een intraveneuze infusie via een aparte intraveneuze lijn (zie rubriek 6.6). Gazyvaro-infusies mogen niet worden uitgevoerd als een intraveneuze push of bolusinjectie.
Voor instructies over verdunning van Gazyvaro voorafgaand aan toediening, zie rubriek 6.6.
Instructies over de infusiesnelheid staan vermeld in tabel 5-8.
Chronische lymfatische leukemie (CLL)
Tabel 5 Chronische lymfatische leukemie: Standaard infusiesnelheid bij afwezigheid van IRR's/overgevoeligheid en aanbevelingen in geval van een IRR tijdens de vorige infusie
Cyclus | Behandeldag | Infusiesnelheid |
Cyclus 1 | Dag 1 | Toediening met 25 mg/uur gedurende 4 uur. Verhoog de infusiesnelheid niet. |
Dag 2 | Wanneer er geen IRR optrad tijdens de vorige infusie, toediening met 50 mg/uur. | |
Dag 8 | Wanneer er geen IRR optrad tijdens de vorige infusie, waarbij de uiteindelijke infusiesnelheid 100 mg/uur of sneller was, kunnen de infusies worden gestart met een snelheid van 100 mg/uur en iedere 30 minuten verhoogd in stappen van 100 mg/uur tot een maximale snelheid van 400 mg/uur. | |
Dag 15 | ||
Cycli 2–6 | Dag 1 |
Folliculair lymfoom (FL)
Gazyvaro moet in cyclus 1 worden toegediend met de standaard infusiesnelheid (zie tabel 6). Bij patiënten die tijdens cyclus 1 geen infusiegerelateerde reacties (IRR’s) van graad ≥ 3 kregen, kan Gazyvaro vanaf cyclus 2 worden toegediend als een kortdurende infusie (ongeveer 90 minuten) (short duration infusion (SDI)) (zie tabel 7).
Tabel 6 Folliculair Lymfoom: Standaard infusiesnelheid en aanbevelingen in geval van een IRR tijdens de vorige infusie
Cyclus | Behandeldag | Infusiesnelheid |
Cyclus 1 | Dag 1 | Toediening met 50 mg/uur. De infusiesnelheid kan iedere 30 minuten worden verhoogd in stappen van 50 mg/uur tot een maximum van 400 mg/uur |
Dag 8 | Wanneer er geen IRR of een IRR van graad 1 optrad tijdens de vorige infusie, waarbij de uiteindelijke infusiesnelheid 100 mg/uur of sneller was, kunnen de infusies worden gestart met een snelheid van 100 mg/uur en iedere 30 minuten verhoogd in stappen van 100 mg/uur tot een maximale snelheid van 400 mg/uur. | |
Dag 15 | ||
Cycli 2-6 of 2-8 | Dag 1 | |
Onderhoudsbehandeling | Elke 2 maanden gedurende 2 jaar of tot ziekteprogressie (afhankelijk van wat zich het eerst voordoet) |
Tabel 7 Folliculair lymfoom: Kortdurende infusiesnelheid (SDI) en aanbevelingen in geval van een IRR tijdens de vorige infusie
Cyclus | Behandeldag | Infusiesnelheid |
Cycli 2‑6 of 2‑8 | Dag 1 | Wanneer er geen IRR van graad ≥ 3 optrad tijdens cyclus 1: |
Onderhoudsbehandeling | Elke 2 maanden gedurende 2 jaar of tot ziekteprogressie (afhankelijk van wat zich het eerst voordoet) |
Lupus nefritis
De eerste Gazyvaro-infusie moet worden toegediend met de standaard infusiesnelheid (zie tabel 8).
Tabel 8 Lupus nefritis: Standaard infusiesnelheid
Dosisnummer | Behandeldag | Infusiesnelheid |
1 | Eerste infusie | Toediening met een snelheid van 50 mg/uur. De infusiesnelheid kan iedere 30 minuten worden verhoogd in stappen van 50 mg/uur tot een maximum van 400 mg/uur. Voor behandeling van IRR’s die optreden tijdens de infusie, zie Behandeling van IRR’s. |
2 | Week 2 - twee weken na dosis 1 | Toediening met een snelheid van 100 mg/uur. De infusiesnelheid kan iedere 30 minuten worden verhoogd in stappen van 100 mg/uur tot een maximum van 400 mg/uur. |
3 | Week 24 | |
4 | Week 26 - twee weken na dosis 3 | |
5* en daaropvolgend | Om de 6 maanden |
*Dosis 5 moet zes maanden na dosis 4 worden toegediend
Behandeling van IRR’s
Voor de behandeling van IRR's kan een tijdelijke onderbreking, vermindering van de infusiesnelheid of stopzetting van de behandeling met Gazyvaro nodig zijn, zoals hieronder beschreven (zie ook rubriek 4.4).
Chronische lymfatische leukemie (CLL) en folliculair lymfoom (FL)
Graad 4 (levensbedreigend): de infusie moet worden gestopt en de behandeling moet permanent worden gestaakt.
Graad 3 (ernstig): de infusie moet tijdelijk worden gestopt en de symptomen moeten worden behandeld. Na het verdwijnen van de symptomen kan de infusie opnieuw worden gestart met ten hoogste de helft van de vorige snelheid (de snelheid die werd gebruikt op het tijdstip van optreden van de IRR) en, indien de patiënt geen IRR-symptomen ondervindt, kan de verhoging van de infusiesnelheid worden hervat met de stappen en intervallen passend bij de behandelingsdosis (zie tabel 5-7). Bij CLL-patiënten die de dag 1 dosis (cyclus 1) verdeeld over 2 dagen ontvangen, kan de infusiesnelheid op dag 1 na 1 uur weer worden verhoogd tot 25 mg/uur, maar mag niet verder worden verhoogd.
De infusie moet worden gestopt en de behandeling moet permanent worden gestaakt als de patiënt een tweede IRR van graad 3 krijgt.
Graad 1–2 (licht tot matig ernstig): de infusiesnelheid moet worden verlaagd en de symptomen moeten worden behandeld. Nadat de symptomen verdwenen zijn, kan de infusie worden voortgezet en, indien de patiënt geen IRR-symptomen ondervindt, kan de verhoging van de infusiesnelheid worden hervat met de stappen en intervallen passend bij de behandelingsdosis (zie tabel 5-7). Bij CLL-patiënten die de dag 1 dosis (cyclus 1) verdeeld over 2 dagen ontvangen, kan de infusiesnelheid op dag 1 na 1 uur weer worden verhoogd tot 25 mg/uur, maar mag niet verder worden verhoogd.
IRR’s die optreden tijdens SDI:
Graad 4 (levensbedreigend): de infusie moet worden gestopt en de behandeling moet permanent worden gestaakt.
Graad 3 (ernstig): de infusie moet tijdelijk worden gestopt en de symptomen moeten worden behandeld. Na het verdwijnen van de symptomen kan de infusie opnieuw worden gestart met ten hoogste de helft van de vorige snelheid (de snelheid die werd gebruikt op het tijdstip van optreden van de IRR) met een maximum van 400 mg/uur.
De infusie moet worden gestopt en de behandeling moet permanent worden gestaakt als de patiënt een tweede IRR van graad 3 krijgt bij het vervolgen van de infusie. Als de patiënt de infusie kan afronden zonder nieuwe IRR’s van graad 3, moet de volgende infusie worden gegeven met een snelheid die niet hoger is dan de standaard snelheid.
Graad 1–2 (licht tot matig ernstig): de infusiesnelheid moet worden verlaagd en de symptomen moeten worden behandeld. Zodra de symptomen verholpen zijn en de patiënt geen IRR symptomen meer ondervindt, kan de infusie worden voortgezet en kan de verhoging van de infusiesnelheid worden hervat met de stappen en intervallen passend bij de behandelingsdosis (zie tabel 6-7).
Lupus nefritis (LN)
- Graad 4 (levensbedreigend): de infusie moet worden gestopt en de behandeling moet permanent worden gestaakt.
- Graad 3 (ernstig): de infusie moet tijdelijk worden gestopt en de symptomen moeten worden behandeld. Na het verdwijnen van de symptomen kan de infusie opnieuw worden gestart met ten hoogste de helft van de vorige snelheid (de snelheid die werd gebruikt op het tijdstip van optreden van de IRR) en, indien de patiënt geen verdere IRR-symptomen ondervindt, kan de verhoging van de infusiesnelheid worden hervat met de stappen en intervallen passend bij de behandelingsdosis (zie tabel 8).
De infusie moet worden gestopt en de behandeling moet permanent worden gestaakt als de patiënt een tweede IRR van graad 3 krijgt.
- Graad 1-2 (licht tot matig ernstig): de infusiesnelheid moet worden verlaagd tot de helft van de snelheid die werd gebruikt op het moment van de reactie, en de symptomen moeten worden behandeld. Na het verdwijnen van de symptomen, kan de infusie worden voortgezet met de verlaagde infusiesnelheid gedurende nog eens 30 minuten. Indien de patiënt geen verdere IRR-symptomen ondervindt, kan de verhoging van de infusiesnelheid worden hervat met de stappen en intervallen passend bij de behandelingsdosis (zie tabel 8).
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Bijwerkingen worden apart weergegeven voor de indicaties oncologie (chronische lymfatische leukemie en folliculair lymfoom) en lupus nefritis.
Chronische lymfatische leukemie (CLL) en folliculair lymfoom (FL)
Samenvatting van het veiligheidsprofiel
De bijwerkingen uit klinische onderzoeken werden vastgesteld tijdens inductiebehandeling, onderhoudsbehandeling en follow-up bij indolent non-hodgkinlymfoom (iNHL) waaronder FL, en tijdens de behandeling en de follow-up bij CLL in de drie klinische hoofdonderzoeken:
BO21004/CLL11 (n=781): Nog niet eerder behandelde CLL-patiënten
BO21223/GALLIUM (n=1390): Nog niet eerder behandelde iNHL patiënten (86% van de patiënten had FL)
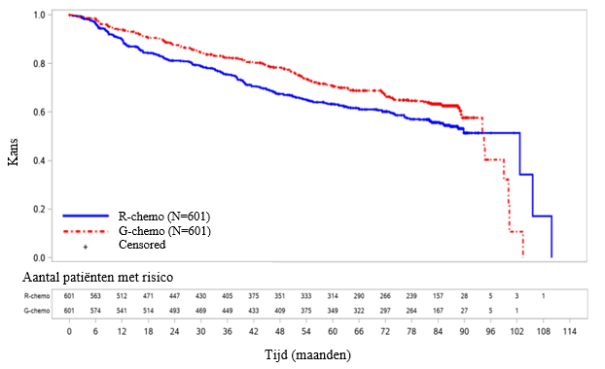
GAO4753g/GADOLIN (n=409): iNHL-patiënten (81% van de patiënten had FL) die geen respons of progressie vertoonden tijdens of tot 6 maanden na rituximab of een rituximab-bevattende behandeling.
In deze onderzoeken werd Gazyvaro onderzocht in combinatie met chloorambucil bij CLL en met bendamustine, CHOP of CVP gevold door Gazyvaro als onderhoudsbehandeling bij iNHL. De onderzoeken BO21223/GALLIUM en GAO4753g/GADOLIN includeerden patiënten met iNHL, waaronder FL. Om de meest begrijpelijke veiligheidsinformatie te verstrekken is daarom de analyse van bijwerkingen, die hieronder staat weergegeven, uitgevoerd op de gehele populatie (d.w.z. iNHL).
Tabel 9 geeft een overzicht van alle bijwerkingen, waaronder die van de hoofdonderzoeken (BO21004/CLL11, BO21223/GALLIUM, GAO4753g/GADOLIN) die zijn opgetreden met een hogere incidentie (verschil van ≥ 2%) vergeleken met de relevante vergelijkingsarm in ten minste één hoofdonderzoek bij:
Patiënten met CLL die Gazyvaro plus chloorambucil ontvingen, vergeleken met alleen chloorambucil of rituximab plus chloorambucil (onderzoek BO21004/CLL11)
Patiënten met nog niet eerder behandeld iNHL die Gazyvaro plus chemotherapie (bendamustine, CHOP, CVP) ontvingen, gevolgd door Gazyvaro onderhoudsbehandeling bij patiënten die een respons bereikten, vergeleken met rituximab plus chemotherapie gevolgd door rituximab als onderhoudsbehandeling bij patiënten die een respons bereikten (onderzoek BO21223/GALLIUM)
Patiënten met iNHL die geen respons hadden of een progressie vertoonden tijdens of tot 6 maanden na rituximab of een rituximab-bevattende behandeling die Gazyvaro plus bendamustine ontvingen, gevolgd door Gazyvaro als onderhoudsbehandeling bij sommige patiënten, vergeleken met alleen bendamustine (onderzoek GAO4753g/GADOLIN).
De incidenties die worden weergegeven in tabel 9 (alle graden en graad 3-5) betreft de hoogste incidentie voor die bijwerking gemeld in een van de drie onderzoeken.
Frequenties zijn gedefinieerd als: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000), niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen elke frequentiegroep zijn de bijwerkingen gepresenteerd in volgorde van afnemende ernst.
Lijst van bijwerkingen in tabelvorm
Tabel 9 Samenvatting van bijwerkingen die zijn gemeld bij patiënten# die Gazyvaro + chemotherapie* ontvingen
Systeem/orgaanklasse | Alle graden | Graad 3–5† | ||
Infecties en parasitaire aandoeningen | ||||
Zeer vaak | Bovensteluchtweginfectie, sinusitis§, urineweginfectie, pneumonie§, herpes zoster§, nasofaryngitis |
| ||
Vaak | Orale herpes, rinitis, faryngitis, longontsteking, influenza | Urineweginfectie, pneumonie, longontsteking, bovensteluchtweginfectie, sinusitis, herpes zoster | ||
Soms | Hepatitis B reactivatie | Nasofaryngitis, rhinitis, influenza, orale herpes | ||
Neoplasmata, benigne, maligne en niet-gespecificeerd (inclusief cysten en poliepen) | ||||
Vaak | Plaveiselcelcarcinoom van de huid, basaalcelcarcinoom | Plaveiselcelcarcinoom van de huid, basaalcelcarcinoom | ||
Bloed- en lymfestelselaandoeningen | ||||
Zeer vaak | Neutropenie§, trombocytopenie, anemie, leukopenie | Neutropenie, trombocytopenie | ||
Vaak | Febriele neutropenie | Anemie, leukopenie, febriele neutropenie | ||
Soms | Diffuse intravasculaire coagulatie## |
| ||
Voedings- en stofwisselingsstoornissen | ||||
Vaak | Tumorlysissyndroom, hyperurikemie, hypokaliëmie | Tumorlysissyndroom, hypokaliëmie | ||
Soms |
| Hyperurikemie | ||
Psychische stoornissen | ||||
Zeer vaak | Insomnia |
| ||
Vaak | Depressie, angst |
| ||
Soms |
| Insomnia, depressie, angst | ||
Zenuwstelselaandoeningen | ||||
Zeer vaak | Hoofdpijn |
| ||
Soms |
| Hoofdpijn | ||
Niet bekend | Progressieve multifocale leuko-encefalopathie |
| ||
Hartaandoeningen | ||||
Vaak | Atriumfibrilleren | Atriumfibrilleren | ||
Bloedvataandoeningen | ||||
Vaak | Hypertensie | Hypertensie | ||
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | ||||
Zeer vaak | Hoesten§ |
| ||
Vaak | Verstopte neus, rhinorrhoe, orofaryngeale pijn |
| ||
Soms |
| Hoesten, orofaryngeale pijn | ||
Maagdarmstelselaandoeningen | ||||
Zeer vaak | Diarree, obstipatie§ |
| ||
Vaak | Dyspepsie, aambeien, gastro-intestinale perforatie | Diarree | ||
Soms |
| Obstipatie, aambeien | ||
Huid- en onderhuidaandoeningen | ||||
Zeer vaak | Alopecia, pruritus |
| ||
Vaak | Eczeem |
| ||
Soms |
| Pruritus | ||
Skeletspierstelsel- en bindweefselaandoeningen | ||||
Zeer vaak | Atralgie§, rugpijn, pijn in de ledematen |
| ||
Vaak | Musculoskeletale borstpijn, botpijn | Pijn in de ledematen | ||
Soms |
| Artralgie, rugpijn, musculoskeletale borstpijn, botpijn | ||
Nier- en urinewegaandoeningen | ||||
Vaak | Dysurie, urine-incontinentie |
| ||
Soms |
| Dysurie, urine-incontinentie | ||
Algemene aandoeningen en toedieningsplaatsstoornissen | ||||
Zeer vaak | Pyrexie, asthenie, vermoeidheid |
| ||
Vaak | Pijn op de borst | Pyrexie, asthenie, vermoeidheid | ||
Soms |
| Pijn op de borst | ||
Immuunsysteemaandoeningen | ||||
Zelden | ‘cytokine release’-syndroom** |
| ||
Onderzoeken | ||||
Vaak | Daling van het aantal witte bloedcellen, daling van het aantal neutrofielen, gewichtstoename | Daling van het aantal witte bloedcellen, daling van het aantal neutrofielen | ||
Soms | Hypogammaglobulinemie |
| ||
Letsels, intoxicaties en verrichtingscomplicaties | ||||
Zeer vaak | IRR’s | IRR’s | ||
# Alleen de hoogste frequentie waargenomen in de onderzoeken is gemeld (gebaseerd op onderzoeken BO21004/niet eerder behandelde CLL, BO21223/niet eerder behandeld gevorderd iNHL en GAO4753g/rituximab-refractair iNHL) | ||||
Het bijwerkingenprofiel van patiënten met FL kwam overeen met dat van de gehele iNHL-populatie in beide onderzoeken.
Beschrijving van geselecteerde bijwerkingen
De incidenties weergegeven in de volgende rubrieken die refereren naar iNHL betreft de hoogste incidentie voor die bijwerking gemeld in een van de hoofdonderzoeken (BO21223/GALLIUM, GAO4753g/GADOLIN).
Onderzoek MO40597 was opgezet om het veiligheidsprofiel van kortdurende infusies (ongeveer 90 minuten) te karakteriseren vanaf cyclus 2 bij patiënten met niet eerder behandeld FL (zie rubriek 5.1 Farmacodynamische eigenschappen).
Infusiegerelateerde reacties
De meest gemelde (≥5%) IRR-gerelateerde verschijnselen waren misselijkheid, braken, diarree, hoofdpijn, duizeligheid, vermoeidheid, rillingen, pyrexie, hypotensie, blozen, hypertensie, tachycardie, dyspneu en een ongemakkelijk gevoel op de borst. Respiratoire symptomen zoals bronchospasmen, larynx- en keelirritatie, piepende ademhaling, larynxoedeem en cardiale symptomen zoals atriumfibrilleren werden ook gemeld (zie rubriek 4.4).
Chronische lymfatische leukemie
De incidentie van IRR’s was hoger in de groep met Gazyvaro plus chloorambucil vergeleken met de groep met rituximab plus chloorambucil. De incidentie van IRR’s was 66% bij de infusie van de eerste 1.000 mg Gazyvaro (20% van de patiënten kreeg een IRR van graad 3–4). In totaal kreeg 7% van de patiënten een IRR die leidde tot stopzetting van de behandeling met Gazyvaro. De incidentie van IRR's bij de volgende infusies was 3% bij de tweede dosis van 1.000 mg en daarna 1%. Er werden geen IRR's van graad 3–5 waargenomen na de eerste infusies van 1.000 mg in cyclus 1.
Er werd een verlaagde incidentie van IRR’s van alle graden waargenomen bij patiënten die de aanbevolen maatregelen ter preventie van IRR's kregen zoals beschreven in rubriek 4.2. De incidentie van IRR’s van graad 3-4 (die bij relatief weinig patiënten optraden) was vergelijkbaar voor en na het toepassen van risicoverlagende maatregelen.
Indolent non-hodgkinlymfoom waaronder folliculair lymfoom
IRR’s van graad 3‑4 traden op bij 12% van de patiënten. In cyclus 1 was de totale incidentie van IRR’s hoger bij patiënten behandeld met Gazyvaro plus chemotherapie in vergelijking met patiënten in de vergelijkingsarm. Bij patiënten die Gazyvaro plus chemotherapie ontvingen, was de incidentie van IRR’s het hoogste op dag 1 en nam geleidelijk af bij de daaropvolgende infusies. Deze afname van incidentie continueerde tijdens de onderhoudsbehandeling met alleen Gazyvaro. Na cyclus 1 was de incidentie van IRR’s bij de daaropvolgende infusies vergelijkbaar tussen de arm met Gazyvaro en relevante vergelijkingsarm. In totaal kreeg 4% van de patiënten een infusiegerelateerde reactie die leidde tot stopzetting van de behandeling met Gazyvaro.
Kortdurende infusie bij patiënten met folliculair lymfoom
In onderzoek MO40597 waarin de veiligheid van SDI werd beoordeeld, kreeg een hoger percentage patiënten IRR’s van alle graden in cyclus 2 in vergelijking met het percentage dat IRR’s kreeg na standaard infusie in cyclus 2 in onderzoek BO21223 (respectievelijk 10/99 [10,1%] vs. 23/529 [4,3%]; IRR’s die door de onderzoeker werden toegeschreven aan een van de onderdelen van de onderzoeksbehandeling). Geen van de patiënten kreeg IRR’s van graad ≥ 3 na SDI in cyclus 2 in MO40597; 3/529 (0,6%) kregen IRR’s van graad ≥ 3 in cyclus 2 in onderzoek BO21223. Klachten en symptomen van IRR waren in beide onderzoeken vergelijkbaar.
Infusiegerelateerde reacties die werden waargenomen in onderzoek MO40597/GAZELLE, zijn weergegeven in tabel 10.
Tabel 10 Onderzoek MO40597/GAZELLE kortdurende infusie: infusiegerelateerde reactiesa per cyclus (voor veiligheid beoordeelbare populatie)
CTCAE-graad | C1 totaal | C1b per dag | C2c | C3 | C4 | C5 | C6 | C7 | Tijdens alle | |||
Dag 1 | Dag 2d | Dag 8 | Dag 15 | |||||||||
Alle graden | 65/113 (57,5%) | 57/113 (50,4%) | 4/51 (7,8%) | 6/112 (5,4%) | 5/111 (4,5%) | 13/110 (11,8%) | 9/108 (8,3%) | 7/108 (6,5%) | 6/107 (5,6%) | 5/105 (4,8%) | 2/55 (3,6%) | 71/113 |
Graad ≥ 3 | 6/113 (5,3%) | 5/113 (4,4%) | 1/51 (2,0%) | 0 | 0 | 0 | 0 | 0 | 1/107 (0,9%) | 0 | 0 | 7/113 |
Ccyclus; CTCAE=Common Terminology Criteria for Adverse Events; IRRinfusiegerelateerde reactie
a Infusiegerelateerde reactie wordt gedefinieerd als een voorvallen dat optrad tijdens of binnen 24 uur na het eind van de infusie van onderzoeksbehandeling, waarvan de onderzoeker oordeelde dat die verband hield met een onderdeel van de behandeling.
b C1 bestond uit drie infusies met de standaard infusiesnelheid, toegediend in wekelijkse intervallen
c Patiënten kregen vanaf C2 een kortdurende infusie. De noemer in C2 en volgende cycli is het aantal patiënten dat in die cyclus SDI kreeg.
d Patiënten behandeld met bendamustine op dag 2 van cyclus 1.
Neutropenie en infecties
Chronische lymfatische leukemie
De incidentie van neutropenie was hoger in de groep met Gazyvaro plus chloorambucil (41%) in vergelijking met de groep rituximab plus chloorambucil, waarbij de neutropenie spontaan verdween of met gebruik van granulocyt-kolonie-stimulerende factoren. De incidentie van infectie was 38% in de groep met Gazyvaro plus chloorambucil en 37% in de groep met rituximab plus chloorambucil (waarbij voorvallen van graad 3–5 werden gemeld bij respectievelijk 12% en 14%, en fatale voorvallen werden gemeld bij < 1% in beide behandelarmen). Ook werden gevallen van langdurige neutropenie (2% in de groep met Gazyvaro plus chloorambucil en 4% in de groep met rituximab plus chloorambucil) en late neutropenie (16% in de groep met Gazyvaro plus chloorambucil en 12% in de groep met rituximab plus chloorambucil) gemeld (zie rubriek 4.4).
Indolent non-hodgkinlymfoom waaronder folliculair lymfoom
In de behandelarm met Gazyvaro plus chemotherapie was de incidentie van neutropenie van graad 1‑4 (50%) hoger dan in de vergelijkingsarm, met een verhoogd risico tijdens de inductieperiode. De incidentie van langdurige neutropenie en late neutropenie was respectievelijk 3% en 8%. De incidentie van infectie was 81% in de arm met Gazyvaro plus chemotherapie (met voorvallen van graad 3-5 gemeld bij 22% van de patiënten en fatale voorvallen gemeld bij 3% van de patiënten). Patiënten die G-CSF-profylaxe ontvingen hadden een lagere mate van infecties van graad 3‑5 (zie rubriek 4.4).
Kortdurende infusie bij patiënten met folliculair lymfoom
In onderzoek MO40597 waarin de veiligheid van SDI werd beoordeeld, werd neutropenie gemeld als bijwerking bij een hoger percentage patiënten in vergelijking met onderzoek BO21223 waarin patiënten de infusie met de standaard snelheid kregen (respectievelijk 69/113 [61,1%] vs. 247/595 [41,5%] tijdens de hele inductie). De mediaan en de spreiding van de waarden voor het aantal neutrofielen waren op elk tijdstip in beide onderzoeken vergelijkbaar. Febriele neutropenie werd gemeld bij een vergelijkbaar percentage patiënten in MO40597 en BO21223 (respectievelijk 6/113 [5,3%] vs. 31/595 [5,2%]). Infectie werd minder vaak gemeld in MO40597 dan in BO21223 (respectievelijk 45/113 [39,8%] vs. 284/595 [47,7%]).
Trombocytopenie en bloedingen
Chronische lymfatische leukemie
De incidentie van trombocytopenie was hoger in de arm met Gazyvaro plus chloorambucil in vergelijking met de arm met rituximab plus chloorambucil (16% versus 7%), vooral tijdens de eerste cyclus. Vier procent van de patiënten behandeld met Gazyvaro plus chloorambucil kreeg acute trombocytopenie (optredend binnen 24 uur na de infusie met Gazyvaro) (zie rubriek 4.4). De totale incidentie van bloedingen in de groep behandeld met Gazyvaro was vergelijkbaar met die in de groep behandeld met rituximab. Het aantal fatale bloedingen was evenwichtig verdeeld tussen de behandelingsarmen; alle voorvallen bij met Gazyvaro behandelde patiënten werden echter gemeld in cyclus 1. Er werden geen voorvallen van graad 5 trombocytopenie gemeld. Er werd geen duidelijke relatie tussen trombocytopenie en bloedingen vastgesteld.
Indolent non-hodgkinlymfoom waaronder folliculair lymfoom
De incidentie van trombocytopenie was 15%. Trombocytopenie trad vaker op in cyclus 1 in de behandelarm met Gazyvaro plus chemotherapie. Trombocytopenie dat optrad gedurende of tot 24 uur na het einde van de infusie (acute trombocytopenie) werd vaker waargenomen bij patiënten in de behandelarm met Gazyvaro plus chemotherapie dan in de vergelijkingsarm. De incidentie van bloedingen was vergelijkbaar tussen alle behandelarmen. Bloedingen en bloedingen van graad 3‑5 traden op bij respectievelijk 12% en 4% van de patiënten. Terwijl fatale bloedingen bij minder dan 1% van de patiënten optraden, kwamen er geen fatale IRR’s voor tijdens cyclus 1.
Kortdurende infusie bij patiënten met folliculair lymfoom
In onderzoek MO40597 waarin de veiligheid van SDI werd beoordeeld, werd trombocytopenie gemeld als bijwerking bij een hoger percentage patiënten in vergelijking met onderzoek BO21223 waarin patiënten de infusie met de standaard snelheid kregen (respectievelijk 21/113 [28,6%] vs. 63/595 [10,6%] tijdens de hele inductie). De mediaan en de spreiding van de waarden voor het aantal bloedplaatjes waren op elk tijdstip in beide onderzoeken vergelijkbaar. Geen van de voorvallen van trombocytopenie werden zijn gemeld in MO40597, ging gepaard met bloedingen.
Lupus nefritis
Samenvatting van het veiligheidsprofiel
In de samengevoegde gegevens van placebogecontroleerde onderzoeken met 200 met Gazyvaro behandelde patiënten met lupus nefritis waren de meest voorkomende bijwerkingen bovensteluchtweginfectie (29%), COVID-19 (22,5%) en urineweginfectie (21%).
Lijst van bijwerkingen in tabelvorm
De hieronder vermelde bijwerkingen zijn gebaseerd op samengevoegde veiligheidsgegevens uit twee klinische onderzoeken bij patiënten met klasse III- of IV-lupus nefritis volgens ISN/RPS 2003, met of zonder gelijktijdige klasse V-lupus nefritis, tot week 76:
- REGENCY (CA41705): een fase III-onderzoek met 136 patiënten die werden behandeld met Gazyvaro plus standaardbehandeling bestaande uit mycofenolaatmofetil (MMF) en corticosteroïden.
- NOBILITY (WA29748): een fase II-onderzoek met 64 patiënten die werden behandeld met Gazyvaro plus standaardbehandeling met MMF/mycofenolzuur en corticosteroïden.
Frequenties zijn gedefinieerd als: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); zelden (≥ 1/10.000, < 1/1.000); zeer zelden (< 1/10.000); niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen elke frequentiegroep zijn de bijwerkingen gepresenteerd in volgorde van afnemende ernst.
Tabel 11 Bijwerkingen die zijn gemeld bij patiënten die Gazyvaro + standaardbehandeling* kregen bij LN
Systeem/orgaanklasse | Alle graden | Graad 3-5 |
Infecties en parasitaire aandoeningen | ||
Zeer vaak | Bovensteluchtweginfectie, COVID-19, urineweginfectie, bronchitis, |
|
Vaak | Pneumonie, herpes simplex | COVID-19, urineweginfectie, pneumonie |
Letsels, intoxicaties en verrichtingscomplicaties | ||
Zeer vaak | IRR |
|
Vaak |
| IRR |
Bloed- en lymfestelselaandoeningen | ||
Zeer vaak | Neutropenie |
|
Vaak |
| Neutropenie |
Onderzoeken | ||
Zeer vaak | Verlaagd immunoglobuline M in het bloed** |
|
*mycofenolaatmofetil (MMF) en corticosteroïden
**Frequentiecategorie is afgeleid van de laboratoriumwaarden die zijn verzameld als onderdeel van de routinematige laboratoriumcontroles in klinische onderzoeken.
Beschrijving van geselecteerde bijwerkingen
Infecties
Infecties werden gemeld bij 72,0% van de patiënten in de arm met Gazyvaro versus 61,7% van de patiënten in de arm met placebo. De meest gemelde infecties waren bovenste- en ondersteluchtweginfecties. Infecties van graad 3-5 werden gemeld bij 11,5% van de patiënten in de arm met Gazyvaro versus 9,8% van de patiënten in de arm met placebo. Fatale infecties werden gemeld bij 1% van de patiënten in de arm met Gazyvaro versus 0,5 % van de patiënten in de arm met placebo (zie rubriek 4.4).
Neutropenie
Neutropenie en gerelateerde bijwerkingen werden gemeld bij 14,0% van de patiënten in de arm met Gazyvaro versus 6,2% van de patiënten in de arm met placebo. Neutropenie van graad 3-4 werd gemeld bij 7% van de met Gazyvaro behandelde patiënten versus 0,5% van de patiënten in de arm met placebo. Het merendeel van neutropenie en gerelateerde voorvallen verdween/verbeterde spontaan of bij gebruik van granulocyt-kolonie-stimulerende factoren (zie rubriek 4.4).
Infusiegerelateerde reacties
IRR’s werden gemeld bij 13,5% van de patiënten in de arm met Gazyvaro versus 10,4% van de patiënten in de arm met placebo. IRR’s in beide armen waren hoofdzakelijk van graad 1-2 en traden op tijdens/na de eerste infusie. IRR’s van graad 3-4 werden gemeld bij 1,5% van de patiënten in de arm met Gazyvaro versus 0,5% van de patiënten in de arm met placebo. Alle voorvallen van graad 3-4 traden op tijdens/na de eerste of tweede infusie. De incidentie en ernst van IRR’s daalden bij volgende infusies (zie rubriek 4.4).
In het REGENCY-onderzoek waren de meest voorkomende tekenen en symptomen van IRR hoofdpijn, misselijkheid en braken. In het NOBILITY-onderzoek waren de meest voorkomende IRR-symptomen pyrexie en tachycardie.
Speciale populaties
Ouderen
Chronische lymfatische leukemie
In het hoofdonderzoek BO21004/CLL11 was 46% (156 van de 336) van de patiënten met CLL die met Gazyvaro plus chloorambucil werden behandeld 75 jaar of ouder (met een mediane leeftijd van 74 jaar). Deze patiënten kregen meer ernstige bijwerkingen en bijwerkingen die tot de dood leidden dan de patiënten < 75 jaar.
Indolent non-hodgkinlymfoom waaronder folliculair lymfoom
In de hoofdonderzoeken (BO21223/GALLIUM, GAO4753g/GADOLIN) bij iNHL kregen patiënten van 65 jaar of ouder meer ernstige bijwerkingen en bijwerkingen die tot het beëindigen van de behandeling of dood leidden dan patiënten <65 jaar.
Verminderde nierfunctie
Chronische lymfatische leukemie
In het hoofdonderzoek BO21004/CLL11 had 27% (90 van de 336) van de patiënten die werden behandeld met Gazyvaro plus chloorambucil een matig-ernstig verminderde nierfunctie (CrCl < 50 ml/min). Deze patiënten kregen meer ernstige bijwerkingen en bijwerkingen die tot de dood leidden dan patiënten met een CrCl ≥ 50 ml/min (zie rubriek 4.2, 4.4 en 5.2). Patiënten met een CrCl < 30 ml/min werden uitgesloten van het onderzoek (zie rubriek 5.1).
Indolent non-hodgkinlymfoom waaronder folliculair lymfoom
In de hoofdonderzoeken (BO21223/GALLIUM, GAO4753g/GADOLIN) bij iNHL had respectievelijk 5% (35 van de 698) en 7% (14 van de 204) van de patiënten die met Gazyvaro behandeld werden een matig-ernstig verminderde nierfunctie (CrCl < 50 ml/min). Deze patiënten kregen meer ernstige bijwerkingen, bijwerkingen van graad 3 tot 5 en bijwerkingen die leidden tot het beëindigen van de behandeling (alleen bij patiënten in BO21223) dan patiënten met een CrCl ≥ 50 ml/min (zie rubriek 4.2 en 5.2). Patiënten met een CrCl < 40 ml/min werden uitgesloten van de onderzoeken (zie rubriek 5.1).
Lupus nefritis
De farmacokinetische populatieanalyse (n = 196) van Gazyvaro toonde aan dat de creatinineklaring geen invloed had op de farmacokinetiek van obinutuzumab bij patiënten met LN. De farmacokinetiek van obinutuzumab bij patiënten met lichte (CrCl 60 - < 90 ml/min, n = 45) of matige (CrCl 30 - < 60 ml/min, n = 17) nierinsufficiëntie was vergelijkbaar met die bij patiënten met een normale nierfunctie. De veiligheid en werkzaamheid van Gazyvaro bij patiënten met een ernstig verminderde nierfunctie werden niet formeel onderzocht.
Aanvullende veiligheidsinformatie uit klinisch onderzoek
Verslechtering van bestaande hartaandoeningen
Er zijn gevallen gemeld van aritmieën (zoals atriumfibrilleren en tachyaritmie), angina pectoris, acuut coronair syndroom, myocardinfarct en hartfalen bij patiënten met CLL en NHL die met Gazyvaro werden behandeld (zie rubriek 4.4). Deze voorvallen kunnen optreden als deel van een IRR en kunnen fataal zijn.
Afwijkende laboratoriumwaarden
Tijdelijke verhoging van leverenzymen (aspartaataminotransferase (ASAT), alanineaminotransferase (ALAT), alkalische fosfatase) werd waargenomen bij patiënten met CLL kort na de eerste infusie met Gazyvaro.
Uit samengevoegde LN-gegevens van placebogecontroleerde onderzoeken bleek behandeling met obinutuzumab te resulteren in een afname van de totale immunoglobulines, voornamelijk veroorzaakt door een afname van IgM.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico's van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden (zie hieronder voor details).
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/14/937/001
10. DATUM VAN HERZIENING VAN DE TEKST
4 december 2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3167483 | GAZYVARO 1000 MG SOL PR PERF 1 FL 1000MG/40ML | L01FA03 | - | € 2702,07 | Ja | - | - |