SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Relvar Ellipta 92 microgram /22 microgram inhalatiepoeder, voorverdeeld.
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Iedere enkelvoudige inhalatie biedt een afgegeven dosis (de dosis die het mondstuk verlaat) van 92 microgram fluticasonfuroaat en 22 microgram vilanterol (als trifenataat). Dit komt overeen met een voorverdeelde dosis van 100 microgram fluticasonfuroaat en 25 microgram vilanterol (als trifenataat).
Hulpstof met bekend effect
Elke afgegeven dosis bevat ongeveer 25 mg lactosemonohydraat.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Inhalatiepoeder, voorverdeeld
Wit poeder in een lichtgrijze inhalator (Ellipta) met een gele beschermkap van het mondstuk en een dosisteller.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Astma
Relvar Ellipta is geïndiceerd voor de reguliere behandeling van astma bij volwassenen en adolescenten van 12 jaar en ouder voor wie het gebruik van een gecombineerd geneesmiddel (langwerkende bèta2-agonist en inhalatiecorticosteroïde) geschikt is:
- patiënten bij wie de astma onvoldoende onder controle is met inhalatiecorticosteroïden en geïnhaleerde kortwerkende bèta2-agonisten 'naar behoefte'
- patiënten bij wie de astma reeds voldoende onder controle is met zowel een inhalatiecorticosteroïde als een geïnhaleerde langwerkende bèta2-agonist
COPD (chronische obstructieve longziekte)
Relvar Ellipta is geïndiceerd voor de symptomatische behandeling van volwassenen met COPD met een FEV1<70% van de voorspelde normale waarde (na bronchusverwijder) met een geschiedenis van exacerbaties ondanks regelmatige bronchusverwijdende behandeling.
4.2 Dosering en wijze van toediening
Dosering
Astma
Patiënten met astma moeten de sterkte van Relvar Ellipta voorgeschreven krijgen waarin de dosis fluticasonfuroaat (FF) passend is bij de ernst van hun aandoening. Artsen moeten zich ervan bewust zijn dat bij patiënten met astma, fluticasonfuroaat (FF) 100 microgram eenmaal daags ongeveer vergelijkbaar is met fluticasonpropionaat (FP) 250 microgram tweemaal daags, terwijl FF 200 microgram eenmaal daags ongeveer vergelijkbaar is met FP 500 microgram tweemaal daags.
Volwassenen en adolescenten van 12 jaar en ouder
Een startdosering van één inhalatie Relvar Ellipta 92/22 microgram eenmaal daags dient te worden overwogen voor volwassenen en adolescenten van 12 jaar en ouder die een lage tot gemiddelde dosis geïnhaleerde corticosteroïden nodig hebben in combinatie met een langwerkende bèta2-agonist. Als bij patiënten niet voldoende controle wordt bereikt met Relvar Ellipta 92/22 microgram, kan de dosis worden verhoogd tot 184/22 microgram, wat een extra verbetering van de astmacontrole kan bieden.
Patiënten dienen regelmatig opnieuw te worden beoordeeld door een beroepsbeoefenaar in de gezondheidszorg, zodat de sterkte van fluticasonfuroaat/vilanterol die zij krijgen optimaal blijft; deze mag alleen worden gewijzigd op medisch advies. De dosis moet worden getitreerd naar de laagste dosis waarbij een effectieve controle van de symptomen wordt behouden.
Relvar Ellipta 184/22 microgram dient te worden overwogen voor volwassenen en adolescenten van 12 jaar en ouder die een hogere dosis geïnhaleerde corticosteroïden nodig hebben in combinatie met een langwerkende bèta2-agonist.
Patiënten ervaren doorgaans een verbetering van de longfunctie binnen 15 minuten na het inhaleren van Relvar Ellipta. De patiënt dient echter verteld te worden dat een regelmatig dagelijks gebruik noodzakelijk is om de astmasymptomen onder controle te houden en dat het gebruik moet worden voortgezet zelfs wanneer hij/zij geen symptomen heeft.
Als symptomen optreden in de periode tussen doseringen dient een geïnhaleerde, kortwerkende bèta2-agonist te worden genomen voor directe verlichting.
Kinderen jonger dan 12 jaar
De veiligheid en werkzaamheid van Relvar Ellipta bij kinderen jonger dan 12 jaar zijn niet vastgesteld voor de indicatie astma.
Relvar Ellipta mag niet bij kinderen jonger dan 12 jaar worden gebruikt. Momenteel beschikbare gegevens worden beschreven in rubrieken 5.1 en 5.2.
COPD
Volwassenen van 18 jaar en ouder
Eén inhalatie van Relvar Ellipta 92/22 microgram eenmaal daags.
Relvar Ellipta 184/22 microgram is niet geïndiceerd voor patiënten met COPD. Er is geen extra voordeel van de dosis van 184/22 microgram in vergelijking met de dosis van 92/22 microgram en er bestaat een mogelijk verhoogd risico op pneumonie en systemische corticosteroïdegerelateerde bijwerkingen (zie rubrieken 4.4 en 4.8).
Patiënten ervaren doorgaans een verbetering van de longfunctie binnen 16-17 minuten na het inhaleren van Relvar Ellipta.
Pediatrische patiënten
Er is geen relevante toepassing van Relvar Ellipta bij pediatrische patiënten (tot 18 jaar) voor de indicatie COPD.
Speciale populaties
Ouderen
Er is geen dosisaanpassing nodig bij patiënten van 65 jaar of ouder (zie rubriek 5.2).
Nierfunctiestoornis
Er is geen dosisaanpassing nodig voor deze populatie (zie rubriek 5.2).
Leverfunctiestoornis
Onderzoeken bij proefpersonen met een lichte, matige of ernstige leverfunctiestoornis toonden een verhoging van de systemische blootstelling aan fluticasonfuroaat (zowel Cmax als AUC) (zie rubriek 5.2).
Voorzichtigheid is geboden bij toediening aan patiënten met een leverfunctiestoornis die een groter risico lopen op systemische bijwerkingen die verband houden met corticosteroïden.
Voor patiënten met een matige of ernstige leverfunctiestoornis is de maximale dosis 92/22 microgram (zie rubriek 4.4).
Wijze van toediening
Relvar Ellipta is uitsluitend bestemd voor orale inhalatie.
Het moet iedere dag op hetzelfde tijdstip worden toegediend.
De uiteindelijke beslissing over toediening 's avonds of 's ochtends moet worden overgelaten aan de arts.
Na de inhalatie moeten de patiënten hun mond spoelen met water zonder dit door te slikken.
Indien een dosis wordt gemist, moet de volgende dosis de volgende dag op de gebruikelijke tijd worden genomen.
Als de inhalator in de koelkast wordt bewaard, dan moet de inhalator gedurende ten minste één uur voor toediening op kamertemperatuur kunnen komen.
Wanneer de inhalator voor het eerst wordt gebruikt, hoeft niet gecontroleerd te worden of die goed werkt. De inhalator hoeft ook niet op een speciale wijze geprepareerd te worden voor gebruik. De stapsgewijze instructies moeten gevolgd worden.
De Ellipta-inhalator is verpakt in een bakje samen met een zakje met droogmiddel om vochtigheid tegen te gaan. Het zakje droogmiddel moet weggegooid worden en mag niet worden geopend, opgegeten of geïnhaleerd.
De patiënt moet worden geïnstrueerd het bakje niet te openen totdat hij klaar is om een dosis te inhaleren.
Als de inhalator uit het bakje wordt gehaald, staat die in de ‘gesloten’ positie. De ‘Weggooien op’ datum moet op het etiket van de inhalator genoteerd worden in de daarvoor bestemde ruimte. De ‘Weggooien op’ datum is 6 weken na de datum waarop het bakje geopend werd. Vanaf deze datum mag de inhalator niet meer gebruikt worden. Het bakje mag na openen worden weggegooid.
De hieronder weergegeven stapsgewijze instructies voor de Ellipta-inhalator met 30 doses (voorraad voor 30 dagen) gelden ook voor de Ellipta-inhalator met 14 doses (voorraad voor 14 dagen).
Instructies voor gebruik
- Lees dit voordat u begint
Als de beschermkap van de inhalator wordt geopend en gesloten zonder het geneesmiddel te inhaleren, zal de dosis verloren gaan. De verloren dosis wordt veilig vastgehouden in de inhalator, maar is niet meer beschikbaar om te inhaleren.
Het is niet mogelijk om tijdens één inhalatie per ongeluk extra geneesmiddel of een dubbele dosis te nemen.
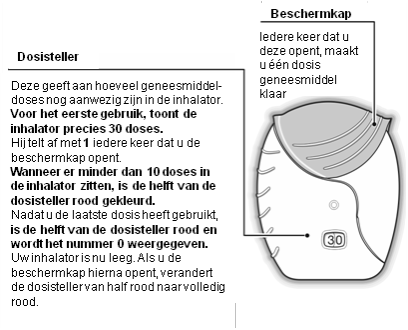
- Een dosis klaarmaken
Open de beschermkap wanneer u gereed bent om een dosis te inhaleren. De inhalator mag niet worden geschud.
Schuif de beschermkap naar beneden totdat een 'klik' te horen is. Het geneesmiddel kan nu worden geïnhaleerd.
De dosisteller telt met 1 af om dit te bevestigen. Als de dosisteller niet aftelt wanneer de 'klik' te horen is, zal de inhalator geen dosis afgeven en moet de inhalator teruggebracht worden naar een apotheker voor advies.
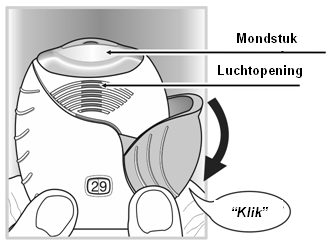
- Hoe wordt het geneesmiddel geïnhaleerd?
De inhalator moet bij de mond vandaan gehouden worden terwijl zo diep mogelijk uitgeademd wordt, maar zonder uit te ademen in de inhalator.
Het mondstuk moet tussen de lippen geplaatst worden en daarna moeten de lippen er stevig omheen gesloten worden. De luchtopening mag niet met de vingers worden geblokkeerd tijdens gebruik.
- Adem eenmaal lang, gelijkmatig en diep in. De adem moet vervolgens zo lang mogelijk ingehouden worden (ten minste 3-4 seconden).
- Haal de inhalator uit de mond.
- Adem langzaam en rustig uit.
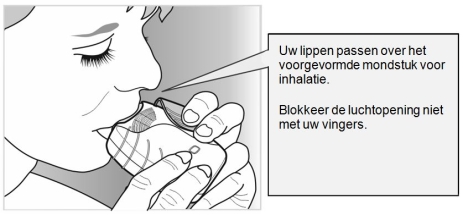
Het kan zijn dat het geneesmiddel niet geproeft of gevoeld wordt, zelfs niet als de inhalator op de juiste manier gebruikt wordt.
Het mondstuk van de inhalator kan met een droog doekje worden schoongemaakt voordat de beschermkap wordt gesloten.
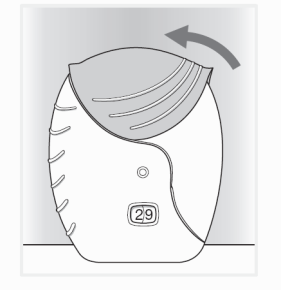
- Sluit de inhalator en spoel uw mond
Schuif de beschermkap zo ver mogelijk omhoog om het mondstuk te bedekken.
Spoel uw mond met water nadat u de inhalator heeft gebruikt en slik het niet in.
Hierdoor wordt het minder waarschijnlijk dat u een pijnlijke mond of keel als bijwerking krijgt.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof(fen) of voor een van de in rubriek 6.1 vermelde hulpstof(fen).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Er werden gegevens uit grootschalige klinische onderzoeken naar astma en COPD gebruikt om de frequentie te bepalen van bijwerkingen die in verband zijn gebracht met fluticasonfuroaat/vilanterol. In het klinische ontwikkelingsprogramma voor astma werden in totaal 7.034 patiënten opgenomen in een geïntegreerde beoordeling van bijwerkingen. In het klinische ontwikkelingsprogramma voor COPD werden in totaal 6.237 proefpersonen opgenomen in een geïntegreerde beoordeling van bijwerkingen.
De meest gemelde bijwerkingen bij gebruik van fluticasonfuroaat en vilanterol waren hoofdpijn en nasofaryngitis. Met uitzondering van pneumonie en botbreuken was het veiligheidsprofiel vergelijkbaar bij patiënten met astma en patiënten met COPD. Tijdens klinische onderzoeken werden pneumonie en botbreuken vaker gezien bij patiënten met COPD.
Samenvattende tabel van bijwerkingen
Bijwerkingen worden per systeem/orgaanklasse en mate van voorkomen (frequentie) opgesomd. De volgende conventie is gebruikt voor de classificatie van frequentiecategorieën: zeer vaak (≥1/10), vaak (≥1/100, <1/10), soms (≥1/1.000, <1/100), zelden (≥1/10.000, <1/1.000) en zeer zelden (<1/10.000).
Binnen elke frequentiegroep worden de bijwerkingen naar afnemende ernst gerangschikt.
Systeem/orgaanklasse | Bijwerking(en) | Frequentie |
Infecties en parasitaire aandoeningen | Pneumonie* | Vaak |
Immuunsysteemaandoeningen | Overgevoeligheidreacties waaronder anafylaxie, angio-oedeem, rash en urticaria | Zelden |
Voedings- en stofwisselingsstoornissen | Hyperglykemie | Soms |
Psychische stoornissen | Angst | Zelden |
Zenuwstelselaandoeningen | Hoofdpijn | Zeer vaak |
Oogaandoeningen | Wazig zien (zie rubriek 4.4) | Soms |
Hartaandoeningen | Extrasystolen | Soms |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Nasofaryngitis | Zeer vaak |
Maagdarmstelselaandoeningen | Abdominale pijn | Vaak |
Skeletspierstelsel- en bindweefselaandoeningen | Artralgie | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | Pyrexie | Vaak |
*,** Zie onder “Beschrijving van geselecteerde bijwerkingen”
Beschrijving van geselecteerde bijwerkingen
*Pneumonie (zie rubriek 4.4)
In een geïntegreerde analyse van de twee één jaar durende replicatieonderzoeken bij matige tot ernstige COPD (gemiddelde voorspelde post-bronchodilatatoire screening FEV1 van 45%, standaarddeviate (SD) 13%) met een exacerbatie in het voorgaande jaar (n = 3.255), was het aantal pneumoniemeldingen per 1.000 patiëntenjaren 97,9 in de groep met FF/VI 184/22 microgram, 85,7 in de groep met FF/VI 92/22 microgram en 42,3 in de groep met VI 22 microgram. Voor ernstige pneumonie bedroeg het overeenkomende aantal gebeurtenissen per 1.000 patiëntenjaren respectievelijk 33,6, 35,5 en 7,6. Voor matig-ernstige pneumonie bedroeg het overeenkomende aantal gebeurtenissen per 1.000 patiëntenjaren respectievelijk 35,1 voor FF/VI 184/22 microgram, 42,9 voor FF/VI 92/22 microgram en 12,1 voor VI 22 microgram. Tot slot bedroeg het aantal fatale pneumonieën, gecorrigeerd voor blootstelling, respectievelijk 8,8 voor FF/VI 184/22 microgram versus 1,5 voor FF/VI 92/22 microgram en 0 voor VI 22 microgram.
In een placebogecontroleerd onderzoek (SUMMIT) bij personen met matige COPD (gemiddelde percentage post-bronchodilatatoire screening FEV1 van 60%, SD 6%) met een voorgeschiedenis van, of een toegenomen risico op cardiovasculaire aandoeningen, was de incidentie van pneumonie met FF/VI, FF, VI en placebo respectievelijk: bijwerkingen (6%, 5%, 4%, 5%); ernstige bijwerkingen (3%, 4%, 3%, 3%); beoordeeld op overlijdens door pneumonie ten gevolge van de behandeling (0,3%; 0,2%; 0,1%; 0,2%); de percentages gecorrigeerd naar blootstelling (per 1.000 behandeljaren) bedroegen respectievelijk: bijwerkingen (39,5; 42,4; 27,7; 38,4); ernstige bijwerkingen (22,4; 25,1; 16,4; 22,2); beoordeeld op overlijdens door pneumonie ten gevolge van de behandeling (1,8; 1,5; 0,9; 1,4).
In een geïntegreerde analyse van 11 onderzoeken naar astma (7.034 patiënten) was de incidentie van pneumonie per 1.000 patiëntenjaren 18,4 voor FF/VI 184/22 microgram versus 9,6 voor FF/VI 92/22 microgram en 8,0 in de placebogroep.
**Botbreuken
In twee replicatieonderzoeken van 12 maanden met in totaal 3.255 patiënten met COPD was de algehele incidentie van botbreuken laag in alle behandelgroepen, met een hogere incidentie in alle groepen met Relvar Ellipta (2%) in vergelijking met de groep met vilanterol 22 microgram (<1%). Hoewel er meer botbreuken waren in de groepen met Relvar Ellipta dan in de groep met vilanterol 22 microgram, traden botbreuken waarmee het gebruik van corticosteroïden normaal gesproken gepaard gaat (bijv. ruggenmergcompressie-/thoracolumbale tussenwervelbreuken, heup- en heupkombreuken) op in <1% van de behandelarmen op Relvar Ellipta en vilanterol.
Voor het SUMMIT onderzoek was de incidentie van alle gevallen van breuken met FF/VI, FF, VI en placebo 2% in elke behandelarm; voor breuken die vaak worden geassocieerd met ICS-gebruik was dit minder dan 1% in elke behandelarm. De voor blootstelling gecorrigeerde getallen (per 1.000 behandeljaren) voor alle gevallen van breuken bedroegen respectievelijk 13,6; 12,8; 13,2 en 11,5; voor breuken die vaak worden geassocieerd met ICS-gebruik was dit respectievelijk 3,4; 3,9; 2,4; 2,1.
In een geïntegreerde analyse van 11 onderzoeken naar astma (7.034 patiënten), was de incidentie van botbreuken <1% en hielden de botbreuken meestal verband met trauma.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
4.9 Overdosering
Klachten en symptomen
Een overdosis fluticasonfuroaat/vilanterol kan klachten en symptomen veroorzaken die zijn toe te schrijven aan de werking van de afzonderlijke bestanddelen, waaronder klachten en symptomen die gezien worden bij overdosering van andere bèta2-agonisten en die consistent zijn met bekende effecten van de klasse van geïnhaleerde corticosteroïden (zie rubriek 4.4).
Behandeling
Er bestaat geen specifieke behandeling voor een overdosering van fluticasonfuroaat/vilanterol. Als overdosering plaatsvindt, moet de patiënt ondersteunend behandeld worden, met de juiste controle, indien nodig.
Een cardioselectieve bètablokkade moet alleen overwogen worden voor ernstige overdosiseffecten van vilanterol die klinisch zorgwekkend zijn en niet reageren op ondersteunende maatregelen. Cardioselectieve bètablokkerende geneesmiddelen dienen met voorzichtigheid te worden gebruikt bij patiënten met een geschiedenis van bronchospasme.
De verdere behandeling dient plaats te vinden zoals klinisch aangewezen of zoals aangeraden door het Nationaal Vergiftigingen Informatie Centrum, indien van toepassing.
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
GlaxoSmithKline Trading Services Limited
12 Riverwalk
Citywest Business Campus
Dublin 24
Ierland
D24 YK11
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/13/886/001
EU/1/13/886/002
EU/1/13/886/003
10. DATUM VAN HERZIENING VAN DE TEKST
12 maart 2025 (versie 19)
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3090214 | RELVAR ELLIPTA 92/22MCG PDR INHAL MULTIDOSE 1X30 | R03AK10 | € 51,09 | - | Ja | € 12,67 | € 7,53 |
| 3343738 | RELVAR ELLIPTA 92/22MCG PDR INHAL MULTIDOSE 3X30 | R03AK10 | € 110,08 | - | Ja | € 12,8 | € 8,5 |