SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Perjeta 420 mg concentraat voor oplossing voor infusie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Eén injectieflacon van 14 ml concentraat bevat 420 mg pertuzumab in een concentratie van 30 mg/ml.
Na verdunning bevat één ml oplossing ongeveer 3,02 mg pertuzumab voor de initiële dosis en ongeveer 1,59 mg pertuzumab voor de onderhoudsdosis (zie rubriek 6.6.).
Pertuzumab is een gehumaniseerd monoklonaal IgG1-antilichaam dat geproduceerd wordt in zoogdiercellen (Chinese hamsterovariumcellen) door middel van recombinant-DNA-technologie.
Hulpstof met bekend effect
Elke injectieflacon van 14 ml bevat 2,8 mg polysorbaat 20
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Concentraat voor oplossing voor infusie.
Heldere tot enigszins opaalachtige, kleurloze tot lichtgele vloeistof.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Vroege borstkanker
Perjeta is geïndiceerd voor gebruik in combinatie met trastuzumab en chemotherapie voor:
de neoadjuvante behandeling van volwassen patiënten met HER2-positieve, lokaal gevorderde, inflammatoire, of vroeg-stadium borstkanker met een hoog risico op recidief (zie rubriek 5.1)
de adjuvante behandeling van volwassen patiënten met HER2-positieve vroege borstkanker met een hoog risico op recidief (zie rubriek 5.1).
Gemetastaseerde borstkanker
Perjeta is geïndiceerd voor gebruik in combinatie met trastuzumab en docetaxel bij volwassen patiënten met HER2-positieve gemetastaseerde of lokaal teruggekeerde, niet-reseceerbare borstkanker die geen eerdere anti-HER2-therapie of chemotherapie voor hun gemetastaseerde ziekte hebben gekregen.
4.2 Dosering en wijze van toediening
Perjeta dient uitsluitend te worden geïnitieerd onder toezicht van een arts die ervaring heeft met de toediening van middelen tegen kanker. Perjeta dient te worden toegediend door een medische zorgverlener die in staat is om anafylaxie te behandelen en in een omgeving die zodanig is uitgerust dat reanimatie onmiddellijk kan plaatsvinden.
Dosering
Patiënten die worden behandeld met Perjeta moeten een HER2- positieve tumor hebben, gedefinieerd als een im (IHC) -score van 3+ en/of een in-situhybridisatie (ISH) -ratio van ≥ 2,0, aangetoond met behulp van een gevalideerde test.
Om accurate en reproduceerbare resultaten te kunnen waarborgen, moeten de testen worden uitgevoerd in een gespecialiseerd laboratorium, dat gevalideerde testprocedures kan garanderen. Voor volledige instructies betreffende de uitvoering en interpretatie van de assay verwijzen wij naar de bijsluiters van de gevalideerde HER2-testassays.
De aanbevolen initiële oplaaddosis van pertuzumab is 840 mg toegediend als een 60 minuten durende intraveneuze infusie, om de 3 weken gevolgd door een onderhoudsdosis van 420 mg toegediend gedurende 30 tot 60 minuten. Na afloop van elke infusie wordt een observatieperiode van 30 - 60 minuten aanbevolen. De observatieperiode moet beëindigd zijn voorafgaand aan een daaropvolgende infusie met trastuzumab of chemotherapie (zie rubriek 4.4).
Perjeta en trastuzumab moeten na elkaar worden toegediend en mogen niet gemengd worden in dezelfde infuuszak. Perjeta en trastuzumab kunnen in willekeurige volgorde worden gegeven. Bij gebruik in combinatie met pertuzumab wordt het aanbevolen om een 3-wekelijks toedieningsschema voor trastuzumab te volgen met:
een intraveneuze infusie met een initiële oplaaddosis van trastuzumab van 8 mg/kg lichaamsgewicht, gevolgd door een onderhoudsdosis van 6 mg/kg lichaamsgewicht die elke 3 weken gegeven wordt
of
een vaste dosis trastuzumab via subcutane injectie (600 mg) om de 3 weken ongeacht het lichaamsgewicht van de patiënt.
Bij patiënten die worden behandeld met een taxaan moeten Perjeta en trastuzumab worden toegediend voorafgaand aan toediening van het taxaan.
Bij toediening in combinatie met Perjeta kan een aanvangsdosis van 75 mg/m2 docetaxel gebruikt worden. Afhankelijk van het gekozen behandelregime en de verdraagbaarheid van de aanvangsdosis, kan de dosis vervolgens verhoogd worden tot 100 mg/m2. Afhankelijk van het gekozen regime kan ook gekozen worden voor 100 mg/m2 docetaxel in een 3-wekelijks toedieningsschema vanaf de aanvang. Als een op carboplatine gebaseerd regime wordt gebruikt, is de aanbevolen docetaxel-dosering 75 mg/m2 gedurende de gehele behandeling (geen dosisverhoging). Bij toediening in combinatie met Perjeta in de adjuvante setting is de aanbevolen paclitaxel-dosering 80 mg/m2 eenmaal per week gedurende 12 wekelijkse cycli.
Bij patiënten die behandeld worden met een antracycline moeten Perjeta en trastuzumab toegediend worden na voltooiing van de antracycline-behandeling (zie rubriek 4.4).
Gemetastaseerdeborstkanker
Perjeta moet worden toegediend in combinatie met trastuzumab en docetaxel. De behandeling met Perjeta en chemotherapie mag tot aan ziekteprogressie of onbehandelbare toxiciteit doorgaan, ook als de behandeling met docetaxel wordt beëindigd.
Vroege borstkanker
In de neoadjuvante setting dient Perjeta gedurende 3 tot 6 cycli te worden toegediend in combinatie met trastuzumab en chemotherapie, als onderdeel van een compleet behandelregime voor vroege borstkanker (zie rubriek 5.1).
In de adjuvante setting dient Perjeta in combinatie met trastuzumab gedurende in totaal één jaar (maximaal 18 cycli of tot recidief of onbehandelbare toxiciteit, afhankelijk van wat zich het eerst voordoet) te worden toegediend als onderdeel van een compleet behandelregime voor vroege borstkanker, ongeacht het moment van chirurgie. De behandeling moet standaard antracycline- en/of taxaan-houdende chemotherapie bevatten. Perjeta en trastuzumab moeten worden gestart op de eerste dag van de eerste cyclus waarin het taxaan wordt gegeven en moeten ook worden gecontinueerd als de chemotherapie wordt beëindigd.
Uitgestelde of overgeslagen doses
Voor aanbevelingen over uitgestelde of overgeslagen doses, zie tabel 1 hieronder.
Tabel 1 Aanbevelingen met betrekking tot uitgestelde of overgeslagen doses
Tijd tussen twee opeenvolgende toedieningen | Perjeta | trastuzumab | |
| IV | SC | |
< 6 weken | De 420 mg dosis van pertuzumab moet zo spoedig mogelijk worden toegediend. Wacht niet tot de volgende geplande dosis. Daarna kan het oorspronkelijk geplande schema gevolgd worden. | De 6 mg/kg dosis van trastuzumab IV moet zo spoedig mogelijk worden toegediend. Wacht niet tot de volgende geplande dosis. Daarna kan het oorspronkelijk geplande schema gevolgd worden. | De vaste dosis van 600 mg trastuzumab SC moet zo spoedig mogelijk worden toegediend. Wacht niet tot de volgende geplande dosis. |
≥ 6 weken | De oplaaddosis van 840 mg pertuzumab moet opnieuw worden toegediend als een 60 minuten durende infusie, gevolgd door een onderhoudsdosis van 420 mg elke 3 weken daarna. | De oplaaddosis van 8 mg/kg trastuzumab IV moet opnieuw toegediend worden als een 90 minuten durende infusie, gevolgd door een onderhoudsdosis van 6 mg/kg elke 3 weken daarna. | |
Dosisaanpassing
Dosisverlagingen worden niet aanbevolen voor Perjeta of trastuzumab. Voor informatie over trastuzumab, zie de samenvatting van de productkenmerken (SmPC).
Patiënten mogen de behandeling continueren gedurende periodes van omkeerbare, chemotherapie-geïnduceerde myelosuppressie, maar moeten dan gedurende deze periode wel zorgvuldig gecontroleerd worden op complicaties als gevolg van neutropenie. Voor informatie over dosisaanpassing van docetaxel en andere chemotherapie, zie de desbetreffende SmPC.
Het gebruik van Perjeta moet worden beëindigd als de behandeling met trastuzumab wordt beëindigd.
Linkerventrikeldisfunctie
Het gebruik van Perjeta en trastuzumab moet voor ten minste 3 weken worden onderbroken bij klachten en symptomen die congestief hartfalen suggereren (behandeling met Perjeta moet worden beëindigd indien symptomatisch hartfalen is bevestigd; zie rubriek 4.4 voor meer informatie).
Patiënten met gemetastaseerde borstkanker
Patiënten moeten voorafgaand aan de behandeling een linkerventrikelejectiefractie (LVEF) hebben van ≥ 50%. Het gebruik van Perjeta en trastuzumab moet voor ten minste 3 weken worden onderbroken bij:
- een daling van de LVEF tot onder de 40%.
- een LVEF van 40-45% geassocieerd met een afname van ≥ 10 procentpunten ten opzichte van de waarde voorafgaand aan de behandeling.
Het gebruik van Perjeta en trastuzumab kan worden hervat zodra de LVEF zich heeft hersteld tot een waarde van > 45%, of tot een waarde van 40-45% bij een afname van < 10 procentpunten ten opzichte van de uitgangswaarden voorafgaand aan de behandeling.
Patiënten met vroege borstkanker
Patiënten moeten voorafgaand aan de behandeling een LVEF hebben van ≥ 55% (≥ 50% na afloop van de behandeling met de antracycline-component van de chemotherapie, indien van toepassing). Het gebruik van Perjeta en trastuzumab moet voor ten minste 3 weken worden onderbroken bij:
- een daling van de LVEF tot onder de 50% geassocieerd met een afname van ≥ 10 procentpunten ten opzichte van de uitgangswaarden voorafgaand aan de behandeling.
Het gebruik van Perjeta en trastuzumab kan worden hervat zodra de LVEF zich heeft hersteld tot een waarde van ≥ 50% of tot een afname < 10 procentpunten ten opzichte van de uitgangswaarden voorafgaand aan de behandeling.
Ouderen
Over het algemeen werd er geen verschil in de werkzaamheid van Perjeta waargenomen tussen patiënten van 65 jaar en ouder en patiënten jonger dan 65 jaar. Bij ouderen van 65 jaar en ouder hoeft de dosis niet te worden aangepast. Er zijn beperkte gegevens beschikbaar bij patiënten ouder dan 75 jaar. Zie rubriek 4.8 voor de beoordeling van de veiligheid van Perjeta bij ouderen.
Verminderde nierfunctie
Bij patiënten met een licht of matig verminderde nierfunctie is aanpassing van de dosis pertuzumab niet nodig. Aangezien er beperkte farmacokinetische gegevens beschikbaar zijn (zie rubriek 5.2) kan er geen doseringsadvies worden gegeven voor patiënten met een ernstig verminderde nierfunctie.
Verminderde leverfunctie
De veiligheid en werkzaamheid van Perjeta zijn niet onderzocht bij patiënten met een verminderde leverfunctie. Er kan geen specifiek doseringsadvies worden gegeven.
Pediatrische patiënten
De veiligheid en werkzaamheid van Perjeta zijn niet vastgesteld bij kinderen en adolescenten jonger dan 18 jaar. Er is geen relevante toepassing voor Perjeta bij pediatrische patiënten voor de indicatie borstkanker.
Wijze van toediening
Perjeta wordt toegediend door middel van intraveneuze infusie. Het mag niet worden toegediend als intraveneuze injectie of bolus. Voor instructies over verdunning van Perjeta voorafgaand aan toediening, zie rubrieken 6.2 en 6.6.
Voor de initiële oplaaddosis bedraagt de aanbevolen infusieperiode 60 minuten. Indien de eerste infusie goed wordt verdragen, kunnen de volgende infusies gedurende 30 minuten tot 60 minuten worden toegediend (zie rubriek 4.4).
Infusiereacties
Indien de patiënt een infusiereactie ontwikkelt, kan de infusiesnelheid worden vertraagd of de infusie worden onderbroken (zie rubriek 4.8). De infusie mag worden hervat wanneer de symptomen afnemen. Behandeling met onder andere zuurstof, bèta-agonisten, antihistaminica, snel toegediende intraveneuze vloeistoffen en antipyretica kan helpen om de symptomen te verlichten.
Overgevoeligheidsreacties/anafylaxie
De infusie moet onmiddellijk en permanent worden stopgezet als de patiënt last krijgt van een NCI-CTCAE graad 4-reactie (anafylaxie), bronchospasme of acuut respiratoir stress-syndroom (zie rubriek 4.4).
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Overzicht van het veiligheidsprofiel
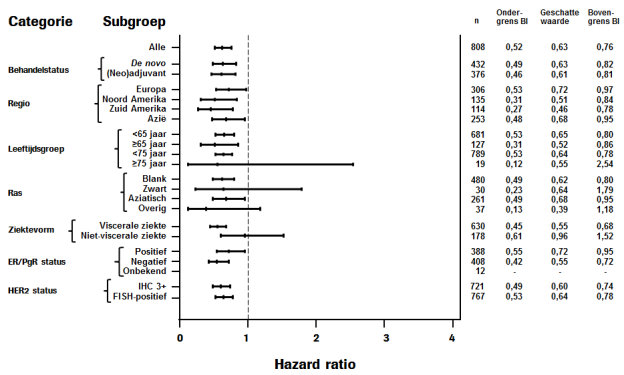
De veiligheid van Perjeta is onderzocht in fase I, II en III-onderzoeken met meer dan 6.000 patiënten, bij patiënten met uiteenlopende maligniteiten en waarbij overwegend behandeling plaatsvond met Perjeta in combinatie met andere antineoplastische middelen. Deze onderzoeken omvatten de registratie-onderzoeken CLEOPATRA (n = 808), NEOSPHERE (n = 417), TRYPHAENA (n = 225) en APHINITY (n = 4.804) [samengevoegd in tabel 2]. De veiligheid van Perjeta waargenomen in de onderzoeken kwam in het algemeen overeen, hoewel de incidentie en de meest voorkomende bijwerkingen varieerden, afhankelijk van of Perjeta werd toegediend als monotherapie of gelijktijdig met antineoplastische middelen.
Lijst van bijwerkingen in tabelvorm
Tabel 2 geeft een samenvatting van de bijwerkingen die optraden in de met Perjeta behandelde groepen van de klinische registratie-onderzoeken:
CLEOPATRA, waarbij Perjeta werd toegediend in combinatie met trastuzumab en docetaxel aan patiënten met gemetastaseerde borstkanker (n = 453)
NEOSPHERE (n = 309) en TRYPHAENA (n = 218), waarbij Perjeta neoadjuvant werd toegediend in combinatie met trastuzumab en chemotherapie aan patiënten met lokaal gevorderde, inflammatoire of vroege borstkanker
APHINITY, waarbij Perjeta adjuvant werd toegediend in combinatie met trastuzumab en een antracycline-houdende of antracycline-vrije taxaan-houdende chemotherapie aan patiënten met vroege borstkanker (n = 2.364)
Bijwerkingen die gemeld zijn na het op de markt brengen zijn ook weergegeven in tabel 2. Aangezien Perjeta in deze onderzoeken samen met trastuzumab en chemotherapie werd gebruikt, is het moeilijk om een causaal verband vast te stellen tussen een bijwerking en één specifiek geneesmiddel.
Hieronder worden per systeem/orgaanklasse volgens MedDRA de bijwerkingen weergegeven, met de frequentiecategorieën:
Zeer vaak (≥ 1/10)
Vaak (≥ 1/100, < 1/10)
Soms (≥ 1/1.000, < 1/100)
Zelden (≥ 1/10.000, < 1/1.000)
Zeer zelden (< 1/10.000)
Niet bekend (kan met de beschikbare gegevens niet worden bepaald)
Binnen iedere frequentiegroep en systeem/orgaanklasse worden de bijwerkingen weergegeven in afnemende ernst.
De meest voorkomende bijwerkingen (≥ 30%) uit deze samengevoegde data waren diarree, alopecia, misselijkheid, vermoeidheid, neutropenie en braken. De meest voorkomende bijwerkingen van NCI-CTCAE graad 3-4 (≥ 10%) waren neutropenie en febriele neutropenie.
Tabel 2 Samenvatting van de bijwerkingen bij patiënten behandeld met Perjeta in klinische onderzoeken^ en na het op de markt brengen†
Systeem/orgaanklasse | Zeer vaak | Vaak | Soms | |
Infecties en parasitaire aandoeningen | Nasofaryngitis | Paronychia |
|
|
Bloed- en lymfestelselaandoeningen | Febriele neutropenie* |
|
|
|
Immuunsysteem-aandoeningen | Infusiereactie°°,* | Overgevoeligheid°,* | Anafylactische reactie°,* | Cytokineafgiftesyndroom°° |
Voedings- en stofwisselingsstoornissen | Verminderde eetlust |
|
| Tumorlysissyndroom† |
Psychische stoornissen | Slapeloosheid |
|
|
|
Zenuwstelselaandoeningen | Perifere neuropathie |
|
|
|
Oogaandoeningen | Toegenomen traanproductie |
|
|
|
Hartaandoeningen |
| Linkerventrikeldisfunctie** | Congestief hartfalen** |
|
Bloedvataandoeningen | Opvliegers |
|
|
|
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Hoest |
| Interstitiële longziekte |
|
Maagdarmstelsel-aandoeningen | Diarree |
|
|
|
Huid- en onderhuidaandoeningen | Alopecia |
|
|
|
Skeletspierstelsel- en bindweefselaandoeningen | Myalgie |
|
|
|
Algemene aandoeningen en toedieningsplaatsstoornissen | Slijmvliesontsteking Perifeer oedeem | Rillingen |
|
|
^ Tabel 2 toont samengevoegde gegevens uit de totale behandelperiode in CLEOPATRA (data-cutoff 11 februari 2014; het mediane aantal Perjeta-cycli was 24); en uit de neoadjuvante behandelperiode in NEOSPHERE (het mediane aantal Perjeta-cycli was 4, over alle behandelgroepen) en TRYPHAENA (het mediane aantal Perjeta-cycli was 3-6 over de behandelgroepen) en de behandelperiode in APHINITY (het mediane aantal Perjeta-cycli was 18).
* Bijwerkingen met een fatale afloop zijn gemeld.
** Voor de totale behandelperiode over de 4 onderzoeken. De incidentie van linkerventrikeldisfunctie en congestief hartfalen komt overeen met de MedDRA voorkeurstermen gerapporteerd in de individuele onderzoeken.
° Overgevoeligheid/anafylactische reacties is gebaseerd op een groep van termen.
°° Infusiereactie omvat een reikwijdte aan verschillende termen binnen een tijdslot, zie “Beschrijving van geselecteerde bijwerkingen” hieronder.
† Bijwerkingen gemeld na het op de markt brengen
Beschrijving van geselecteerde bijwerkingen
Linkerventrikeldisfunctie(LVD)
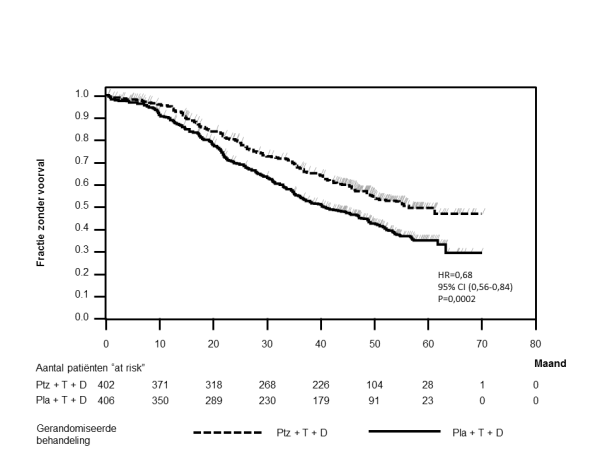
In het registratie-onderzoek CLEOPATRA, in gemetastaseerde borstkanker, was de incidentie van LVD tijdens onderzoeksbehandeling hoger in de placebogroep dan in de Perjetagroep (respectievelijk 8,6% en 6,6%). De incidentie van symptomatische LVD was ook lager in de Perjetagroep (1,8% in de placebogroep versus 1,5% in de Perjetagroep) (zie rubriek 4.4).
In het neoadjuvante onderzoek NEOSPHERE, waarbij de patiënten 4 cycli Perjeta als neoadjuvante behandeling kregen, was de incidentie van LVD (tijdens de totale behandelperiode) hoger in de met Perjeta, trastuzumab en docetaxel behandelde groep (7,5%) vergeleken met de met trastuzumab en docetaxel behandelde groep (1,9%). Er was één geval van symptomatische LVD in de met Perjeta en trastuzumab behandelde groep.
In het neoadjuvante onderzoek TRYPHAENA was de incidentie van LVD (tijdens de totale behandelingsperiode) 8,3% in de groep die behandeld werd met Perjeta plus trastuzumab en FEC (5-fluorouracil, epirubicine, cyclofosfamide) gevolgd door Perjeta plus trastuzumab en docetaxel; 9,3% in de groep behandeld met Perjeta plus trastuzumab en docetaxel na FEC; en 6,6% in de groep die behandeld werd met Perjeta in combinatie met TCH (docetaxel, carboplatine en trastuzumab). De incidentie van symptomatische LVD (congestief hartfalen) was 1,3% in de groep die behandeld werd met Perjeta plus trastuzumab en docetaxel na FEC (dit sluit een patiënt die symptomatische LVD heeft ervaren tijdens FEC-behandeling voorafgaand aan het krijgen van Perjeta plus trastuzumab en docetaxel uit) en ook 1,3% in de groep die behandeld werd met Perjeta in combinatie met TCH. Geen patiënten in de groep die behandeld werd met Perjeta plus trastuzumab en FEC gevolgd door Perjeta plus trastuzumab en docetaxel ervoeren symptomatische LVD.
In de neoadjuvante periode van het BERENICE-onderzoek, was de incidentie van NYHA-klasse III/IV symptomatisch LVD (congestief hartfalen volgens NCI-CTCAE v.4) 1,5% in de groep die behandeld werd met dose dense doxorubicine en cyclofosfamide (dd AC) gevolgd door Perjeta met trastuzumab en paclitaxel, en geen van de patiënten (0%) ervoeren symptomatisch LVD in de groep behandeld met FEC gevolgd door Perjeta in combinatie met trastuzumab en docetaxel. De incidentie van asymptomatisch LVD (ejectiefractiedaling volgens NCI-CTCAE v.4) was 7% in de groep behandeld met dose dense AC gevolgd door Perjeta met trastuzumab en paclitaxel en 3,5% in de groep behandeld met FEC gevolgd door Perjeta met trastuzumab en docetaxel.
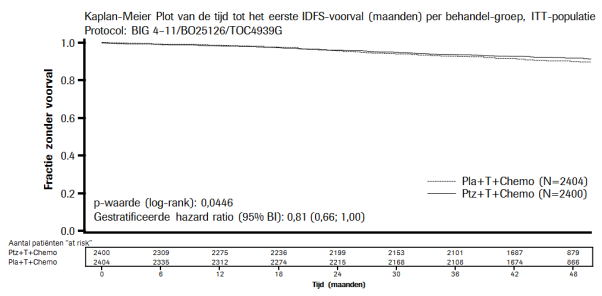
In het APHINITY-onderzoek was de incidentie van symptomatisch hartfalen (NYHA-klasse III of IV), met een afname van de LVEF van ten minste 10 procentpunten ten opzichte van de uitgangswaarde voorafgaand aan de behandeling en tot < 50%, minder dan 1% (0,8% van de Perjetagroep versus 0,4% van de placebogroep). Van de patiënten die symptomatisch hartfalen ontwikkelden, waren 62,5% van de patiënten uit de Perjetagroep en 66,7% van de patiënten uit de placebogroep hersteld op het moment van data-cutoff (herstel gedefinieerd als 2 opeenvolgende LVEF-waarden boven de 50%). Het merendeel van de voorvallen werd gemeld bij de patiënten behandeld met antracycline. Asymptomatische of mild symptomatische afnames in LVEF (NYHA- klasse II), met een afname van LVEF van ten minste 10 procentpunten ten opzichte van de uitgangswaarde voorafgaand aan de behandeling en tot < 50%, zijn gerapporteerd bij 2,7% van de Perjetagroep en bij 2,9% van de placebogroep, waarbij 84,4% van de Perjetagroep en 87,0% van de placebogroep was hersteld op het moment van data-cutoff.
Infusiereacties
In de registratie-onderzoeken werd een infusiereactie gedefinieerd als elk voorval gemeld als overgevoeligheid, anafylactische reactie, acute infusiereactie of cytokineafgiftesyndroom dat tijdens een infusie of op dezelfde dag als de infusie optrad. In het registratie-onderzoek CLEOPATRA werd de aanvangsdosis van Perjeta een dag eerder toegediend dan trastuzumab en docetaxel, zodat eventuele Perjeta-gerelateerde reacties onderzocht konden worden. Op de eerste dag, waarop uitsluitend Perjeta werd toegediend, bedroeg de totale frequentie van infusiereacties 9,8% in de placebogroep en 13,2% in de Perjetagroep, waarbij het merendeel van de infusiereacties mild of matig van aard was. De meest voorkomende infusiereacties (voorkomend bij ≥ 1,0%) in de Perjetagroep waren koorts, rillingen, vermoeidheid, hoofdpijn, asthenie, overgevoeligheid en braken.
Tijdens de tweede cyclus, waarbij alle geneesmiddelen op dezelfde dag werden toegediend, waren de meest voorkomende infusiereacties (voorkomend bij ≥ 1,0%) in de Perjetagroep vermoeidheid, dysgeusie, geneesmiddelovergevoeligheid, myalgie en braken (zie rubriek 4.4).
In de neoadjuvante en adjuvante onderzoeken werd Perjeta tijdens alle cycli op dezelfde dag toegediend als andere onderzoeksbehandelingen. Bij 18,6% tot 25,0% van de patiënten kwamen de infusiereacties voor op de eerste dag van toediening van Perjeta (in combinatie met trastuzumab en chemotherapie). De aard en ernst van voorvallen kwamen overeen met die werden waargenomen in CLEOPATRA tijdens de cycli waarop Perjeta op dezelfde dag werd gegeven als trastuzumab en docetaxel, waarbij de meeste reacties mild of matig ernstig waren.
Overgevoeligheidsreacties/anafylaxie
In het registratie-onderzoek CLEOPATRA bij patiënten met gemetastaseerde borstkanker, bedroeg de totale frequentie van de door de onderzoeker gemelde overgevoeligheid/anafylactische voorvallen gedurende de gehele behandelperiode in de placebogroep 9,3% en in de Perjetagroep 11,3%, en bij respectievelijk 2,5% en 2,0% daarvan was sprake van een reactie van NCI-CTCAE graad 3-4. In totaal trad bij 2 patiënten uit de placebogroep en bij 4 patiënten uit de Perjetagroep een voorval op dat door de onderzoeker werd beschreven als anafylaxie (zie rubriek 4.4).
Over het algemeen gold dat het merendeel van de overgevoeligheidsreacties mild tot matig van ernst was en na behandeling verdween. Op basis van aanpassingen aan de onderzoeksbehandeling werden de meeste reacties beschouwd als secundaire reacties op de docetaxel-infusies.
In de neoadjuvante en adjuvante onderzoeken kwamen de overgevoeligheids-/anafylaxie-voorvallen overeen met die werden waargenomen in CLEOPATRA. In NEOSPHERE ervoeren twee patiënten in de met Perjeta en docetaxel behandelde groep anafylaxie. In zowel het TRYPHAENA-onderzoek als het APHINITY-onderzoek was de totale frequentie van overgevoeligheid/anafylaxie het hoogst in de met Perjeta en TCH behandelde groep (respectievelijk 13,2% en 7,6%), waarvan respectievelijk 2,6% en 1,3% van de voorvallen NCI-CTCAE graad 3-4 was.
Febriele neutropenie
In het registratie-onderzoek CLEOPATRA maakte het merendeel van de patiënten in beide behandelgroepen minimaal één voorval van leukopenie door (63,0% van de patiënten in de Perjetagroep en 58,3% van de patiënten in de placebogroep), waarvan het merendeel neutropenie was (zie rubriek 4.4). Bij 13,7% van de patiënten in de Perjetagroep en 7,6% van de patiënten in de placebogroep trad febriele neutropenie op. In beide behandelgroepen was het aandeel patiënten dat febriele neutropenie kreeg het hoogst tijdens de eerste behandelcyclus en nam daarna gestaag af. In beide behandelgroepen werd onder Aziatische patiënten een toegenomen incidentie van febriele neutropenie gezien in vergelijking met patiënten van andere rassen en uit andere geografische regio's. Onder Aziatische patiënten was de incidentie van febriele neutropenie hoger in de Perjetagroep (25,8%) dan in de placebogroep (11,3%).
In het NEOSPHERE-onderzoek ervoer 8,4% van de patiënten die neoadjuvant behandeld werden met Perjeta, trastuzumab en docetaxel febriele neutropenie, in vergelijking met 7,5% bij patiënten behandeld met trastuzumab en docetaxel. In het TRYPAENA-onderzoek, kwam febriele neutropenie voor bij 17,1% van de patiënten die neoadjuvant behandeld werden met Perjeta en TCH en 9,3% van de patiënten die neoadjuvant behandeld werden met Perjeta, trastuzumab en docetaxel na FEC.
In TRYPHAENA was de incidentie van febriele neutropenie hoger bij patiënten die 6 cycli Perjeta ontvingen in vergelijking met patiënten die 3 cycli Perjeta ontvingen, ongeacht de chemotherapie die gegeven werd. Net zoals in het CLEOPATRA-onderzoek was de incidentie neutropenie en febriele neutropenie hoger onder Aziatische patiënten in vergelijking met andere patiënten in beide neoadjuvante onderzoeken. In NEOSPHERE ervoer 8,3% van de Aziatische patiënten die neoadjvant behandeld werden met Perjeta, trastuzumab en docetaxel febriele neutropenie vergeleken met 4,0% van de Aziatische patiënten die neoadjuvant behandeld werden met trastuzumab en docetaxel.
In het APHINITY-onderzoek trad febriele neutropenie op bij 12,1% van de met Perjeta behandelde patiënten en bij 11,1% van de met placebo behandelde patiënten. Zoals in de CLEOPATRA-, TRYPHAENA- en NEOSPHERE-onderzoeken, werd in het APHINITY-onderzoek een hogere incidentie van febriele neutropenie waargenomen bij de met Perjeta behandelde Aziatische patiënten in vergelijking met patiënten van andere afkomst (15,9% van de met Perjeta behandelde patiënten en 9,9% van de met placebo behandelde patiënten).
Diarree
In het registratie-onderzoek CLEOPATRA bij patiënten met gemetastaseerde borstkanker, kwam diarree voor bij 68,4% van de met Perjeta behandelde patiënten en bij 48,7% van de met placebo behandelde patiënten (zie rubriek 4.4). De meeste voorvallen waren mild tot matig van ernst en traden op tijdens de eerste paar behandelcycli. NCI-CTCAE graad 3-4 diarree kwam voor bij 9,3% van de met Perjeta behandelde patiënten en bij 5,1% van de met placebo behandelde patiënten. De mediane duur van de langste episode was 18 dagen bij de met Perjeta behandelde patiënten en 8 dagen bij de met placebo behandelde patiënten. Voorvallen van diarree reageerden goed op proactieve behandeling met antidiarreemiddelen.
In het NEOSPHERE-onderzoek kwam diarree bij 45,8% van de patiënten voor die neoadjuvant met Perjeta, trastuzumab en docetaxel werden behandeld, in vergelijking tot 33,6% bij patiënten die behandeld werden met trastuzumab en docetaxel.
In het TRYPAENA-onderzoek kwam diarree bij 72,3% van de patiënten voor die behandeld werden met Perjeta en TCH en bij 61,4% van de patiënten die neoadjuvant behandeld werden met Perjeta, trastuzumab en docetaxel na FEC. In beide onderzoeken waren de meeste voorvallen mild tot matig van ernst.
In het APHINITY-onderzoek werd een hogere incidentie van diarree gerapporteerd in de Perjetagroep (71,2%) vergeleken met de placebogroep (45,2%). Diarree graad ≥ 3 werd gerapporteerd bij 9,8% van de patiënten in de Perjetagroep versus 3,7% in de placebogroep. Het merendeel van de gemelde voorvallen had een ernst van graad 1 of 2. De hoogste incidentie van diarree (alle gradaties) werd gerapporteerd tijdens de behandelperiode met HER2-gerichte therapie + taxaan-houdende chemotherapie (61,4% van de patiënten in de Perjetagroep versus 33,8% van de patiënten in de placebogroep). De incidentie van diarree was veel lager na beëindiging van chemotherapie en betrof 18,1% van de patiënten in de Perjetagroep versus 9,2% van de patiënten in de placebogroep gedurende de periode van gerichte therapie na de behandeling met chemotherapie.
Uitslag
In het registratie-onderzoek CLEOPATRA bij patiënten met gemetastaseerde borstkanker, kwam uitslag voor bij 51,7% van de patiënten in de Perjetagroep en bij 38,9% van de patiënten in de placebogroep. De meeste voorvallen hadden een ernst van graad 1 of 2, traden op tijdens de eerste twee cycli en reageerden op standaardtherapieën zoals topicale of orale acnebehandeling.
In het NEOSPEHERE-onderzoek kwam uitslag voor bij 40,2% van de patiënten die neoadjuvant behandeld werden met Perjeta, trastuzumab en docetaxel, in vergelijking met 29,0% bij patiënten die behandeld werden met trastuzumab en docetaxel.
In het TRYPHAENA-onderzoek kwam uitslag voor bij 36,8% van de patiënten die neoadjuvant behandeld werden met Perjeta en TCH en bij 20,0% van de patiënten die neoadjuvant behandeld werden met Perjeta, trastuzumab en docetaxel na FEC. De incidentie van uitslag was hoger in patiënten die 6 cycli Perjeta ontvingen dan in patiënten die 3 cycli Perjeta ontvingen, ongeacht de chemotherapie die werd gegeven.
In het APHINITY-onderzoek kwam uitslag voor bij 25,8% van de patiënten die met Perjeta werden behandeld versus 20,3% bij patiënten in de placebogroep. Het merendeel van de gevallen van uitslag was van graad 1 of 2.
Afwijkende laboratoriumbevindingen
In het registratie-onderzoek CLEOPATRA bij patiënten met gemetastaseerde borstkanker, was de incidentie van NCI-CTCAE v.3 graad 3-4 neutropenie gebalanceerd tussen de twee behandelgroepen (86,3% in de Perjetagroep en 86,6% in de placebogroep, inclusief respectievelijk 60,7% en 64,8% graad 4 neutropenie).
In het NEOSPHERE-onderzoek was de incidentie van NCI-CTCAE v.3 graad 3-4 neutropenie 74,5% in patiënten die neoadjuvant behandeld werden met Perjeta, trastuzumab en docetaxel, vergeleken met 84,5% in patiënten die behandeld werden met trastuzumab en docetaxel, waaronder respectievelijk 50,9% en 60,2% graad 4 neutropenie.
In het TRYPHAENA-onderzoek was de incidentie van NCI-CTCAE v.3 graad 3-4 neutropenie 85,3% bij patiënten die neoadjuvant behandeld werden met Perjeta en TCH en 77,0% bij patiënten die neoadjuvant behandeld werden met Perjeta, trastuzumab en docetaxel na FEC, waaronder respectievelijk 66,7% en 59,5% graad 4 neutropenie.
In het APHINITY-onderzoek was de incidentie van neutropenie van NCI-CTCAE v.4 graad 3-4 40,6% bij patiënten die behandeld werden met Perjeta, trastuzumab en chemotherapie, vergeleken met 39,1% bij patiënten die behandeld werden met placebo, trastuzumab en chemotherapie, waaronder respectievelijk 28,3% en 26,5% neutropenie van graad 4.
Ouderen
Voor de volgende bijwerkingen (alle graden) was de incidentie ten minste 5% hoger bij patiënten van 65 jaar en ouder vergeleken met patiënten jonger dan 65 jaar: verminderde eetlust, anemie, gewichtsverlies, asthenie, dysgeusie, perifere neuropathie, hypomagnesiëmie en diarree. Er zijn beperkte gegevens beschikbaar over patiënten ouder dan 75 jaar.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden (zie hieronder voor details).
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/13/813/001
10. DATUM VAN HERZIENING VAN DE TEKST
8 mei 2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3019890 | PERJETA 420MG CONC OPL INF FL INJ 1 X 14ML | L01FD02 | - | € 1900,77 | Ja | - | - |