1. NAAM VAN HET GENEESMIDDEL
Rotarix suspensie voor oraal gebruik in voorgevulde applicator voor orale toediening.
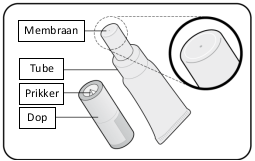
Rotarix suspensie voor oraal gebruik in samendrukbare tube.
Rotarix suspensie voor oraal gebruik in presentatie van samendrukbare tubes met monodosering (5 keer enkele doses) verbonden door een strip.
Rotavirus vaccin, levend
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
1 dosis (1,5 ml) bevat:
Humaan rotavirus RIX4414 stam (levend, verzwakt)* niet minder dan 106.0 CCID50
* geproduceerd op VERO-cellen
Hulpstoffen met bekend effect:
Dit product bevat 1.073 mg sucrose, 32 mg natrium, 10 microgram glucose en 0,15 microgram fenylalanine per dosis (zie rubriek 4.4).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Suspensie voor oraal gebruik.
Rotarix is een heldere, kleurloze vloeistof.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Rotarix is geïndiceerd voor actieve immunisatie, bij zuigelingen van 6 tot 24 weken, ter voorkoming van gastro-enteritis veroorzaakt door een rotavirusinfectie (zie rubrieken 4.2, 4.4 en 5.1).
De toepassing van Rotarix moet in overeenstemming zijn met officiële richtlijnen.
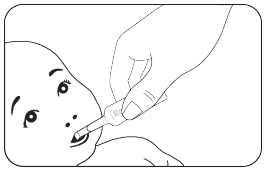
4.2 Dosering en wijze van toediening
Dosering
De vaccinatie bestaat uit twee doses. De eerste dosis kan vanaf een leeftijd van 6 weken worden toegediend. Tussen de doses moet een interval van ten minste 4 weken zijn. De vaccinatie moet bij voorkeur vóór de leeftijd van 16 weken afgerond worden, maar uiterlijk voor de leeftijd van 24 weken.
Rotarix kan worden gegeven aan premature zuigelingen geboren na ten minste 27 weken zwangerschap in dezelfde dosering (zie rubrieken 4.8 en 5.1).
Tijdens klinische studies werd in zeldzame gevallen spugen en uitbraken van het vaccin waargenomen en in deze omstandigheden werd geen vervangende dosis gegeven. Echter, in het onwaarschijnlijke geval dat een zuigeling het grootste deel van het vaccin uitspuugt of uitbraakt, kan meteen een vervangende dosis gegeven worden.
Het wordt aanbevolen om bij zuigelingen die een eerste dosis Rotarix krijgen van een vaccinatie van twee doses, deze vaccinatie ook af te ronden met Rotarix. Er zijn geen gegevens bekend over veiligheid, immunogeniciteit of werkzaamheid indien Rotarix wordt toegediend bij de eerste dosis en een ander rotavirusvaccin bij de tweede dosis of vice versa.
Pediatrische patiënten
Rotarix mag niet worden gebruikt bij kinderen in de leeftijd van 24 weken of ouder.
Wijze van toediening
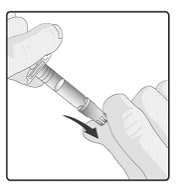
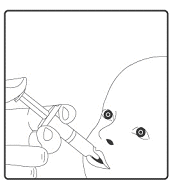
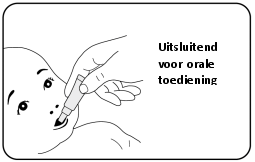
Rotarix is alleen geschikt voor oraal gebruik.
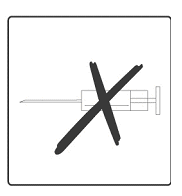
Rotarix mag onder geen beding worden geïnjecteerd.
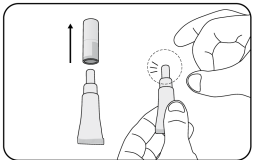
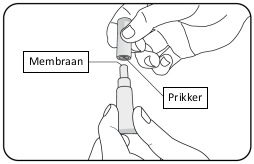
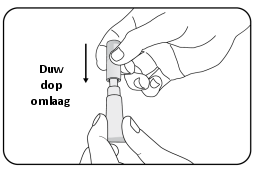
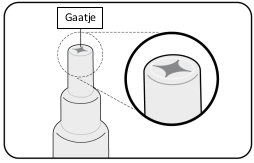
Voor instructies over de toediening, zie rubriek 6.6.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof(fen) of voor (één van) de in rubriek 6.1 vermelde hulpstoffen.
Bekende overgevoeligheid na voorgaande toediening van rotavirusvaccins.
Voorgeschiedenis met darminvaginatie.
Personen met een ongecorrigeerde aangeboren afwijking van het gastro-intestinale stelsel die gepredisponeerd zijn voor darminvaginatie.
Personen met het ernstige gecombineerde immunodeficiëntiesyndroom (SCID) (zie rubriek 4.8).
Toediening van Rotarix moet uitgesteld worden bij personen met acuut ernstige koorts. De aanwezigheid van een lichte infectie is geen contra-indicatie voor vaccinatie.
De toediening van Rotarix moet worden uitgesteld bij personen met diarree of personen die overgeven.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Het hieronder weergegeven veiligheidsprofiel is gebaseerd op klinische studies met de gevriesdroogde of de vloeibare formulering van Rotarix.
In 4 klinische studies zijn bijna 3.800 doseringen van Rotarix vloeibare formulering toegediend bij bijna 1.900 zuigelingen. Deze studies hebben aangetoond dat het veiligheidsprofiel van de vloeibare formulering vergelijkbaar is met de gevriesdroogde formulering.
In 23 placebogecontroleerde klinische studies zijn ongeveer 106.000 doses Rotarix (gevriesdroogde of vloeibare formulering) toegediend aan ongeveer 51.000 zuigelingen.
In twee klinische studies (Finland) werd alleen de gevriesdroogde formulering van Rotarix toegediend (toediening van de gebruikelijke pediatrische vaccins was opgeschort). De incidentie en ernst van de bijwerkingen (verzameld acht dagen na vaccinatie) diarree, overgeven, gebrek aan eetlust, koorts, prikkelbaarheid en hoesten/loopneus waren niet significant verschillend in de groep die Rotarix kreeg vergeleken met de groep die placebo kreeg toegediend. Er was geen toename in incidentie of de ernst van deze bijwerkingen bij de toediening van de tweede dosis.
In een gepoolde analyse van 17 placebo-gecontroleerde klinische studies (Europa, Noord-Amerika, Azië, Afrika) inclusief studies waarin Rotarix gelijktijdig met gebruikelijke pediatrische vaccins toegediend werd (zie rubriek 4.5), waren de volgende bijwerkingen (verzameld 31 dagen na vaccinatie) mogelijk gerelateerd aan de vaccinatie.
Lijst van bijwerkingen in tabelvorm
Bijwerkingen worden hieronder weergegeven volgens de volgende frequenties.
Frequenties zijn gerapporteerd als:
Zeer vaak (≥ 1/10)
Vaak (≥ 1/100, < 1/10)
Soms (≥ 1/1.000, < 1/100)
Zelden (≥ 1/10.000, < 1/1.000)
Zeer zelden (< 1/10.000)
Systeemorgaanklasse | Frequentie | Bijwerkingen |
Maagdarmstelselaandoeningen | vaak | diarree |
soms | buikpijn, flatulentie | |
zeer zelden | intussusceptie (zie rubriek 4.4) | |
niet bekend* | bloederige feces | |
niet bekend* | gastro-enteritis met virale shedding van het vaccin bij kinderen met ernstige gecombineerde immuundeficiëntie (SCID) | |
Huid- en onderhuidaandoeningen | soms | dermatitis |
zeer zelden | urticaria | |
Algemene aandoeningen en toedieningsplaatsstoornissen | vaak | prikkelbaarheid |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | niet bekend* | apnoe bij zeer premature kinderen (geboren ≤ 28 weken zwangerschap) (zie rubriek 4.4) |
* Aangezien deze bijwerkingen spontaan gemeld zijn, is het niet mogelijk om op betrouwbare wijze hun frequentie te schatten.
Beschrijving van geselecteerde bijwerkingen
Intussusceptie
Gegevens uit observationale veiligheidsstudies die zijn uitgevoerd in diverse landen tonen aan dat rotavirusvaccins een toegekomen risico op intussusceptie geven, meestal binnen 7 dagen na vaccinatie. Er zijn per jaar tot 6 extra gevallen per 100.000 zuigelingen waargenomen in deze landen tegen een achtergrondincidentie van respectievelijk 25 tot 101 per 100.000 zuigelingen (jonger dan één jaar oud).
Er is beperkt bewijs van een kleiner toegenomen risico na de tweede dosis.
Het blijft, gebaseerd op langere follow-up-perioden, onduidelijk of rotavirusvaccins de totale incidentie van intussusceptie beïnvloeden (zie rubriek 4.4).
Andere speciale populaties
Veiligheid bij premature zuigelingen
In een klinisch onderzoek kregen 670 premature zuigelingen, geboren na 27 tot 36 weken zwangerschap, Rotarix gevriesdroogde formulering en 339 premature zuigelingen placebo toegediend. De eerste dosis werd toegediend vanaf 6 weken na geboorte. Ernstige bijwerkingen werden waargenomen bij 5,1% van de zuigelingen die Rotarix kregen toegediend, vergeleken met 6,8% van de zuigelingen die placebo kregen toegediend. Het aantal andere bijwerkingen waargenomen bij zuigelingen die Rotarix kregen en zuigelingen die placebo kregen, was vergelijkbaar. Er werden geen gevallen van intussusceptie gerapporteerd.
Veiligheid bij zuigelingen met humaan immunodeficiëntie (HIV-) infectie
In een klinisch onderzoek kregen 100 met HIV geïnfecteerde zuigelingen Rotarix gevriesdroogde formulering of placebo toegediend. Het veiligheidsprofiel was vergelijkbaar in beide groepen.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
Afdeling Vigilantie
Postbus 97
1000 Brussel
Madou
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
GlaxoSmithKline Biologicals SA
Rue de l’Institut 89
B-1330 Rixensart
België
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Voorgevulde applicator voor orale toediening
EU/1/05/330/005
EU/1/05/330/006
EU/1/05/330/007
EU/1/05/330/008
Samendrukbare tube
EU/1/05/330/009
EU/1/05/330/010
EU/1/05/330/011
Presentatie van samendrukbare tubes met monodosering (5 keer enkele doses) verbonden door een strip
EU/1/05/330/012
10. DATUM VAN HERZIENING VAN DE TEKST
07/2023 (v36)
Gedetailleerde informatie over dit product is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2663532 | ROTARIX SUSP BUV 1,5 ML TUBE | J07BH01 | € 72,95 | - | Ja | € 12,8 | € 8,5 |