SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
NeoRecormon 500 IE oplossing voor injectie in een voorgevulde spuit
NeoRecormon 2.000 IE oplossing voor injectie in een voorgevulde spuit
NeoRecormon 3.000 IE oplossing voor injectie in een voorgevulde spuit
NeoRecormon 4.000 IE oplossing voor injectie in een voorgevulde spuit
NeoRecormon 5.000 IE oplossing voor injectie in een voorgevulde spuit
NeoRecormon 6.000 IE oplossing voor injectie in een voorgevulde spuit
NeoRecormon 10.000 IE oplossing voor injectie in een voorgevulde spuit
NeoRecormon 20.000 IE oplossing voor injectie in een voorgevulde spuit
NeoRecormon 30.000 IE oplossing voor injectie in een voorgevulde spuit
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
NeoRecormon 500 IE oplossing voor injectie in een voorgevulde spuit
Eén voorgevulde spuit met 0,3 ml oplossing voor injectie bevat 500 internationale eenheden (IE) overeenkomend met 4,15 microgram epoëtine bèta* (recombinant humaan erytropoëtine).
Eén ml oplossing voor injectie bevat 1.667 IE epoëtine bèta.
NeoRecormon 2.000 IE oplossing voor injectie in een voorgevulde spuit
Eén voorgevulde spuit met 0,3 ml oplossing voor injectie bevat 2.000 internationale eenheden (IE) overeenkomend met 16,6 microgram epoëtine bèta* (recombinant humaan erytropoëtine).
Eén ml oplossing voor injectie bevat 6.667 IE epoëtine bèta.
NeoRecormon 3.000 IE oplossing voor injectie in een voorgevulde spuit
Eén voorgevulde spuit met 0,3 ml oplossing voor injectie bevat 3.000 internationale eenheden (IE) overeenkomend met 24,9 microgram epoëtine bèta* (recombinant humaan erytropoëtine).
Eén ml oplossing voor injectie bevat 10.000 IE epoëtine bèta.
NeoRecormon 4.000 IE oplossing voor injectie in een voorgevulde spuit
Eén voorgevulde spuit met 0,3 ml oplossing voor injectie bevat 4.000 internationale eenheden (IE) overeenkomend met 33,2 microgram epoëtine bèta* (recombinant humaan erytropoëtine).
Eén ml oplossing voor injectie bevat 13.333 IE epoëtine bèta.
NeoRecormon 5.000 IE oplossing voor injectie in een voorgevulde spuit
Eén voorgevulde spuit met 0,3 ml oplossing voor injectie bevat 5.000 internationale eenheden (IE) overeenkomend met 41,5 microgram epoëtine bèta* (recombinant humaan erytropoëtine).
Eén ml oplossing voor injectie bevat 16.667 IE epoëtine bèta.
NeoRecormon 6.000 IE oplossing voor injectie in een voorgevulde spuit
Eén voorgevulde spuit met 0,3 ml oplossing voor injectie bevat 6.000 internationale eenheden (IE) overeenkomend met 49,8 microgram epoëtine bèta* (recombinant humaan erytropoëtine).
Eén ml oplossing voor injectie bevat 20.000 IE epoëtine bèta.
NeoRecormon 10.000 IE oplossing voor injectie in een voorgevulde spuit
Eén voorgevulde spuit met 0,6 ml oplossing voor injectie bevat 10.000 internationale eenheden (IE) overeenkomend met 83 microgram epoëtine bèta* (recombinant humaan erytropoëtine).
Eén ml oplossing voor injectie bevat 16.667 IE epoëtine bèta.
NeoRecormon 20.000 IE oplossing voor injectie in een voorgevulde spuit
Eén voorgevulde spuit met 0,6 ml oplossing voor injectie bevat 20.000 internationale eenheden (IE) overeenkomend met 166 microgram epoëtine bèta* (recombinant humaan erytropoëtine).
Eén ml oplossing voor injectie bevat 33.333 IE epoëtine bèta.
NeoRecormon 30.000 IE oplossing voor injectie in een voorgevulde spuit
Eén voorgevulde spuit met 0,6 ml oplossing voor injectie bevat 30.000 internationale eenheden (IE) overeenkomend met 250 microgram epoëtine bèta* (recombinant humaan erytropoëtine).
Eén ml oplossing voor injectie bevat 50.000 IE epoëtine bèta.
* Geproduceerd met behulp van recombinant DNA technologie in Chinese Hamster Ovariumcellen (CHO).
Hulpstoffen met een bekend effect
Fenylalanine (tot 0,3 mg/spuit)
Natrium (minder dan 1 mmol/spuit)
Polysorbaat 20 (0,034 mg/spuit nominaal volume 0,3 ml en 0,063 mg/spuit nominaal volume 0,6 ml)
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie.
Kleurloze, heldere tot enigszins melkachtige oplossing.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
NeoRecormon is geïndiceerd voor:
- Behandeling van symptomatische anemie als gevolg van chronisch nierfalen bij volwassenen en kinderen
- Preventie van anemie bij prematuren met een geboortegewicht van 750 tot 1.500 gram en een zwangerschapsduur van minder dan 34 weken
- Behandeling van symptomatische anemie bij volwassen patiënten met non-myeloïde maligniteiten die behandeld worden met chemotherapie
- Het vermeerderen van de opbrengst van autoloog bloed bij patiënten in een predonatieprogramma
Het gebruik in deze indicatie dient te worden afgewogen tegen het gemelde verhoogde risico op trombo-embolische gebeurtenissen. Behandeling dient alleen te worden gegeven aan patiënten met matige anemie (Hb 10 ‑ 13 g/dl [6.21 ‑ 8.07 mmol/l], geen ijzergebrek) indien bloed conserverende procedures niet beschikbaar zijn of onvoldoende zijn wanneer de geplande grote electieve chirurgische ingreep een grote hoeveelheid bloed vereist (4 of meer eenheden bloed voor vrouwen of 5 of meer eenheden bloed voor mannen). Zie rubriek 5.1.
4.2 Dosering en wijze van toediening
Behandeling met NeoRecormon dient te worden ingesteld door artsen die ervaren zijn met de bovengenoemde indicaties. Aangezien anafylactoïde reacties in incidentele gevallen zijn beschreven, wordt geadviseerd de eerste dosis onder medische supervisie toe te dienen.
Dosering
Behandeling van symptomatische anemie bij volwassen en pediatrische patiënten met chronisch nierfalen
Symptomen van anemie en bijwerkingen kunnen variëren naar leeftijd, geslacht en algemene belasting als gevolg van de ziekte; een evaluatie door een arts van het klinisch verloop van de individuele patiënt is noodzakelijk. NeoRecormon dient ofwel subcutaan ofwel intraveneus te worden toegediend voor een hemoglobinestijging niet hoger dan 12 g/dl (7,45 mmol/l). Subcutaan gebruik heeft de voorkeur bij patiënten die geen hemodialyse krijgen om het doorprikken van de perifere aderen te voorkomen. Bij intraveneuze toediening dient de oplossing gedurende ongeveer 2 minuten langzaam intraveneus te worden toegediend, bijv. bij hemodialysepatiënten via de arterioveneuze fistel aan het eind van de dialyse.
Als gevolg van variabiliteit tussen patiënten, kunnen incidenteel hemoglobinewaarden worden waargenomen die boven of onder de gewenste hemoglobinewaarden liggen. Variabiliteit in hemoglobine dient te worden toegeschreven aan het beheersen van de dosering, waarbij rekening wordt gehouden met een hemoglobine target range van 10 g/dl (6,21 mmol/l) tot 12 g/dl (7,45 mmol/l). Een aanhoudend hemoglobineniveau van meer dan 12 g/dl (7,45 mmol/l) dient te worden vermeden; richtlijnen voor geschikte dosisaanpassingen indien hemoglobinewaarden van meer dan 12 g/dl (7,45 mmol/l) worden waargenomen, zijn hieronder beschreven.
Een stijging in hemoglobine van meer dan 2 g/dl (1,25 mmol/l) over een periode van vier weken dient te worden vermeden. Indien dit optreedt, dient de dosis te worden aangepast zoals beschreven. Als de mate van stijging in de hemoglobine meer is dan 2 g/dl (1,25 mmol/l) in een maand, of als het hemoglobineniveau toeneemt en 12 g/dl (7,45 mmol/l) nadert, dient de dosering met ongeveer 25% verminderd te worden. Als het hemoglobineniveau blijft stijgen, dient de therapie te worden onderbroken tot het hemoglobineniveau begint te dalen. Op dat moment dient de therapie opnieuw te worden gestart bij een dosering die ongeveer 25% onder de eerder toegediende dosering ligt.
Patiënten dienen nauwkeurig te worden gecontroleerd om er zeker van te zijn dat de laagst goedgekeurde werkzame dosering NeoRecormon wordt gebruikt om adequate controle van de anemiesymptomen te bewerkstelligen, terwijl een hemoglobineconcentratie van 12 g/dl (7,45 mmol/l) of lager gehandhaafd wordt.
Voorzichtigheid moet worden betracht bij dosisescalatie van NeoRecormon bij patiënten met chronisch nierfalen. Voor patiënten met een beperkte hemoglobinerespons op NeoRecormon moeten alternatieve verklaringen voor deze beperkte respons worden overwogen (zie rubriek 4.4 en 5.1).
In de aanwezigheid van hypertensie of bestaande cardiovasculaire-, cerebrovasculaire- of perifere vaataandoeningen, dient de wekelijkse toename van de Hb en de maximale Hb op de individuele patiënt te worden afgestemd op geleide van het klinisch beeld.
De behandeling met NeoRecormon wordt verdeeld in twee stadia:
1. Correctiefase
- Subcutane toediening:
De behandeling begint met een dosis van 3 x 20 IE/kg lichaamsgewicht per week. Indien nodig mag de dosis iedere vier weken met 3 x 20 IE/kg lichaamsgewicht per week worden verhoogd indien de toename van de Hb niet adequaat is (< 0,25 g/dl per week).
De weekdosering kan ook verdeeld worden over dagelijkse doseringen.
- Intraveneuze toediening:
De behandeling begint met een dosis van 3 x 40 IE/kg lichaamsgewicht per week. Indien nodig mag de dosis na 4 weken verhoogd worden tot 80 IE/kg lichaamsgewicht driemaal per week. Indien verdere verhoging noodzakelijk is, mag de dosis om de maand verhoogd worden met 20 IE/kg lichaamsgewicht driemaal per week.
Zowel voor de subcutane als de intraveneuze toediening geldt een maximale dosis van 720 IE/kg lichaamsgewicht per week.
2. Onderhoudsfase
Om een Hb van tussen 10 en 12 g/dl te handhaven wordt de dosis eerst verlaagd tot de helft van de laatst toegediende dosis. Vervolgens wordt de dosis afgestemd op de individuele patiënt met intervallen van 1 of 2 weken (onderhoudsdosis).
Bij subcutane toediening kan de wekelijkse dosis gegeven worden als één injectie per week of verdeeld over 3 of 7 doses per week. Patiënten die stabiel zijn op een doseringsschema van eenmaal per week kunnen overgezet worden op een doseringsschema van eenmaal per 2 weken. In dit geval kan een verhoging van de dosis noodzakelijk zijn.
Resultaten van klinische studies bij kinderen hebben aangetoond dat, gemiddeld, de benodigde NeoRecormon dosis hoger werd naarmate de kinderen jonger waren. Niettemin dient niet afgeweken te worden van het aanbevolen doseringsschema, daar de individuele respons niet voorspeld kan worden.
De behandeling met NeoRecormon zal in de meeste gevallen langdurig worden voortgezet. De behandeling kan echter, indien noodzakelijk, op elk moment onderbroken worden. Gegevens over het doseringsschema van eenmaal per week zijn gebaseerd op klinische studies met een behandelingsduur van 24 weken.
Preventie van anemie bij prematuren
De oplossing wordt subcutaan toegediend in een dosis van 3 x 250 IE/kg lichaamsgewicht per week. Prematuren die al bloedtransfusies hebben ontvangen vóór de start van de behandeling met NeoRecormon ondervinden waarschijnlijk minder voordeel van de behandeling dan niet-getransfundeerde prematuren. De aanbevolen behandelduur is zes weken.
Behandeling van symptomatische door chemotherapie geïnduceerde anemie bij kankerpatiënten
NeoRecormon dient subcutaan te worden toegediend aan patiënten met anemie (bijvoorbeeld hemoglobineconcentratie ≤ 10 g/dl (6,21 mmol/l)). Symptomen van anemie en bijwerkingen kunnen variëren naar leeftijd, geslacht en algemene belasting als gevolg van de ziekte; een evaluatie door een arts van het klinisch verloop van de individuele patiënt is noodzakelijk.
De wekelijkse dosis kan als één injectie per week of verdeeld over 3 tot 7 doses per week toegediend worden.
De aanbevolen startdosis bedraagt 30.000 IE per week (overeenkomend met ongeveer 450 IE/kg lichaamsgewicht per week, gebaseerd op een patiënt met een gemiddeld gewicht).
Als gevolg van variabiliteit tussen patiënten, kunnen incidenteel hemoglobinewaarden worden waargenomen die boven of onder de gewenste hemoglobinewaarden liggen. Variabiliteit in hemoglobine dient te worden toegeschreven aan het beheersen van de dosering, waarbij rekening wordt gehouden met een hemoglobine target range van 10 g/dl (6,21 mmol/l) tot 12 g/dl (7,45 mmol/l). Een aanhoudend hemoglobineniveau van meer dan 12 g/dl (7,45 mmol/l) dient te worden vermeden; richtlijnen voor geschikte dosisaanpassingen indien hemoglobinewaarden van meer dan 12 g/dl (7,45 mmol/l) worden waargenomen, zijn hieronder beschreven.
Indien na vier weken behandelen de hemoglobinewaarde met ten minste 1 g/dl (0,62 mmol/l) gestegen is, dient de huidige dosis gecontinueerd te worden. Indien de hemoglobinewaarde niet met ten minste 1 g/dl (0,62 mmol/l) gestegen is, dient een verdubbeling van de wekelijkse dosis overwogen te worden. Indien na 8 weken behandelen de hemoglobinewaarde niet met ten minste 1 g/dl (0,62 mmol/l) gestegen is, is respons niet waarschijnlijk en dient de behandeling gestaakt te worden.
De behandeling dient tot maximaal vier weken na de chemotherapie te worden voortgezet.
De maximale dosis mag niet meer zijn dan 60.000 IE per week.
Wanneer de therapeutische streefwaarden voor een individuele patiënt bereikt zijn, dient de dosis met 25 tot 50% verlaagd te worden om de hemoglobinewaarde op dat niveau te houden. Een geschikte dosistitratie dient te worden overwogen.
Als de hemoglobine meer dan 12 g/dl (7,45 mmol/l) is, dient de dosis met 25 tot 50% te worden verlaagd. Behandeling met NeoRecormon dient tijdelijk te worden onderbroken als het hemoglobineniveau meer is dan 13 g/dl (8,1 mmol/l). Therapie dient opnieuw te worden gestart, met een dosis van ongeveer 25% lager dan de eerder toegediende dosis als hemoglobineniveaus dalen tot 12 g/dl (7,45 mmol/l) of lager.
Indien de hemoglobinewaarde met meer dan 2 g/dl (1,3 mmol) per 4 weken toeneemt, dient de dosis met 25 tot 50% verlaagd te worden.
Patiënten dienen nauwkeurig te worden gecontroleerd om er zeker van te zijn dat de laagst goedgekeurde dosering NeoRecormon wordt gebruikt om adequate controle van de anemiesymptomen te bewerkstelligen.
Behandeling voor vermeerdering van de opbrengst van autologe bloeddonatie
De oplossing kan subcutaan worden toegediend, of gedurende ongeveer 2 minuten intraveneus worden toegediend.
NeoRecormon wordt tweemaal per week toegediend over een periode van 4 weken. Indien de hematocriet van de patiënt bloeddonatie toestaat (Ht 33%), wordt NeoRecormon toegediend na de bloeddonatie.
Gedurende de gehele behandelingsperiode mag de hematocriet de 48% niet overschrijden.
De dosering dient voor iedere patiënt afzonderlijk te worden vastgesteld door het chirurgisch team als functie van de benodigde hoeveelheid autoloog bloed en de endogene rode bloedcelreserve:
1. De benodigde hoeveelheid autoloog bloed is afhankelijk van het te verwachten bloedverlies, het gebruik van bloedconserveringsprocedures en de lichamelijke conditie van de patiënt.
Deze hoeveelheid dient voldoende te zijn om homologe transfusies te voorkomen.
De benodigde hoeveelheid autoloog bloed wordt uitgedrukt in eenheden, waarbij één eenheid in het nomogram overeenkomt met 180 ml rode bloedcellenconcentraat.
2. De mogelijkheid om autoloog bloed te doneren is hoofdzakelijk afhankelijk van het bloedvolume van de patiënt en de uitgangswaarde van de hematocriet. Beide parameters bepalen de endogene rode bloedcelreserve, welke berekend kan worden volgens de volgende formule:
Endogene rode bloedcelreserve = bloedvolume [ml] x (Ht-33) ÷ 100
Vrouw: bloedvolume [ml] = 41 [ml/kg] x lichaamsgewicht [kg] + 1.200 [ml]
Man: bloedvolume [ml] = 44 [ml/kg] x lichaamsgewicht [kg] + 1.600 [ml]
(Lichaamsgewicht > 45 kg)
De indicatie voor behandeling met NeoRecormon en indien vereist, de dosis per injectie, dienen te worden bepaald aan de hand van het vereiste aantal eenheden autoloog bloed en de endogene rode bloedcelreserve met behulp van de volgende grafieken:
Vrouwelijke patiënt Mannelijke patiënt
Benodigde aantal eenheden Benodigde aantal eenheden
autoloog bloed autoloog bloed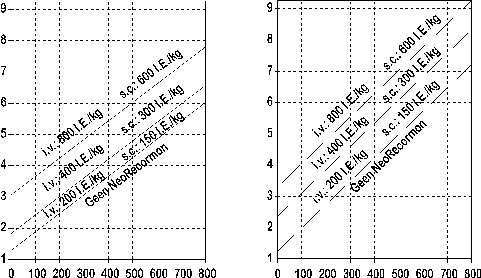
Endogene rode bloedcelreserve [ml] Endogene rode bloedcelreserve [ml]
De vastgestelde enkelvoudige dosis wordt tweemaal per week toegediend gedurende 4 weken. De maximale dosis bij intraveneuze toediening mag de 1.600 IE/kg lichaamsgewicht per week niet overschrijden en bij subcutane toediening bedraagt de maximale dosis 1.200 IE/kg per week.
Wijze van toediening
NeoRecormon voorgevulde spuit is klaar voor gebruik. Alleen oplossingen die helder of licht opalescent, kleurloos en praktisch vrij van zichtbare deeltjes zijn mogen geïnjecteerd worden.
NeoRecormon in voorgevulde spuit is een steriel, ongeconserveerd product. Onder geen enkel beding mag meer dan één dosis per spuit worden toegediend; dit geneesmiddel is voor eenmalig gebruik.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
Slecht onder controle te houden hypertensie.
Voor de indicatie “het vermeerderen van de opbrengst van autoloog bloed”: myocardinfarct of een beroerte in de maand voorafgaand aan de behandeling, onstabiele angina pectoris, verhoogd risico op diepe veneuze trombose zoals bij een voorgeschiedenis van veneuze trombo-embolische aandoeningen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Op grond van resultaten uit klinische studies met 1.725 patiënten wordt verwacht dat ongeveer 8% van de met NeoRecormon behandelde patiënten bijwerkingen ervaren.
Anemische patiënten met chronisch nierfalen
De bijwerking, die het meest beschreven wordt gedurende de behandeling met NeoRecormon, is een verhoging van de bloeddruk of het verergeren van de bestaande hypertensie, met name bij patiënten met een snelle toename van de hematocriet (zie rubriek 4.4). Bij individuele patiënten die anders een normale of lage bloeddruk hebben, kan ook een hypertensieve crisis met symptomen die passen bij een encefalopathie (hoofdpijn, verwardheid, sensomotorische afwijkingen – zoals spraakstoornis, gestoorde gang enz.- en tonisch/klonische convulsies) optreden (zie rubriek 4.4).
Shunttrombose kan optreden, met name bij patiënten die een neiging tot hypotensie hebben, of wiens arterioveneuze fistels tot complicaties (bijvoorbeeld stenose of aneurysma) leiden, zie rubriek 4.4. In de meeste gevallen wordt een daling in serumijzerspiegels tegelijk met een stijging in hematocriet waargenomen (zie rubriek 4.4). Aanvullend zijn in enkele gevallen tijdelijke stijgingen in serum kalium en fosfaatspiegels waargenomen (zie rubriek 4.4).
In enkele gevallen is door neutraliserende anti-erytropoëtine antilichamen gemedieerde aplastische anemie (PRCA) gerelateerd aan de behandeling met NeoRecormon waargenomen. Wanneer PRCA veroorzaakt door neutraliserende anti-erytropoëtine antilichamen is gediagnosticeerd, moet de behandeling met NeoRecormon worden onderbroken en mogen de patiënten niet behandeld worden met een ander erytropoëtine eiwit (zie rubriek 4.4).
Bijwerkingen zijn weergegeven in tabel 1 hieronder.
Kankerpatiënten
Epoëtine bèta behandelingsgerelateerde hoofdpijn en hypertensie die behandeld kunnen worden met medicijnen komen vaak voor (zie rubriek 4.4).
Bij sommige patiënten is een daling in serumijzerparameters waargenomen (zie rubriek 4.4).
Klinische studies lieten een hogere frequentie van trombo-embolische voorvallen zien bij kankerpatiënten die werden behandeld met NeoRecormon, vergeleken met onbehandelde patiënten of met placebo behandelde patiënten. Bij patiënten die met NeoRecormon werden behandeld, komen deze verschijnselen voor in 7% vergeleken met 4% in de controlegroep; dit is niet gerelateerd aan enige stijging in trombo-embolische mortaliteit vergeleken met de controlegroep.
Bijwerkingen zijn weergegeven in tabel 2 hieronder.
Patiënten in een predonatieprogramma met autoloog bloed
Bij patiënten in een predonatieprogramma met autoloog bloed is een enigszins hogere frequentie in trombo-embolische voorvallen waargenomen. Toch kan geen causaal verband met NeoRecormon worden vastgesteld.
In placebogecontroleerde studies werd tijdelijk ijzertekort duidelijker waargenomen bij patiënten die werden behandeld met NeoRecormon dan bij de controlegroep (zie rubriek 4.4).
Bijwerkingen zijn weergegeven in tabel 3 hieronder.
Er zijn ernstige bijwerkingen van de huid zoals stevens-johnsonsyndroom (SJS) en toxische epidermale necrolyse (TEN), die levensbedreigend of fataal kunnen zijn, gemeld in verband met epoëtinebehandeling (zie rubriek 4.4).
Lijst van bijwerkingen in tabelvorm
De bijwerkingen zijn opgesomd volgens MedDRA systeem/orgaanklassen en frequentiecategorie. De frequentiecategorieën zijn gedefinieerd naar aanleiding van de volgende conventie: zeer vaak (1/10); vaak (1/100, <1/10); soms (1/1.000, <1/100); zelden (1/10.000, <1/1.000); zeer zelden (<1/10.000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 1: Bijwerkingen toe te schrijven aan behandeling met NeoRecormon in gecontroleerde klinische studies bij patiënten met chronisch nierfalen
Systeem/orgaanklasse | Bijwerking | Frequentie |
Bloedvataandoeningen | Hypertensie | Vaak |
| Hypertensieve crisis | Soms |
Zenuwstelselaandoeningen | Hoofdpijn | Vaak |
Bloed- en lymfestelselaandoeningen | Shunttrombose | Zelden |
Tabel 2: Bijwerkingen toe te schrijven aan behandeling met NeoRecormon in gecontroleerde klinische studies bij patiënten met kanker
Systeem/orgaanklasse | Bijwerking | Frequentie |
Bloedvataandoeningen | Hypertensie | Vaak |
Bloed- en lymfestelselaandoeningen | Trombo-embolische verschijnselen | Vaak |
Zenuwstelselaandoeningen | Hoofdpijn | Vaak |
Tabel 3: Bijwerkingen toe te schrijven aan behandeling met NeoRecormon in gecontroleerde klinische studies bij patiënten in een predonatieprogramma met autoloog bloed
Systeem/orgaanklasse | Bijwerking | Frequentie |
Zenuwstelselaandoeningen | Hoofdpijn | Vaak |
Prematuren
Een daling van de serumijzerwaarden komt vaak voor (zie rubriek 4.4)
Beschrijving van geselecteerde bijwerkingen
Zelden, kunnen epoëtine bèta behandelingsgerelateerde huidreacties zoals huiduitslag, jeuk, urticaria of reacties op de injectieplaats optreden. Zeer zelden, zijn epoëtine bèta behandelingsgerelateerde anafylactoïde reacties waargenomen. In gecontroleerde klinische studies is echter geen verhoogde incidentie van overgevoeligheidsreacties waargenomen.
Zeer zelden, vooral bij het begin van de behandeling, zijn epoëtine bèta behandelingsgerelateerde griepachtige symptomen, zoals koorts, koude rillingen, hoofdpijnen, pijn in de ledematen, malaise en/of botpijn, gemeld. Deze reacties waren licht of matig ernstig van aard en verdwenen na enige uren of dagen.
Gegevens uit gecontroleerd klinisch onderzoek met epoëtine alfa of darbepoëtine alfa wezen uit dat de incidentie voor beroerte vaak was.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden (zie hieronder voor details).
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Duitsland
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/97/031/025 – 026
EU/1/97/031/029 – 030
EU/1/97/031/031 – 032
EU/1/97/031/033 – 034
EU/1/97/031/035 – 036
EU/1/97/031/037 – 038
EU/1/97/031/041 – 042
EU/1/97/031/043 – 044
EU/1/97/031/045 – 046
10. DATUM VAN HERZIENING VAN DE TEKST
1 mei 2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 1478130 | NEORECORMON 500 UI VOORGEV. SPUIT 6 | B03XA01 | - | € 23,49 | Ja | - | - |
| 1478189 | NEORECORMON 10000 UI VOORGEV. SPUIT 6 | B03XA01 | - | € 448,53 | Ja | - | - |
| 1522408 | NEORECORMON 4000 UI VOORGEV. SPUIT 6 | B03XA01 | - | € 179,41 | Ja | - | - |
| 2084390 | NEORECORMON 30000 UI VOORGEV. SPUIT 4 | B03XA01 | - | € 897,06 | Ja | - | - |