NOTICE
Que contient cette notice ?
- 1. NOM DU MÉDICAMENT VÉTÉRINAIRE
- 2. COMPOSITION
- 3. ESPÈCES CIBLES
- 4. INDICATIONS D’UTILISATION
- 5. CONTRE-INDICATIONS
- 6. MISES EN GARDE PARTICULIÈRES
- 7. EFFETS INDÉSIRABLES
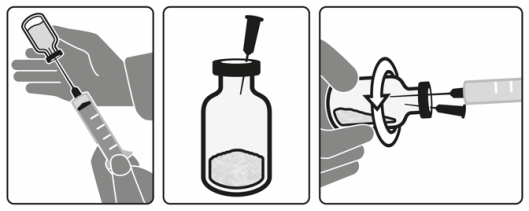
- 8. POSOLOGIE POUR CHAQUE ESPÈCE, VOIES ET MODE D’ADMINISTRATION
- 9. INDICATIONS NÉCESSAIRES À UNE ADMINISTRATION CORRECTE
- 10. TEMPS D’ATTENTE
- 11. PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION
- 12. PRÉCAUTIONS PARTICULIÈRES D’ÉLIMINATION
- 13. CLASSIFICATION DES MÉDICAMENTS VÉTÉRINAIRES
- 14. NUMÉROS D’AUTORISATION DE MISE SUR LE MARCHÉ ET PRÉSENTATIONS
- 15. DATE À LAQUELLE LA NOTICE A ÉTÉ RÉVISÉE POUR LA DERNIÈRE FOIS
- 16. COORDONNÉES
- 17. AUTRES INFORMATIONS