PACKUNGSBEILAGE
GEBRAUCHSINFORMATION
Ficoxil 227 mg Kautabletten für Hunde
Was in dieser Packungsbeilage steht
- 1. NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH, DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST
- 2. BEZEICHNUNG DES TIERARZNEIMITTELS
- 3. WIRKSTOFF UND SONSTIGE BESTANDTEILE
- 4. ANWENDUNGSGEBIETE
- 5. GEGENANZEIGEN
- 6. NEBENWIRKUNGEN
- 7. ZIELTIERART
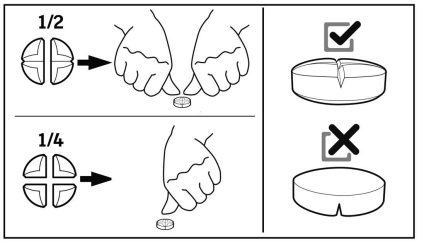
- 8. DOSIERUNG FÜR JEDE TIERART, ART UND DAUER DER ANWENDUNG
- 9. HINWEISE FÜR DIE RICHTIGE ANWENDUNG
- 10. WARTEZEIT
- 11. BESONDERE LAGERUNGSHINWEISE
- 12. BESONDERE WARNHINWEISE
- 13. BESONDERE VORSICHTSMASSNAHMEN FÜR DIE ENTSORGUNG VON NICHT VERWENDETEM ARZNEIMITTEL ODER VON ABFALLMATERIALIEN, SOFERN ERFORDERLICH
- 14. GENEHMIGUNGSDATUM DER PACKUNGSBEILAGE
- 15. WEITERE ANGABEN