- Aperçu notices
- Notice
Notice : Information du patient
Luxturna® 5 × 1012 génomes de vecteur/mL solution à diluer et solvant pour solution injectable
voretigene neparvovec
![]() Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de rubrique 4 comment déclarer les effets indésirables.
Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de rubrique 4 comment déclarer les effets indésirables.
Veuillez lire attentivement cette notice avant que ce médicament ne vous soit administré car elle contient des informations importantes pour vous.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
- Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Que contient cette notice ?
- 1. QU’EST-CE QUE LUXTURNA ET DANS QUELS CAS EST-IL UTILISÉ
- 2. QUELLES SONT LES INFORMATIONS À CONNAÎTRE AVANT QUE LUXTURNA NE VOUS SOIT ADMINISTRÉ
- 3. COMMENT LUXTURNA VOUS EST-IL ADMINISTRÉ
- 4. QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS?
- 5. COMMENT LUXTURNA EST-IL CONSERVÉ
- 6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
1. QU’EST-CE QUE LUXTURNA ET DANS QUELS CAS EST-IL UTILISÉ
Luxturna est un produit de thérapie génique qui contient la substance active voretigene neparvovec.
Luxturna est utilisé pour le traitement des adultes et des enfants présentant une perte visuelle due à une dystrophie rétinienne héréditaire résultant de mutations bi-alléliques confirmées du gène RPE65. Ces mutations empêchent l’organisme de produire une protéine nécessaire à la vision et conduisent donc à une perte visuelle et une éventuelle cécité totale.
La substance active de Luxturna, le voretigene neparvovec, est un virus modifié qui contient une copie fonctionnelle du gène RPE65. Après injection, cela libère ce gène dans les cellules de la rétine, la couche de cellules à l’arrière de l’œil qui détecte la lumière. Cela permet à la rétine de produire la protéine nécessaire à la vision. Le virus utilisé pour délivrer le gène n’entraine pas de maladie chez les humains.
Luxturna ne vous sera administré que si les tests génétiques montrent que votre perte visuelle est causée par des mutations du gène RPE65.
2. QUELLES SONT LES INFORMATIONS À CONNAÎTRE AVANT QUE LUXTURNA NE VOUS SOIT ADMINISTRÉ
Luxturna ne vous sera jamais administré
- si vous êtes allergique au voretigene neparvovec ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
- si vous présentez une infection oculaire
- si vous présentez une inflammation oculaire
Si vous êtes dans l’une des situations ci-dessus ou en cas de doute, parlez-en avec votre médecin avant de recevoir Luxturna.
Avertissements et précautions
Avant de recevoir le traitement par Luxturna :
- Informez votre médecin si vous présentez des signes d’infection ou d’inflammation oculaire, par exemple en cas de rougeur oculaire, de sensibilité à la lumière, de gonflement oculaire, ou de douleur oculaire.
- Informez votre médecin si vous présentez une infection active quelle qu’elle soit. Votre médecin peut retarder votre traitement jusqu’à la guérison de votre infection car ce médicament peut rendre plus difficile la lutte contre les infections. Voir aussi rubrique 3.
Après avoir reçu Luxturna :
- Consultez immédiatement votre médecin afin de recevoir des soins si l’un de vos yeux ou les deux deviennent rouges, douloureux, sensibles à la lumière, si vous voyez des flashs ou des corps flottants, si vous constatez une détérioration de votre vision ou si votre vision est trouble.
- Évitez les voyages en avion ou autres voyages à altitude élevée tant que votre médecin ne vous y a pas autorisé(e). Pendant le traitement par ce médicament, le médecin insère une bulle d'air dans l’œil, qui est lentement absorbée par l’organisme. Tant que la bulle n'a pas été entièrement absorbée, le voyage en avion ou un autre voyage à altitude élevée peut entraîner une expansion de la bulle et conduire à des lésions oculaires, y compris une perte visuelle. Avant de voyager, parlez-en avec votre médecin.
- Vous ne devez pas vous baigner en raison d'un risque accru d’infection oculaire. Avant de vous baigner après avoir reçu Luxturna, parlez-en avec votre médecin.
- Vous devrez éviter l’activité physique intense en raison d'un risque accru de lésion oculaire. Avant de pratiquer une activité physique intense après avoir reçu Luxturna, parlez-en avec votre médecin.
- Vous pourrez présenter des troubles visuels temporaires, comme une sensibilité à la lumière et une vision trouble. Informez votre médecin de tout trouble visuel que vous pourriez présenter. Votre médecin pourra peut-être vous aider à réduire la gêne occasionnée par ces troubles temporaires.
- La substance active de Luxturna peut être excrétée temporairement dans vos larmes. Vous et le personnel qui vous soigne devez placer tous les pansements usagés et les déchets souillés par des larmes et des sécrétions nasales dans des poches scellées avant de les éliminer. Ces précautions doivent être suivies pendant 14 jours.
- Il est possible que vous ne puissiez pas donner votre sang, vos organes, tissus, et cellules pour transplantation après avoir été traité par Luxturna.
Enfants et adolescents
Luxturna n’a pas été étudié chez des enfants âgés de moins de 4 ans. Les données sont limitées.
Autres médicaments et Luxturna
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou infirmier/ère avant d’être traitée par Luxturna.
Les effets de ce médicament sur la grossesse et l’enfant à naître ne sont pas connus. Par précaution, Luxturna ne doit pas vous être injecté pendant votre grossesse.
Luxturna n'a pas été étudié chez les femmes qui allaitent. Son passage dans le lait maternel n’est pas connu. Informez votre médecin si vous allaitez ou si vous prévoyez de le faire. Votre médecin vous aidera à décider si vous devez arrêter d’allaiter ou ne pas recevoir Luxturna, en prenant en compte le bénéfice de l’allaitement pour votre bébé et le bénéfice de Luxturna pour vous.
Conduite de véhicules et utilisation de machines
Vous pouvez présenter des troubles visuels temporaires après l'administration de Luxturna. Ne conduisez pas et n’utilisez pas de machines lourdes tant que vous n’avez pas retrouvé le niveau de vision antérieur. Veuillez discuter avec votre médecin avant de reprendre ces activités.
Luxturna contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement « sans sodium ».
3. COMMENT LUXTURNA VOUS EST-IL ADMINISTRÉ
Luxturna vous sera administré au bloc opératoire par des chirurgiens expérimentés en chirurgie oculaire.
Luxturna est administré sous anesthésie. Votre médecin vous parlera de l’anesthésie et de la manière dont elle sera réalisée.
Votre médecin réalisera une intervention chirurgicale destinée à éliminer le gel transparent situé à l’intérieur de l’œil, et ensuite injectera Luxturna directement sous votre rétine, la fine couche de cellules sensibles à la lumière située à l’arrière de l’œil. Il en sera de même pour votre autre œil avec au moins 6 jours d’intervalle. Vous devrez rester en observation au moins quelques heures après chaque intervention pour surveiller votre récupération et les éventuels effets secondaires liés à la chirurgie ou à l’anesthésie.
Avant que le traitement par Luxturna soit initié, votre médecin pourra vous demander de prendre un médicament qui diminuera l’activité de votre système immunitaire (système de défense naturel de votre organisme) afin qu’il n’essaie pas de combattre Luxturna lors de son administration. Il est important de prendre ce médicament conformément aux instructions données. N’arrêtez pas de prendre le médicament sans consulter votre médecin au préalable.
Si vous avez reçu plus de Luxturna que vous n’auriez dû
Ce médicament vous étant administré par un médecin, il est improbable que vous en receviez trop. Si cela se produit, votre médecin traitera les symptômes de manière appropriée. Informez votre médecin ou infirmier/ère si vous présentez des troubles visuels.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Les effets indésirables suivants peuvent se produire avec Luxturna :
Fréquent (pouvant affecter jusqu'à 1 personne sur 10)
- Dépôts sous la rétine
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
- Atrophie choriorétinienne
Les effets indésirables suivants peuvent se produire avec la procédure d'injection :
Très fréquent (pouvant affecter plus d'une personne sur 10)
- Rougeur de l’œil
- Cataracte (opacification du cristallin)
- Augmentation de la pression dans l’œil
Fréquent (pouvant affecter jusqu'à 1 personne sur 10)
- Déchirure rétinienne
- Douleur de l’œil
- Gonflement de l’œil
- Décollement de la rétine
- Saignement au fond de l’œil
- Douleur ou augmentation de l’inconfort dans l’œil
- Vision centrale floue due à un trou au centre de la rétine
- Amincissement de la surface de l’œil (dellen)
- Irritation de l’œil
- Inflammation de l’œil
- Sensation de corps étranger dans l’œil
- Gêne dans l’œil
- Anomalies au fond de l’œil
- Nausée (avoir mal au cœur), vomissement, douleur abdominale (ventre), douleur à la lèvre
- Modification de l’activité électrique du cœur
- Maux de tête, étourdissement
- Éruption cutanée, gonflement du visage
- Anxiété
- Problèmes associés à la mise en place d’un tube respiratoire dans la trachée
- Lésion au niveau de la plaie chirurgicale
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
- Ombre ou tâche dans la substance gélatineuse à l’intérieur de l’œil (opacités vitréennes)
- Atrophie choriorétinienne
Les lésions des tissus de l’oeil peuvent être accompagnés de saignements, de gonflements et augmenter le risque d’infections. Il existe une réduction de la vision dans les jours suivant la chirurgie qui généralement s’améliore ; si votre vision ne se rétablit pas, parlez-en à votre médecin.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement (voir informations ci-dessous). En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet: www.guichet.lu/pharmacovigilance
5. COMMENT LUXTURNA EST-IL CONSERVÉ
Luxturna sera conservé par des professionnels de santé dans votre établissement de soins.
La solution à diluer et le solvant doivent être conservés et transportés sous forme congelée à ≤ ‑65 ºC. Une fois décongelé, le médicament ne doit pas être recongelé et doit être laissé à température ambiante (moins de 25 °C).
N’utilisez pas ce médicament après la date de péremption indiquée sur l'étiquette et la boîte après EXP.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient Luxturna
- La substance active est le voretigene neparvovec. Chaque mL de solution à diluer contient 5 × 1012 génomes de vecteur (vg). La solution à diluer (volume extractible de 0,5 mL dans un flacon unidose de 2 mL) doit être diluée dans un rapport 1/10 avant administration.
- Chaque dose de solution diluée contient 1,5 × 1011 génomes de vecteur de voretigene neparvovec dans un volume disponible de 0,3 mL.
- Les autres composants de la solution à diluer sont du chlorure de sodium (voir « Luxturna contient du sodium » en rubrique 2 de la notice), phosphate monosodique monohydraté (pour ajustement du pH), phosphate disodique dihydraté (pour ajustement du pH), du poloxamère 188 et de l’eau pour préparation injectable.
- Le solvant contient du chlorure de sodium (voir fin de la rubrique 2), phosphate monosodique monohydraté (pour ajustement du pH), phosphate disodique dihydraté (pour ajustement du pH), du poloxamère 188 et de l’eau pour préparation injectable.
Ce médicament contient des organismes génétiquement modifiés.
Comment se présente Luxturna et contenu de l’emballage extérieur
Luxturna est une solution à diluer transparente et incolore pour injection sous-rétinienne, fournie dans un flacon en plastique transparent. Le solvant est un liquide transparent et incolore fourni dans un flacon en plastique transparent.
Chaque poche d’aluminium inclut une boîte contenant 1 flacon de 0,5 mL de solution à diluer et 2 flacons de solvant (contenant chacun 1,7 mL).
Titulaire de l’Autorisation de mise sur le marché
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlande
Fabricant
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nuremberg
Allemagne
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’autorisation de mise sur le marché :
België/Belgique/Belgien
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Luxembourg/Luxemburg
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
La dernière date à laquelle cette notice a été révisée est 10/2025
Autres sources d’informations
Cette notice est disponible sous forme audio et en grand caractère imprimable sur le site internet : http://www.voretigeneneparvovec.support
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu/
------------------------------------------------------------------------------------------------------------------------
Les informations suivantes sont destinées exclusivement aux professionnels de la santé :
Précautions à prendre avant la manipulation ou l’administration du médicament
Ce médicament contient des organismes génétiquement modifiés. Un équipement de protection individuelle (avec blouse de laboratoire, lunettes de sécurité et gants) doit être porté pendant la préparation ou l’administration du voretigene neparvovec.
Il convient de surveiller la pression intra-oculaire avant et après l'administration du médicament et de la prendre en charge de manière appropriée.
Après l’administration, il doit être demandé aux patients de signaler immédiatement tout symptôme suggérant un décollement de rétine ou une endophtalmie afin de garantir une prise en charge appropriée.
Préparation avant l’administration
Chaque boîte contient 1 flacon de solution à diluer et 2 flacons de solvant à usage unique seulement.
Luxturna doit être inspecté visuellement avant l’administration. Si des particules, une turbidité ou une coloration sont visibles, le flacon unidose ne doit pas être utilisé.
La préparation de Luxturna doit être effectuée dans les 4 heures précédant le début de la procédure d'administration, dans des conditions aseptiques, conformément à la procédure recommandée suivante.
Décongeler un flacon unidose de solution à diluer et deux flacons de solvant à température ambiante. Une fois que les 3 flacons (1 flacon de solution à diluer et 2 flacons de solvant) sont décongelés, la dilution doit être initiée. Retourner délicatement les flacons cinq fois pour mélanger les contenus.
S'assurer visuellement de l'absence de particules ou d’une quelconque anomalie. Toutes anomalies ou présence de particules visibles doivent être signalées au titulaire de l’Autorisation de Mise sur le Marché et le produit ne doit pas être utilisé.
Transférer 2,7 mL de solvant extrait des deux flacons décongelés dans un flacon en verre vide stérile de 10 mL en utilisant une seringue de 3 mL.
Pour la dilution, prélever 0,3 mL de solution à diluer décongelée dans une seringue de 1 mL et les ajouter au flacon stérile de 10 mL contenant le solvant. Retourner délicatement le flacon au moins cinq fois pour bien mélanger. S'assurer visuellement de l'absence de particules. La solution diluée doit être transparente à légèrement opalescente. Étiqueter le flacon en verre de 10 mL contenant la solution diluée de la manière suivante: «Luxturna dilué».
Ne pas préparer les seringues si le flacon présente des dommages ou si des particules sont visibles. Préparer les seringues pour injection en prélevant 0,8 mL de la solution diluée dans une seringue stérile de 1 mL. Répéter la même procédure pour préparer une seringue de secours. Les seringues remplies de produit doivent ensuite être transférées au bloc opératoire dans un conteneur de transport désigné à cet effet.
Mesures à prendre en cas d’exposition accidentelle
Éviter toute exposition accidentelle. Les recommandations locales relatives à la sécurité biologique doivent être suivies pour la préparation, l’administration et la manipulation du voretigene neparvovec.
- Un équipement de protection individuelle (avec blouse de laboratoire, lunettes de sécurité et gants) doit être porté pendant la manipulation ou l’administration du voretigene neparvovec.
- L’exposition accidentelle au voretigene neparvovec, y compris le contact avec la peau, les yeux et les muqueuses, doit être évitée. Toute plaie exposée doit être recouverte avant manipulation.
- Toutes les éclaboussures de voretigene neparvovec doivent être traitées avec un agent virucide tel que l’hypochlorure de sodium à 1 % et sécher avec un matériau absorbant.
- Tout matériel susceptible d’être entré en contact avec voretigene neparvovec (par exemple, flacon, seringue, aiguille, gaze de coton, gants, masques ou pansements) doit être éliminé conformément aux recommandations locales relatives à la sécurité biologique.
Exposition accidentelle
- En cas d’exposition professionnelle accidentelle (par exemple, éclaboussures dans les yeux ou les muqueuses), rincer avec de l’eau claire pendant au moins 5 minutes.
- En cas d’exposition de peau lésée ou de blessure avec l’aiguille, nettoyer soigneusement la zone touchée avec du savon et de l’eau et/ou un désinfectant.
Précautions à prendre pour l’élimination du médicament
Ce médicament contient des organismes génétiquement modifiés. Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation locale en vigueur relative aux déchets pharmaceutiques.
Posologie
Le traitement doit être initié et administré par un chirurgien spécialiste de la rétine et expérimenté en chirurgie maculaire.
Les patients recevront une dose unique de 1,5 × 1011 génomes de vecteur de voretigene neparvovec dans chaque œil. Chaque dose sera délivrée dans l’espace sous-rétinien dans un volume total de 0,3 mL. L’administration individuelle dans chaque œil est réalisée lors de jours distincts sur un court intervalle, mais espacés d'au moins 6 jours.
Traitement immunomodulateur
Avant l’initiation du traitement immunomodulateur et avant l’administration de voretigene neparvovec, les symptômes d’une maladie infectieuse active de toute nature doivent être recherchés chez le patient., et en cas d’infection de ce type le début du traitement doit être repoussé jusqu’à la guérison du patient.
Il est recommandé d'initier un traitement immunomodulateur en suivant le calendrier ci-dessous (Tableau 1), en commençant 3 jours avant l’administration de voretigene neparvovec dans le premier œil. L’initiation du traitement immunomodulateur pour le second œil doit suivre le même calendrier et remplacer le traitement immunomodulateur du premier œil à la fin de celui-ci.
Tableau 1 Traitement immunomodulateur pré- et post-opératoire pour chaque oeil
Pré-opératoire | 3 jours avant l’administration de Luxturna | Prednisone (ou équivalent) 1 mg/kg/jour |
Post-opératoire | 4 jours | Prednisone (ou équivalent) 1 mg/kg/jour |
Suivi pendant 5 jours | Prednisone (ou équivalent) | |
Suivi pendant 5 jours d’une dose tous les deux jours | Prednisone (ou équivalent) |
Populations particulières
Population âgée
La sécurité et l’efficacité du voretigene neparvovec chez les patients âgés de 65 ans ou plus n’ont pas été établies. Les données sont limitées. Cependant, aucune adaptation de dose n’est nécessaire chez les patients âgés.
Insuffisance hépatique et rénale
La sécurité et l’efficacité du voretigene neparvovec n’ont pas été établies chez les patients atteints d’une insuffisance hépatique ou rénale. Aucune adaptation de dose n’est nécessaire chez ces patients (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité du voretigene neparvovec chez des enfants âgés de moins de 4 ans n’ont pas été établies. Les données sont limitées. Aucune adaptation de dose n’est nécessaire chez les enfants.
Mode d'administration
Administration sous-rétinienne.
Luxturna est une solution à diluer stérile pour injection sous-rétinienne, qui doit être décongelée et diluée avant administration.
Ce médicament ne doit pas être administré par injection intravitréenne.
Luxturna est contenu dans un flacon à usage unique pour administration unique dans un seul œil. Le produit est administré sous la forme d’une injection sous-rétinienne après vitrectomie dans chaque œil. Il ne doit pas être administré dans le voisinage immédiat de la fovéa, afin de préserver l’intégrité fovéale.
Le voretigene neparvovec doit être administré au bloc opératoire, en conditions aseptiques contrôlées. Une anesthésie adéquate doit être administrée au patient avant l’intervention. La pupille de l’œil devant recevoir l’injection doit être dilatée et une prise en charge du risque infectieux doit être définie avant la chirurgie, conformément à la pratique médicale de référence.
Administration
Veuillez suivre les étapes ci-dessous pour administrer voretigene neparvovec aux patients :
- Inspecter visuellement la solution diluée de Luxturna avant administration. Si des particules, une turbidité ou une coloration sont visibles, le médicament ne doit pas être utilisé.
- Raccorder la seringue contenant le produit dilué à la tubulure d’extension et à la canule d'injection sous-rétinienne. Expulser le produit lentement par la tubulure d’extension et la canule d’injection sous-rétinienne afin d'éliminer toute bulle d’air du système.
- Vérifier le volume de produit disponible pour l’injection dans la seringue, en alignant l’extrémité du piston avec la ligne 0,3 mL.
- Une fois la vitrectomie terminée, Luxturna est administré par injection sous-rétinienne en utilisant une canule d'injection sous-rétinienne introduite via la pars plana.
- Sous visualisation directe, placer l’extrémité de la canule d’injection sous-rétinienne en contact avec la surface de la rétine. Le site d’injection recommandé doit être situé le long de l'arc vasculaire supérieur, à au moins 2 mm en position distale par rapport au centre de la fovéa. Injecter une petite quantité de produit avec précaution jusqu’à ce qu’une bulle sous-rétinienne initiale soit observée, puis injecter lentement le volume restant jusqu’à ce que la totalité des 0,3 mL ait été délivrée (Figure 1).
Figure 1 Extrémité de la canule d'injection sous-rétinienne placée dans le site recommandé d'injection (vue du chirurgien)
![]()
![]()
![]()
![]()
![]()
![]()
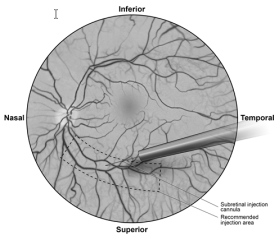
- À la fin de l’injection, retirer la canule d'injection sous-rétinienne de l’œil.
- Après l’injection, jeter tout produit inutilisé. Ne pas conserver la seringue de secours.
- Effectuer un échange liquide-air, en veillant à éviter le drainage de liquide près de la rétinotomie créée pour l’injection sous-rétinienne.
- Placer la tête en décubitus dorsal, immédiatement après l’intervention. Cette position doit être maintenue par le patient pendant 24 heures.
PRIX
| Code CNK | Emballage | Prix | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|
| 3916798 | LUXTURNA 5X10 12 SOL+SOLV POUR SOL INJ FL INJ 1+2 | - | Oui | - | - |