- Aperçu notices
- Notice
Notice: Information du patient
Beovu® 120 mg/ml solution injectable en seringue préremplie
brolucizumab
Veuillez lire attentivement cette notice avant que ce médicament ne vous soit administré car elle contient des informations importantes pour vous.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Si vous avez d’autres questions, interrogez votre médecin.
- Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Que contient cette notice ?
- 1. QU’EST-CE QUE BEOVU ET DANS QUELS CAS EST-IL UTILISÉ
- 2. QUELLES SONT LES INFORMATIONS À CONNAÎTRE AVANT QUE BEOVU NE VOUS SOIT ADMINISTRÉ
- 3. COMMENT BEOVU EST-IL ADMINISTRÉ
- 4. QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS ?
- 5. COMMENT CONSERVER BEOVU
- 6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
1. QU’EST-CE QUE BEOVU ET DANS QUELS CAS EST-IL UTILISÉ
Qu’est-ce que Beovu
Beovu contient une substance active appelée brolucizumab, qui appartient à un groupe de médicaments appelés médicaments contre la néovascularisation. Beovu est injecté dans votre œil par votre médecin pour traiter des pathologies oculaires pouvant impacter votre vision.

Dans quels cas Beovu est-il utilisé
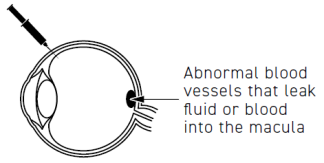
Beovu est utilisé chez les adultes pour traiter des pathologies oculaires, qui apparaissent lorsque des vaisseaux sanguins anormaux se forment et se développent sous la macula. La macula, qui est dans la partie arrière de l’œil, permet une vision fine. Ces vaisseaux sanguins anormaux peuvent entrainer une fuite de liquide ou de sang dans l’œil et interférer avec la fonction de la macula et conduire à des maladies pouvant entraîner une diminution de la vision, telles que :
- la dégénérescence maculaire liée à l’âge (DMLA) néovasculaire (humide)
- l’œdème maculaire diabétique (OMD)
Quel est le mécanisme d’action de Beovu
Beovu peut ralentir la progression de la maladie et ainsi maintenir, voire améliorer votre vision.
2. QUELLES SONT LES INFORMATIONS À CONNAÎTRE AVANT QUE BEOVU NE VOUS SOIT ADMINISTRÉ
Beovu ne doit pas vous être administré :
- si vous êtes allergique au brolucizumab ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
- si vous avez une infection active ou suspectée dans ou autour de l'œil.
- si vous présentez des douleurs ou une rougeur de l'œil (inflammation oculaire).
Si l’une de ces situations vous concerne, parlez-en à votre médecin. Beovu ne doit pas vous être administré.
Avertissements et précautions
Adressez-vous à votre médecin avant que Beovu ne vous soit administré si l’une de ces situations vous concerne :
- si vous présentez un glaucome (une pathologie oculaire généralement causée par une pression élevée dans l’œil).
- si vous avez des antécédents de visions de flashs lumineux ou de corps flottants, et si vous voyez soudainement des corps flottants en plus grand nombre ou de plus grosse taille.
- si une opération chirurgicale a été ou doit être pratiquée sur votre œil dans les 4 semaines précédentes ou à venir.
- si vous avez déjà eu une maladie oculaire ou un traitement ophtalmique.
- si vous avez des antécédents de perte de vision soudaine due à une obstruction des vaisseaux sanguins à l’arrière de l’œil (occlusion vasculaire rétinienne) ou à une inflammation des vaisseaux sanguins à l’arrière de l’œil (vascularite rétinienne) au cours de l’année précédente.
Adressez-vous immédiatement à votre médecin si vous :
- développez une rougeur de l’œil, une douleur dans l’œil, une gêne accrue, une rougeur de l’œil s’aggravant, une vision diminuée ou floue, un nombre augmenté de petites taches dans votre champ visuel, une sensibilité accrue à la lumière.
- avez soudainement une perte de la vision, qui pourrait être le signe d’une occlusion vasculaire rétinienne.
Tout symptôme mentionné ci-dessus peut amener votre médecin à interrompre votre traitement par Beovu.
De plus, il est important pour vous de savoir que :
- la sécurité et l’efficacité de Beovu, lorsqu’il est administré dans les deux yeux en même temps, n’ont pas été étudiées et une telle utilisation peut entraîner une augmentation du risque d’effets indésirables.
- des injections de Beovu peuvent causer une augmentation de la pression de l’œil (pression intraoculaire) chez certains patients dans les 30 minutes suivant l’injection. Votre médecin surveillera cela après chaque injection.
- votre médecin vérifiera si vous présentez d’autres facteurs de risque qui peuvent augmenter le risque de déchirure ou de décollement de l’une des couches situées à l’arrière de l’œil (décollement ou déchirure de la rétine, et décollement ou déchirure de l’épithélium pigmentaire rétinien). Dans ce cas, Beovu devra être administré avec précaution.
L’utilisation systémique d’inhibiteurs du VEGF, substances similaires à celles contenues dans Beovu, est potentiellement associée à un risque de formation de caillots sanguins dans les vaisseaux sanguins (événements artériels thromboemboliques), qui peuvent entrainer une crise cardiaque ou un accident vasculaire cérébral. Il existe un risque théorique de survenue de ces événements après injection de Beovu dans l'œil.
Enfants et adolescents
Beovu n’est pas utilisé chez les enfants et les adolescents de moins de 18 ans.
Autres médicaments et Beovu
Informez votre médecin si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant que ce médicament vous soit administré.
L'allaitement n’est pas recommandé durant le traitement par Beovu et jusqu’à un mois après l’arrêt de traitement par Beovu, car on ne sait pas si Beovu passe dans le lait maternel.
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement et jusqu'à un mois après l’arrêt de traitement par Beovu. Si vous tombez enceinte ou pensez être enceinte durant le traitement, parlez-en immédiatement à votre médecin. Beovu ne doit pas être utilisé pendant la grossesse à moins que le bénéfice potentiel ne l’emporte sur le risque potentiel pour l’enfant à naître.
Conduite de véhicules et utilisation de machines
Après l’injection de Beovu, il est possible que vous présentiez des troubles temporaires de la vision (par exemple une vision floue). Ne conduisez pas et n’utilisez pas de machines tant que vos troubles visuels persistent.
Beovu contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
Beovu contient des polysorbates
Ce médicament contient 0,01 mg de polysorbate 80 par dose (0,05 ml). Les polysorbates peuvent provoquer des réactions allergiques. Informez votre médecin si vous avez déjà présenté une allergie.
3. COMMENT BEOVU EST-IL ADMINISTRÉ
A quelle dose et à quelle fréquence Beovu est-il administré
La dose recommandée est de 6 mg de brolucizumab.
DMLA néovasculaire (humide)
Initiation du traitement (aussi appelée phase d’induction du traitement)
- Soit, vous allez être traité avec une injection tous les mois pendant les 3 premiers mois.
- Soit, vous pourrez être traité avec une injection à 6 semaines d’intervalle pour les deux premières doses. Votre médecin déterminera si une troisième injection est nécessaire 12 semaines après le début du traitement en fonction de l’état de votre oeil ou de vos yeux.
Traitement d’entretien
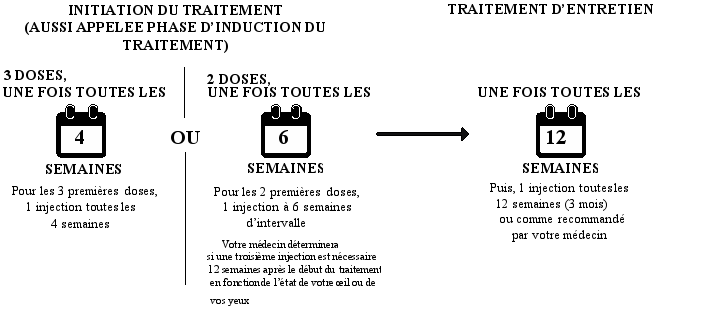 Après cela, vous pouvez recevoir une injection tous les 3 mois. Votre médecin déterminera votre intervalle de traitement selon l’état de votre œil ; certains patients auront besoin d’être traités tous les 2 mois. En fonction de l'état de votre œil, votre médecin peut étendre ou réduire l’intervalle de votre traitement de 1 mois maximum à la fois. Il existe des données limitées sur les intervalles de traitement supérieurs à 5 mois. L’intervalle de traitement entre deux doses de Beovu ne devra pas être de moins de 2 mois.
Après cela, vous pouvez recevoir une injection tous les 3 mois. Votre médecin déterminera votre intervalle de traitement selon l’état de votre œil ; certains patients auront besoin d’être traités tous les 2 mois. En fonction de l'état de votre œil, votre médecin peut étendre ou réduire l’intervalle de votre traitement de 1 mois maximum à la fois. Il existe des données limitées sur les intervalles de traitement supérieurs à 5 mois. L’intervalle de traitement entre deux doses de Beovu ne devra pas être de moins de 2 mois.
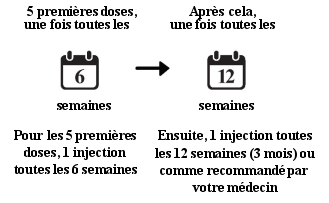
OMD
- Vous allez être traité avec une injection toutes les 6 semaines pour les 5 premières injections.
- Après cela, vous pouvez recevoir une injection tous les 3 mois. Votre médecin ajustera l’intervalle de traitement selon l’état de votre œil. Certains patients pourront avoir besoin d’être traités tous les 2 mois. Certains patients pourront recevoir le traitement tous les 4 mois.
Mode d’administration
Beovu est administré par injection dans votre œil (utilisation intravitréenne) par un ophtalmologiste.
Avant l'injection, votre médecin lavera votre œil soigneusement afin d'éviter une infection. Votre médecin vous administrera également un collyre (anesthésique local) afin d’anesthésier l’œil et de limiter ou d'éviter la douleur liée à l'injection.
Combien de temps dure le traitement par Beovu
Beovu est utilisé pour traiter des maladies oculaires chroniques qui nécessitent un traitement à long terme, qui pourra durer plusieurs mois ou années. Votre médecin vérifiera que le traitement fonctionne pendant vos visites planifiées régulièrement. Votre médecin pourra aussi contrôler vos yeux entre les injections. Si vous avez des questions concernant la durée de votre traitement par Beovu, parlez-en à votre médecin.
Avant d’arrêter le traitement par Beovu
Parlez avec votre médecin avant d’arrêter votre traitement. L’arrêt du traitement peut augmenter le risque de perdre ou de diminuer votre vision.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin.
4. QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde. Les effets indésirables avec l’injection de Beovu sont soit dus au médicament lui-même ou à la procédure d’injection et ils touchent principalement l’œil.
Certains effets indésirables peuvent être graves
Consultez immédiatement votre médecin si vous présentez l’un des effets indésirables suivants, car ils sont le signe de réactions allergiques, d’inflammations ou d’infections :
- une diminution soudaine ou un changement de votre vision
- une douleur, une sensation d’inconfort augmentée, une rougeur de l’œil aggravée
Si vous présentez un effet indésirable grave, parlez-en immédiatement à votre médecin.
Autres effets indésirables possibles
Les autres effets indésirables pouvant survenir après un traitement par Beovu sont décrits ci-dessous.
La majorité des effets indésirables sont d’intensité légère à modérée et disparaissent généralement dans la semaine suivant l’injection.
Si ces effets indésirables s’aggravent, parlez-en à votre médecin.
Fréquents : pouvant toucher jusqu’à 1 personne sur 10
- inflammation de la couche intermédiaire de la structure de l’œil (uvéite)
- décollement entre la substance gélatineuse à l’intérieur de l’œil et la rétine (décollement du vitré)
- déchirure de la rétine (la partie située à l’arrière de l’œil qui détecte la lumière) ou de l’une de ses couches (déchirure de l’épithélium pigmentaire rétinien)
- réduction de la netteté de la vision (acuité visuelle diminuée)
- saignement dans la rétine (hémorragie rétinienne)
- inflammation de l’iris, la partie colorée de l’œil (iritis)
- inflammation dans l’iris et son tissu adjacent dans l’œil (iridocyclite)
- perte soudaine de vision suite à l’obstruction des vaisseaux sanguins situés à l’arrière de l’œil (occlusion vasculaire rétinienne)
- saignement dans l’œil (hémorragie vitréenne)
- opacification du cristallin de l’œil (cataracte)
- saignement de petits vaisseaux sanguins situés dans la couche extérieure de l’œil (hémorragie conjonctivale)
- petites particules ou taches dans le champ visuel (corps flottants vitréens)
- douleur oculaire
- augmentation de la pression à l’intérieur de l’œil (augmentation de la pression intraoculaire)
- rougeur dans la partie blanche de l’œil (conjonctivite)
- vision floue ou trouble
- lésion de la cornée, la couche transparente du globe oculaire qui recouvre l’iris (abrasion de la cornée)
- atteinte de la couche transparente du globe oculaire qui recouvre l’iris (kératite ponctuée)
- réactions allergiques (hypersensibilité)
Peu fréquents : pouvant toucher jusqu’à 1 personne sur 100
- inflammation sévère à l’intérieur de l’œil (endophtalmie)
- cécité
- perte soudaine de la vision suite au blocage d’une artère dans l’œil (occlusion artérielle rétinienne)
- décollement de la rétine
- rougeur de l’œil (hyperhémie conjonctivale)
- augmentation de la production de larmes (larmoiement augmenté)
- sensation anormale dans l’œil
- décollement de l’une des couches de la rétine (décollement de l’épithélium pigmentaire rétinien)
- inflammation de la substance gélatineuse à l’intérieur de l’œil (inflammation du vitré)
- inflammation du devant de l’œil (inflammation ou effet Tyndall dans la chambre antérieure)
- gonflement de la cornée, la couche transparente du globe oculaire (œdème de la cornée)
- inflammation des vaisseaux sanguins à l’arrière de l’œil (vascularite rétinienne)
- inflammation de la couche blanche externe de l’œil (sclérite)
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement (voir informations ci-dessous). En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet: www.guichet.lu/pharmacovigilance
5. COMMENT CONSERVER BEOVU
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et l’étiquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre 2°C et 8°C).
Ne pas congeler.
Conserver la seringue préremplie dans son emballage fermé dans la boîte d’origine à l’abri de la lumière.
Avant l’utilisation, l’emballage non ouvert contenant la seringue préremplie pourra être conservé à température ambiante (en dessous de 25°C) pendant une durée maximale de 24 heures.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient Beovu
- La substance active est brolucizumab. Un ml de solution injectable contient 120 mg de brolucizumab. Chaque seringue préremplie contient 19,8 mg de brolucizumab dans 0,165 ml de solution. Cette quantité est suffisante pour permettre de délivrer une dose unique de 0,05 ml de solution contenant 6 mg de brolucizumab.
- Les autres composants sont : citrate de sodium, sucrose, polysorbate 80, hydroxyde de sodium (pour ajustement du pH), eau pour préparations injectables (voir rubrique 2).
Comment se présente Beovu et contenu de l’emballage extérieur
Beovu 120 mg/ml solution injectable en seringue préremplie (injection) est une solution aqueuse, limpide à légèrement opalescente, incolore à légèrement jaune-brun.
Boîte de 1 seringue préremplie à usage unique seulement.
Titulaire de l’Autorisation de mise sur le marché
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlande
Fabricant
Novartis Manufacturing NV
Rijksweg 14
2870 Puurs-Sint-Amands
Belgique
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nuremberg
Allemagne
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’autorisation de mise sur le marché :
België/Belgique/Belgien
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Luxembourg/Luxemburg
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
La dernière date à laquelle cette notice a été révisée est 01/2026
Autres sources d’information
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu/
Les informations suivantes sont destinées exclusivement aux professionnels de la santé :
Instructions d’utilisation de la seringue préremplie
Conservation et inspection
| Conserver Beovu au réfrigérateur (2°C à 8°C). Ne pas congeler. Conserver la seringue préremplie dans son emballage fermé dans la boîte d’origine à l’abri de la lumière. |
| Avant l’utilisation, l’emballage non ouvert contenant la seringue préremplie de Beovu peut être conservé à température ambiante (en dessous de 25°C) pendant une durée maximale de 24 heures. Vérifier que le conditionnement contient une seringue préremplie stérile dans un emballage scellé. Après ouverture du blister, procéder sous conditions aseptiques. |
| Beovu est une solution aqueuse, limpide à légèrement opalescente, et incolore à légèrement jaune-brun. |
| La solution doit être inspectée visuellement au moment de sa sortie du réfrigérateur et avant administration. Si des particules ou un trouble sont visibles, la seringue préremplie ne doit pas être utilisée et une procédure appropriée de remplacement doit être suivie. |
Comment préparer et administrer Beovu
La seringue préremplie contient une dose de produit supérieure à la dose recommandée de 6 mg. La totalité du volume extractible de la seringue préremplie (0,165 ml) ne doit pas être utilisée. Le volume excédentaire doit être éliminé avant l’injection. L’injection du volume total de la seringue préremplie peut entraîner un surdosage.
La procédure d'injection intravitréenne doit être réalisée en conditions d'asepsie, incluant la désinfection chirurgicale des mains, le port de gants stériles, l'utilisation d'un champ stérile et d'un spéculum à paupières stérile (ou équivalent) et l’équipement permettant d'effectuer une paracentèse stérile (si nécessaire).
Une anesthésie appropriée ainsi qu’un antibactérien local à large spectre pour désinfecter la peau autour de l'œil, la paupière et la surface oculaire doivent être administrés avant l'injection.
Pour l’injection intravitréenne, utiliser une aiguille d’injection stérile de 30G x ½″. L’aiguille d’injection n’est pas incluse dans la boîte de Beovu.
S’assurer que l’injection est réalisée immédiatement après préparation de la dose (étape 5).
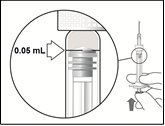
Note : La dose doit être ajustée à 0,05 ml.
![]()
![]()
![]()
![]()
![]()
![]()
Procédure d’injection
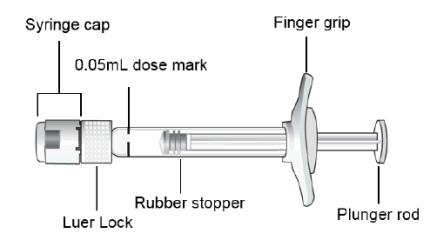
1. | Décoller le film protecteur de l’emballage contenant la seringue et, de manière aseptique, retirer la seringue. |
2. | Casser (ne pas tourner ou tordre) le capuchon de la seringue. |
3. | Fixer de manière aseptique et solidement une aiguille pour injection de 30G x ½″ sur la seringue. |
4. | Pour vérifier l’absence de bulles d’air, tenir la seringue en pointant l’aiguille vers le haut. Si des bulles d’air sont présentes, tapoter doucement la seringue avec votre doigt jusqu’à ce que les bulles remontent à la surface. |
5. | Tenir la seringue à la hauteur des yeux et pousser délicatement le piston jusqu’à aligner le plateau situé en dessous de la partie bombée de la butée en caoutchouc avec le trait de dose de 0,05 ml. Ceci permettra d’expulser l’air et l’excédent de solution et d’ajuster la dose au repère 0,05 ml. La seringue est prête pour l’injection. |
6. | Injecter lentement jusqu’à ce que la butée en caoutchouc touche le fond de la seringue et délivre un volume de 0,05 ml. Contrôler la délivrance de la dose entière en vérifiant que la butée en caoutchouc a bien atteint le fond du cylindre de la seringue. |
Note : Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Questions fréquemment posées et réponses
Question : Que faire si je ne peux pas retirer toutes les bulles d’air du liquide ?
Réponse : Il est important que le liquide ne contienne pas d’air. Cependant, les minuscules bulles d’air collées au bouchon ne se détachent généralement pas du bouchon durant l’injection et, par conséquent, n’affectent pas la dose injectée.
PRIX
| Code CNK | Emballage | Prix | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|
| 4175592 | BEOVU 120MG/ML SOL INJ SERINGUE PREREMPLIE 1 | - | Oui | - | - |