NOTICE :
Prednicure 5 mg comprimés pour chiens et pour chats
Que contient cette notice ?
- 1. NOM ET ADRESSE DU TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ ET DU TITULAIRE DE L’AUTORISATION DE FABRICATION RESPONSABLE DE LA LIBÉRATION DES LOTS, SI DIFFÉRENT
- 2. DÉNOMINATION DU MÉDICAMENT VÉTÉRINAIRE
- 3. LISTE DE LA (DES) SUBSTANCE(S) ACTIVE(S) ET AUTRE(S) INGRÉDIENT(S)
- 4. INDICATION(S)
- 5. CONTRE-INDICATIONS
- 6. EFFETS INDÉSIRABLES
- 7. ESPÈCES CIBLES
- 8. POSOLOGIE POUR CHAQUE ESPÈCE, VOIE(S) ET MODE D’ADMINISTRATION
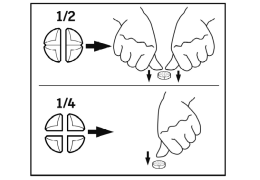
- 9. CONSEILS POUR UNE ADMINISTRATION CORRECTE
- 10. TEMPS D’ATTENTE
- 11. CONDITIONS PARTICULIÈRES DE CONSERVATION
- 12. MISE(S) EN GARDE PARTICULIÈRE(S)
- 13. PRÉCAUTIONS PARTICULIÈRES POUR L’ÉLIMINATION DES MÉDICAMENTS VÉTÉRINAIRES NON UTILISÉS OU DES DÉCHETS DÉRIVÉS DE CES MÉDICAMENTS, LE CAS ÉCHÉANT
- 14. DATE DE LA DERNIÈRE NOTICE APPROUVÉE
- 15. INFORMATIONS SUPPLÉMENTAIRES