- Aperçu notices
- Notice
Notice : Information du patient
Lucentis® 10 mg/ml solution injectable en seringue préremplie
ranibizumab
Veuillez lire attentivement cette notice avant que ce médicament ne vous soit administré car elle contient des informations importantes pour vous.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Si vous avez d’autres questions, interrogez votre médecin.
- Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Que contient cette notice ?
- 1. QU’EST CE QUE LUCENTIS ET DANS QUEL CAS EST-IL UTILISÉ
- 2. QUELLES SONT LES INFORMATIONS À CONNAÎTRE AVANT QUE LUCENTIS NE VOUS SOIT ADMINISTRÉ
- 3. COMMENT LUCENTIS EST ADMINISTRÉ
- 4. QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS?
- 5. COMMENT CONSERVER LUCENTIS
- 6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
1. QU’EST CE QUE LUCENTIS ET DANS QUEL CAS EST-IL UTILISÉ
Qu’est-ce que Lucentis
Lucentis est une solution qui est injectée dans l’œil. Lucentis appartient à un groupe de médicaments appelé médicaments contre la néovascularisation. Il contient un principe actif appelé ranibizumab.
Dans quels cas Lucentis est-il utilisé
Lucentis est utilisé chez les adultes pour traiter plusieurs pathologies de l’œil qui entraînent une diminution de la vision.
Ces maladies résultent de lésions de la rétine (couche située dans la partie arrière de l'œil sensible à la lumière) causées par :
- La croissance de vaisseaux sanguins anormaux, perméables. Ceci est observé dans des maladies telles que la dégénérescence maculaire liée à l'âge (DMLA) et la rétinopathie diabétique proliférante (RDP, une maladie causée par le diabète). Cela peut également être associé à une néovascularisation choroïdienne (NVC) secondaire à une myopie forte (MF), des stries angioïdes, une choriorétinopathie centrale séreuse ou une NVC inflammatoire.
- L’œdème maculaire (gonflement du centre de la rétine). Ce gonflement peut être provoqué par du diabète (une maladie appelée œdème maculaire diabétique (OMD)) ou par l’obstruction des veines de la rétine (une maladie appelée occlusion veineuse rétinienne (OVR)).
Quel est le mécanisme d’action de Lucentis
Lucentis reconnaît et se lie spécifiquement à une protéine appelée facteur de croissance de l’endothélium vasculaire humain de type A (VEGF-A) présente dans l’œil. En excès, le VEGF-A est responsable de la croissance de vaisseaux sanguins anormaux et d’un gonflement dans l’œil qui peuvent entraîner une diminution de la vision dans des maladies telles que la DMLA, l’OMD, la RDP, l’OVR, la MF et les NVC. En se liant au VEGF-A, Lucentis peut bloquer ses effets et prévenir cette croissance anormale et le gonflement.
Dans ces maladies, Lucentis peut aider à la stabilisation de votre vision et à son amélioration dans de nombreux cas.
2. QUELLES SONT LES INFORMATIONS À CONNAÎTRE AVANT QUE LUCENTIS NE VOUS SOIT ADMINISTRÉ
Lucentis ne doit pas vous être administré
- Si vous êtes allergique au ranibizumab ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
- Si vous avez une infection dans ou autour de l'œil.
- Si vous présentez des douleurs ou une rougeur (inflammation intraoculaire sévère) de l'œil.
Avertissements et précautions
Adressez-vous à votre médecin avant que Lucentis ne vous soit administré.
- Lucentis est administré sous forme d'une injection dans l'œil. Occasionnellement, une infection à l’intérieur de l'œil, des douleurs ou une rougeur (inflammation), un décollement ou une déchirure d’une des couches postérieures de l'œil (décollement ou déchirure de la rétine, décollement ou déchirure de l’épithélium pigmentaire rétinien) ou une opacification du cristallin (cataracte) peuvent se produire après le traitement par Lucentis. Il est important d'identifier et de traiter une telle infection ou le décollement de rétine le plus rapidement possible. Veuillez prévenir immédiatement votre médecin si vous développez des signes tels que des douleurs oculaires ou une gêne accrue, une rougeur de l’œil s’aggravant, une vision trouble ou diminuée, une augmentation du nombre de petites taches dans votre champ visuel ou une augmentation de la sensibilité à la lumière.
- Chez certains patients, il se peut que la pression à l’intérieur de l’oeil augmente pendant une courte durée immédiatement après l'injection. C'est quelque chose que vous pouvez ne pas remarquer et c'est pourquoi votre médecin pourra surveiller ce phénomène après chaque injection.
- Informez votre médecin si vous avez des antécédents de problèmes oculaires ou des traitements oculaires, ou si vous avez eu un accident vasculaire cérébral ou si vous avez souffert de signes passagers d’accident vasculaire cérébral (faiblesse ou paralysie des membres ou du visage, difficultés à parler ou à comprendre). Cette information permettra à votre médecin d’évaluer si le traitement par Lucentis est approprié dans votre cas.
Voir la rubrique 4 (“Quels sont les effets indésirables éventuels?”) pour une information plus détaillée sur les effets indésirables qui peuvent survenir au cours d’un traitement par Lucentis.
Enfants et adolescents (moins de 18 ans)
L'utilisation de Lucentis n'a pas été établie chez l'enfant et l'adolescent et elle n'est donc pas recommandée.
Autres médicaments et Lucentis
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Grossesse et allaitement
- Les femmes en âge de procréer doivent utiliser une contraception efficace pendant toute la durée du traitement et au moins trois mois après la dernière injection de Lucentis.
- Il n'existe aucune expérience de l'utilisation de Lucentis chez la femme enceinte. Lucentis ne doit pas être utilisé au cours d’une grossesse à moins que le bénéfice potentiel ne l’emporte sur le risque potentiel pour l’enfant à naître. Si vous êtes enceinte, si vous pensez être enceinte ou planifiez une grossesse, veuillez en discuter avec votre médecin avant le traitement par Lucentis.
- De petites quantités de Lucentis peuvent passer dans le lait maternel. Par conséquent, Lucentis n'est pas recommandé au cours de l'allaitement. Demandez conseil à votre médecin ou votre pharmacien avant le traitement par Lucentis.
Conduite de véhicules et utilisation de machines
Après le traitement par Lucentis, il est possible que vous ayez des troubles temporaires de la vision. Si cela vous arrive, vous ne devez ni conduire ni utiliser de machines tant que vos troubles visuels n'auront pas disparu.
3. COMMENT LUCENTIS EST ADMINISTRÉ
Lucentis sera administré par votre ophtalmologiste, sous forme d'une injection unique dans l'œil et sous anesthésie locale. La dose habituellement utilisée pour l’injection est de 0,05 ml (qui contient 0,5 mg de substance active). La seringue préremplie contient une dose de produit supérieure à la dose recommandée de 0,5 mg. La totalité du volume extractible ne doit pas être utilisée. Le volume excédentaire doit être éliminé avant l’injection. L’injection du volume total de la seringue préremplie peut entraîner un surdosage.
L’intervalle entre deux doses injectées dans le même œil doit être d’au moins quatre semaines. Toutes les injections seront réalisées par votre ophtalmologiste.
Avant l'injection, votre médecin vous lavera l'œil soigneusement afin d'éviter une infection. Votre médecin vous administrera également un anesthésique local afin de limiter ou d'éviter toute douleur liée à l'injection.
Le traitement sera initié avec une injection de Lucentis par mois. Votre médecin surveillera votre œil, et selon la façon dont vous répondez au traitement, décidera si vous nécessitez d’être retraité et quand.
Des instructions détaillées pour l’utilisation de Lucentis sont fournies à la fin de cette notice dans « Comment préparer et administrer Lucentis ».
Personnes âgées (65 ans et plus)
Lucentis peut être administré aux personnes âgées de 65 ans et plus, sans adaptation de la dose.
Avant d’arrêter le traitement par Lucentis
Si vous envisagez d'arrêter le traitement par Lucentis, veuillez vous rendre à votre prochain rendez-vous pour en discuter avec votre médecin. Votre médecin vous conseillera et décidera de la durée nécessaire du traitement par Lucentis.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin.
4. QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Les effets indésirables associés à l’administration de Lucentis sont dus au médicament lui-même ou à la procédure d’injection et touchent principalement l’œil.
Les effets indésirables les plus graves sont décrits ci-dessous :
Effets indésirables graves et fréquents (pouvant toucher jusqu’à 1 patient sur 10) : Décollement ou déchirure de la couche postérieure de l'œil (décollement ou déchirure de la rétine) entraînant une vision de flashes lumineux avec des corps flottants évoluant progressivement vers une perte de vision temporaire ou une opacification du cristallin (cataracte).
Effets indésirables graves et peu fréquents (pouvant toucher jusqu’à 1 patient sur 100) : Cécité, infection du globe oculaire (endophtalmie) avec inflammation de l’intérieur de l’œil.
Les symptômes que vous pourriez présenter sont des douleurs oculaires ou une gêne accrue, une rougeur de l’œil s’aggravant, une vision trouble ou diminuée, une augmentation du nombre de petites taches dans votre champ visuel ou une augmentation de la sensibilité à la lumière. Si vous développez l’un de ces effets indésirables, parlez-en immédiatement à votre médecin.
Les effets indésirables les plus fréquemment rapportés sont décrits ci-dessous :
Effets indésirables très fréquents (pouvant toucher plus de 1 patient sur 10)
Les effets indésirables oculaires sont les suivants : inflammation de l'œil, saignement dans la partie postérieure de l’œil (saignement de la rétine), troubles visuels, douleur oculaire, petites particules ou taches dans le champ visuel (corps flottants), œil injecté de sang, irritation oculaire, sensation d'avoir quelque chose dans l'œil, augmentation de la production de larmes, inflammation ou infection du bord des paupières, sécheresse de l'œil, rougeur ou démangeaison de l'œil et augmentation de la pression intraoculaire.
Les effets indésirables non oculaires sont les suivants : maux de gorge, congestion nasale, écoulement nasal, maux de tête et douleurs articulaires.
Les autres effets indésirables pouvant survenir après un traitement par Lucentis sont décrits ci-dessous :
Effets indésirables fréquents
Les effets indésirables oculaires sont les suivants : diminution de l’acuité visuelle, oedème de certaines parties de l’œil (uvée, cornée), inflammation de la cornée (partie antérieure de l’œil), petites marques à la surface de l’œil, vision trouble, saignement au site d’injection, saignement dans l’œil, sécrétions oculaires avec démangeaisons, rougeur et oedème (conjonctivite), sensibilité à la lumière, gêne oculaire, oedème de la paupière, douleur de la paupière.
Les effets indésirables non oculaires sont les suivants : infections urinaires, faible taux de globules rouges (associé à des symptômes tels que: fatigue, essoufflement, vertiges, pâleur), anxiété, toux, nausées, réactions cutanées de type allergique telles que éruption cutanée étendue, urticaire, démangeaison et rougeur de la peau.
Effets indésirables peu fréquents
Les effets indésirables oculaires sont les suivants : inflammation et saignement dans la partie antérieure de l’œil, poche de pus dans l’œil, modifications de la partie centrale de la surface de l’œil, douleur ou irritation au point d’injection, sensation anormale dans l’œil, irritation de la paupière.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement (voir informations ci-dessous). En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet: www.guichet.lu/pharmacovigilance
5. COMMENT CONSERVER LUCENTIS
- Tenir ce médicament hors de la vue et de la portée des enfants.
- N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et l’étiquette de la seringue préremplie après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
- A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler.
- Avant l’utilisation, l’emballage scellé pourra être conservé à une température ne dépassant pas 25°C jusqu’à 24 heures.
- Conserver la seringue préremplie dans son emballage fermé dans la boîte d’origine à l'abri de la lumière.
- N’utilisez aucun emballage endommagé.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient Lucentis
- La substance active est le ranibizumab. Chaque ml contient 10 mg de ranibizumab. Une seringue préremplie contient 0,165 ml, ce qui correspond à 1,65 mg de ranibizumab. Ceci permettant de délivrer une quantité suffisante pour délivrer une dose de 0,05 ml contenant 0,5 mg de ranibizumab.
- Les autres composants sont alpha, alpha-tréhalose dihydraté ; chlorhydrate d'histidine monohydraté ; histidine ; polysorbate 20 ; eau pour préparations injectables.
Comment se présente Lucentis et contenu de l’emballage extérieur
Lucentis est une solution injectable présentée dans une seringue préremplie. La seringue préremplie contient 0,165 ml de solution stérile, aqueuse, limpide, incolore à jaune-brun pâle. La seringue préremplie contient une dose de produit supérieure à la dose recommandée de 0,5 mg. La totalité du volume extractible ne doit pas être utilisée. Le volume excédentaire doit être éliminé avant l’injection. L’injection du volume total de la seringue préremplie peut entraîner un surdosage.
Boîte d’une seringue préremplie, dans un emballage scellé. La seringue préremplie est seulement à usage unique.
Titulaire de l’Autorisation de mise sur le marché
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlande
Fabricant
Novartis Manufacturing NV
Rijksweg 14
2870 Puurs-Sint-Amands
Belgique
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nuremberg
Allemagne
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’autorisation de mise sur le marché :
België/Belgique/Belgien
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Luxembourg/Luxemburg
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
La dernière date à laquelle cette notice a été révisée est 12/2025
Autres sources d’informations
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu/
Les informations suivantes sont destinées exclusivement aux professionnels de la santé :
Se référer également à la rubrique 3 « Comment Lucentis est administré ».
Comment préparer et administrer Lucentis ?
Seringue préremplie à usage unique réservée à la voie intravitréenne.
Lucentis doit être administré par un ophtalmologiste expérimenté ayant l'expérience des injections intravitréennes.
Dans la DMLA néovasculaire, dans les NVC, dans les RDP et dans la baisse visuelle due à un OMD ou à un œdème maculaire secondaire à une OVR, la dose recommandée de Lucentis est de 0,5 mg, administrée en une injection intravitréenne unique. Cette dose correspond à un volume d’injection de 0,05 ml. L’intervalle entre deux doses injectées dans le même œil doit être d’au moins quatre semaines.
Le traitement sera initié avec une injection par mois jusqu’à ce que l’acuité visuelle maximale soit atteinte et/ou jusqu’à l’absence de signe d’activité de la maladie, c’est-à-dire pas de changement de l’acuité visuelle ni des autres signes et symptômes de la maladie sous traitement continu. A l’initiation, chez les patients atteints de DMLA, d’OMD, de RDP et d’OBVR ou d’OVCR, au moins trois injections mensuelles consécutives peuvent être nécessaires.
Ensuite, les intervalles de suivi et de traitement doivent être déterminés par le médecin et doivent être basés sur l’activité de la maladie, évaluée par la mesure de l’acuité visuelle et/ou des critères anatomiques.
Si, selon l’avis du médecin, les critères visuels et anatomiques indiquent que le traitement continu n’est pas bénéfique pour le patient, Lucentis devra être arrêté.
Le suivi de l’activité de la maladie peut inclure des examens cliniques, des tests fonctionnels ou des techniques d’imagerie, comme la tomographie à cohérence optique ou l’angiographie à la fluoréscéine.
Si les patients sont traités selon un protocole « treat-and-extend », une fois l’acuité visuelle maximale atteinte et/ou qu’il n’y a plus de signe d’activité de la maladie, les intervalles de traitement peuvent être étendus progressivement jusqu’à réapparition de signes d’activité de la maladie et/ou de baisse visuelle. L’intervalle de traitement ne doit pas être prolongé de plus de deux semaines à la fois dans les cas de DMLA mais pourra être prolongé d’un mois à la fois dans les cas d’OMD. Dans les cas de RDP et d’OBVR ou d’OVCR, les intervalles de traitement peuvent également être allongés graduellement, cependant les données sont insuffisantes pour conclure sur la durée de ces intervalles. Si des signes d’activité de la maladie réapparaissent, l’intervalle de traitement doit être réduit en conséquence.
Le traitement de la baisse visuelle due à une NVC doit être déterminé de façon individualisée pour chaque patient en se basant sur l’activité de la maladie. Certains patients pourront ne nécessiter qu’une injection au cours des 12 premiers mois, d’autres pourront nécessiter un traitement plus fréquent, y compris des injections mensuelles. Dans les NVC secondaires à une myopie forte (MF), seulement une ou deux injections pourront être nécessaires pour de nombreux patients au cours de la première année.
Lucentis et photocoagulation au laser dans l’OMD et dans l’œdème maculaire secondaire à l’OBVR
Des données concernant l’administration concomitante de Lucentis et d’une photocoagulation au laser sont disponibles. Si les deux traitements sont réalisés le même jour, Lucentis doit être administré au moins 30 minutes après la photocoagulation au laser. Lucentis peut être administré aux patients ayant été traités précédemment par photocoagulation au laser.
Lucentis et thérapie photodynamique par la vertéporfine dans la NVC secondaire à une MF
Il n’existe pas de données concernant l’administration concomitante de Lucentis et de la vertéporfine.
Lucentis doit être inspecté visuellement pour détecter la présence de particules et d’une décoloration avant administration.
La procédure d'injection doit être réalisée en conditions d'asepsie, incluant la désinfection chirurgicale des mains, le port de gants stériles, l'utilisation d'un champ stérile et d'un spéculum à paupières stérile (ou équivalent) et la possibilité d'effectuer une paracentèse stérile (si nécessaire). Les antécédents médicaux du patient relatifs aux réactions d'hypersensibilité doivent être attentivement évalués avant de procéder à l'administration intravitréenne. Une anesthésie appropriée ainsi qu’un antibactérien local à large spectre pour désinfecter la peau autour de l'œil, la paupière et la surface oculaire doivent être administrés avant l'injection, conformément à la pratique locale.
La seringue préremplie est seulement à usage unique. La seringue préremplie est stérile. Ne pas utiliser ce produit si l’emballage est endommagé. La stérilité de la seringue préremplie ne peut être garantie que si l’emballage reste scellé. Ne pas utiliser la seringue préremplie si la solution a changé de couleur, est trouble ou contient des particules.
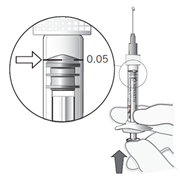
La seringue préremplie contient une dose de produit supérieure à la dose recommandée de 0,5 mg. La totalité du volume extractible de la seringue préremplie (0,1 ml) ne doit pas être utilisée. Le volume excédentaire doit être éliminé avant l’injection. L’injection du volume total de la seringue préremplie peut entraîner un surdosage. Pour éliminer les bulles d’air en même temps que l’excédent de médicament, pousser lentement le piston jusqu’à aligner le plateau situé en dessous de la partie bombée de la butée en caoutchouc avec le trait de dose noir de la seringue (équivalent à 0,05 ml, soit 0,5 mg de ranibizumab).
Pour l’injection intravitréenne, une aiguille stérile pour injection de 30 G x ½″ doit être utilisée.
Pour la préparation de Lucentis pour administration intravitréenne, veuillez respecter les instructions suivantes :
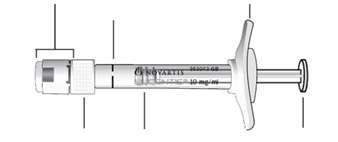
Introduction | Lire attentivement les instructions avant d’utiliser la seringue préremplie. | |
Description de la seringue préremplie |
| |
Préparation | 1. S’assurer que la boîte contient : | |
Vérifier la seringue | 3. Vérifier que:
|
|
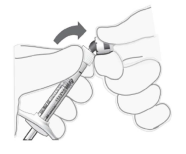
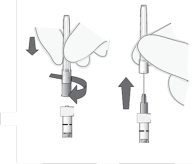
Retirer le capuchon de la seringue | 5. Casser (ne pas tourner ou tordre) le capuchon de la seringue (voir Figure 2). |
|
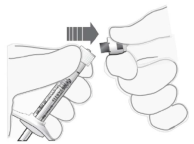
Attacher l’aiguille | 7. Fixer solidement une aiguille stérile pour injection de 30G x ½″ sur la seringue en la vissant fermement sur l’extrémité Luer lock (voir Figure 4). |
|
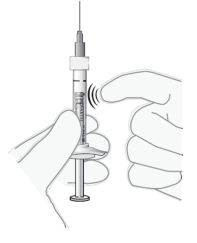
Chasser les bulles d’air | 9. Tenir la seringue en position verticale. |
|
Ajuster la dose | 11. Tenir la seringue à la hauteur des yeux et pousser délicatement le piston jusqu’à aligner le plateau situé en dessous de la partie bombée de la butée en caoutchouc avec le trait de dose (voir Figure 7). Ceci permettra d’expulser l’air et l’excès de solution et d’ajuster la dose au repère 0.05 ml. |
|
Injecter | La procédure d’injection doit être réalisée dans des conditions d’asepsie. | |
PRIX
| Code CNK | Emballage | Prix | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|
| 3120482 | LUCENTIS 1 SER PREREMPL 0,165ML SOL INJ 10MG/ML | - | Oui | - | - |