1. DENOMINATION DU MEDICAMENT
Duovent® HFA 0,020 mg/0,050 mg Solution pour inhalation en flacon pressurisé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Bromure d'ipratropium anhydre 0,020 mg (= 0,021 mg Bromure d'ipratropium monohydraté) – Bromhydrate de fénotérol 0,050 mg
Excipient(s) à effet notoire :
Ce médicament contient environ 13 mg d'alcool (éthanol) par prise.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution pour inhalation en flacon pressurisé.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Le Duovent HFA est un bronchodilatateur indiqué chez l’adulte et l’enfant à partir de 6 ans dans la prévention et le traitement symptomatique des troubles chroniques obstructifs des voies respiratoires associés à un écoulement d’air limité réversible tels que l’asthme bronchique et la bronchite chronique avec ou sans emphysème.
Un traitement concomitant avec des anti-inflammatoires devrait être envisagé chez les patients souffrant d’asthme bronchique ou de bronchopneumopathie chronique obstructive répondant aux corticostéroïdes.
4.2 Posologie et mode d'administration
Posologie
Posologies à adapter en fonction de chaque individu. Les doses recommandées sont les suivantes :
Adultes :
- Dans les épisodes d’asthme aigu, la posologie recommandée est de 2 bouffées.
Dans la plupart des cas, 2 bouffées sont généralement suffisantes pour induire un soulagement immédiat de la symptomatologie. Dans les cas sévères, si la respiration ne s’est pas améliorée après 5 minutes, 2 bouffées supplémentaires peuvent être requises.
Si la crise n’est pas soulagée par 4 bouffées, des doses répétées peuvent être nécessaires. Dans de tels cas, le patient devra être rapidement invité à consulter son médecin ou se rendre à l’hôpital le plus proche. - Dans les traitements intermittents et de longue durée : 1 à 2 bouffées par prise, avec un maximum de 8 bouffées par jour.
La dose d’entretien moyenne chez l’adulte est de 1 à 2 bouffées, 3 fois par jour. - Chez les patients souffrant d’asthme bronchique, le Duovent HFA solution pour inhalation en flacon pressurisé sera utilisé seulement lorsque nécessaire
Population pédiatrique :
- Enfants de plus de 6 ans : voir adultes
- Le Duovent HFA est contre-indiqué chez les enfants en-dessous de 6 ans (voir rubrique 4.3)
L’utilisation chez l’enfant se fera toujours sous avis médical et sous le contrôle d’un adulte.
Mode d’administration
Les patients doivent être instruits quant à l'utilisation correcte de la solution pour inhalation en flacon pressurisé pour assurer un traitement efficace.
Avant la première administration :
Retirer le capuchon protecteur et activer la valve deux fois avant la première utilisation de la solution pour inhalation en flacon pressurisé.
Si l'appareil n'a plus été utilisé depuis plus de 3 jours, il est également recommandé d'activer la valve une fois.
Avant chaque administration :
- Retirer le capuchon protecteur.
- Expirer le plus profondément possible (hors de l'appareil).
- Introduire l'embout dans la bouche comme montré en fig. lo1 et refermer les lèvres autour de cet embout.
- Commencer une inspiration lente par la bouche tout en libérant une bouffée d'aérosol (par pression de l'appareil entre le pouce et l'index) (fig. 1). Poursuivre l'inspiration lente le plus profondément possible. Maintenir une apnée de quelques secondes. Retirer l'appareil de la bouche et expirer lentement. Répéter le processus pour une seconde bouffée.
- Replacer le capuchon protecteur après l’utilisation.
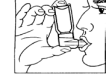
Fig. 1
Le flacon pressurisé du Duovent HFA n'étant pas transparent, il n'est pas possible de voir quand il est vide. Le flacon délivre 200 doses (bouffées). Après avoir dispensé 200 doses, celui-ci peut encore sembler contenir une petite quantité de liquide. Veuillez cependant remplacer votre inhalateur afin d’être certain de recevoir une quantité correcte de médicament lors de chaque bouffée.
- Nettoyez l’embout buccal au moins 1x/semaine.
- Il est important que l'embout buccal de votre inhalateur reste propre afin d’éviter toute accumulation du produit et un blocage du spray. Pour nettoyer, retirez le capuchon protecteur et enlevez le flacon de l’embout buccal. Lavez à l’eau chaude jusqu’à élimination du produit ou des impuretés.
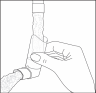
Fig. 2
- Après l’avoir nettoyé, secouez et laissez sécher l’embout buccal à l’air sans utiliser de source de chaleur. Dès que l’embout est sec, replacez le flacon et le capuchon protecteur.
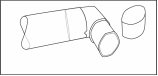
Fig. 3
Attention !
L'embout buccal en plastique est spécifique au Duovent HFA, solution pour inhalation en flacon pressurisé, afin que vous inhaliez toujours la dose appropriée du produit. Celui-ci ne peut être utilisé avec la solution pour inhalation en flacon pressurisé d'un autre produit. De même, la solution pour inhalation en flacon pressurisé de Duovent HFA ne peut être utilisée avec un autre embout buccal que le sien.
Les patients prédisposés au glaucome nécessitent une protection des yeux (voir § 4.4 "Mises en garde spéciales et précautions particulières d’emploi").
Le flacon est sous pression et ne doit en aucun cas être ouvert de force ou exposé à des températures supérieures à 50°C.
4.3 Contre-indications
- Hypersensibilité au bromhydrate de fénotérol, à d’autres amines sympathicomimétiques, à un autre dérivé atropinique ou à l’un des excipients mentionnés à la rubrique 6.1.
- Patients souffrants de thyréotoxicose, de cardiomyopathie hypertrophique obstructive ou de tachyarythmie.
- Enfants en-dessous de 6 ans.
4.8 Effets indésirables
Résumé du profil de sécurité
La plupart des effets indésirables peuvent être attribués aux propriétés anticholinergiques et
β-adrénergiques de Duovent HFA. Comme tout traitement topique, Duovent HFA peut entraîner des irritations locales.
Les effets indésirables les plus fréquents rapportés lors des études cliniques sont : céphalées, toux, bouche sèche, vomissements, nausées et étourdissements, tremblements, pharyngite, dysphonie, tachycardie, palpitations, augmentation de la pression systolique, nervosité.
Résumé tabulé des effets indésirables
Les effets indésirables ont été classés en fonction de leur incidence en utilisant la classification suivante :
Très fréquent ( 1/10) ; fréquent ( 1/100, <1/10) ; peu fréquent ( 1/1000, <1/100) ; rare ( 1/10000, < 1/1000) ; très rare (<1/10000) ; fréquence inconnue (ne peut être estimée sur la base des données cliniques disponibles).
Classes de systèmes d’organes | Effet indésirables | Fréquence |
Affections du système immunitaire | réactions cutanées ou réactions de type allergique (hypersensibilité)*, comme une éruption cutanée, un oedème angioneurotique, de l'urticaire, un laryngospasme et des réactions anaphylactiques* | Rare |
Troubles du métabolisme et de la nutrition | hypokaliémie* | Rare |
Affections psychiatriques | cas d’altérations psychologiques, agitation | Rare |
nervosité | Peu fréquent | |
Affections du système nerveux | céphalées, légers tremblements des muscles squelettiques, vertiges | Peu fréquent |
hyperactivité | Fréquence inconnue | |
Affections oculaires | troubles de l’accommodation*, glaucome à angle fermé*, augmentation de la pression intraoculaire*, mydriase*, vision trouble*, douleur oculaire*, œdème cornéen*, hyperémie de la conjonctive*, halo*. Voir aussi § "Mises en garde spéciales et précautions d’emploi". | Rare |
Affections cardiaques | fibrillation auriculaire, arythmies, tachycardie supraventriculaire*, ischémie myocardique* | Rare |
tachycardie, augmentation du rythme cardiaque, palpitations | Peu fréquent: | |
Affections respiratoires, thoraciques et médiastinales | toux | Fréquent |
pharyngite, dysphonie | Peu fréquent | |
bronchospasme, irritation de la gorge, œdème pharyngé, spasme laryngé*, bronchospasme paradoxal*, sécheresse de la gorge* | Rare | |
Affections gastro-intestinales | sécheresse de la bouche, nausées, vomissements | Peu fréquent |
stomatite, glossite, œdème buccal*, troubles du transit gastro-intestinal, constipation* et diarrhée | Rare | |
Affections de la peau et du tissu sous-cutané | rash, hyperhidrose*, urticaire, prurit, angio-œdème* | Rare |
Affections musculo-squelettiques et systémiques | myalgie, faiblesse et spasmes musculaires | Rare |
Affections du rein et des voies urinaires | rétention urinaire | Rare |
Investigations | augmentation de la tension artérielle systolique | Rare |
diminution de la tension artérielle diastolique | Peu fréquent |
* Cet effet indésirable a été notifié spontanément dans le cadre de données de suivi post-commercialisation. Cet effet indésirable n’a été observé dans aucun des essais cliniques sélectionnés avec le Duovent HFA. L’estimation est basée sur la limite supérieure de son intervalle de confiance à 95%, calculée à partir de la totalité des patients traités dans les essais cliniques et les études.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence Fédérale des Médicaments et des Produits de Santé
www.afmps.be
Division Vigilance :
Site internet : www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHE
Boehringer Ingelheim SComm
Avenue Arnaud Fraiteur 15-23
1050 Bruxelles
8. NUMERO D'AUTORISATION DE MISE SUR LE MARCHE
Belgique : BE223063
Luxembourg : 2009030359
- NN 0305499 : 10 ml
10. DATE DE MISE A JOUR DU TEXTE
06/05/2025
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1677863 | DUOVENT HFA AERO DOS 10 ML (200) | R03AL01 | € 12,06 | - | Oui | € 2,2 | € 1,32 |