1. DÉNOMINATION DU MÉDICAMENT
Saxenda 6 mg/ml, solution injectable en stylo prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 ml de solution contient 6 mg de liraglutide*. Un stylo prérempli contient 18 mg de liraglutide dans 3 ml.
* peptide analogue au glucagon-1 humain (GLP-1) produit par la technique de l’ADN recombinant sur Saccharomyces cerevisiae.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution injectable.
Solution isotonique, incolore ou presque incolore et limpide ; pH = 8,15.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Adultes
Saxenda est indiqué en complément d’un régime hypocalorique et d’une augmentation de l’activité physique dans le contrôle du poids chez des patients adultes ayant un Indice de Masse Corporelle (IMC) initial :
• ≥ 30 kg/m² (obésité), ou
• ≥ 27 kg/m² et < 30 kg/m² (surpoids) en présence d’au moins un facteur de comorbidité lié au poids tel qu’une dysglycémie (prédiabète ou diabète de type 2), une hypertension artérielle, une dyslipidémie ou un syndrome d’apnée obstructive du sommeil.
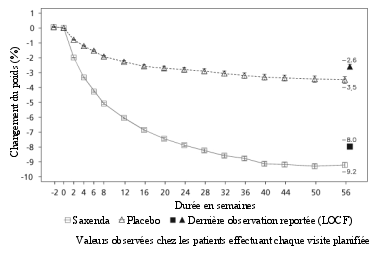
Le traitement par Saxenda doit être interrompu après 12 semaines à la dose de 3,0 mg/jour si les patients n’ont pas perdu au moins 5 % de leur poids initial.
Adolescents (≥ 12 ans)
Saxenda peut être utilisé en complément d’une alimentation saine et d’une augmentation de l’activité physique dans le contrôle du poids chez des patients adolescents à partir de 12 ans ayant :
• une obésité (correspondant à un IMC ≥ 30 kg/m² chez les adultes selon les seuils internationaux)* et
• un poids corporel supérieur à 60 kg.
Le traitement par Saxenda doit être interrompu et réévalué si les patients n’ont pas perdu au moins 4 % de leur IMC ou de leur Z-score d’IMC après 12 semaines à la dose de 3,0 mg/jour ou à la dose maximale tolérée.
* Seuils d’IMC selon l’IOTF pour l’obésité en fonction du sexe entre 12 et 18 ans (voir tableau 1), en accord avec le plan de l'étude 4180, voir la rubrique 5.1.
Tableau 1 Seuils d’IMC selon l’IOTF pour l’obésité en fonction du sexe entre 12 et 18 ans
Âge | IMC correspondant à 30 kg/m² pour les adultes selon les seuils internationaux. | |
Garçons | Filles | |
12 | 26,02 | 26,67 |
12,5 | 26,43 | 27,24 |
13 | 26,84 | 27,76 |
13,5 | 27,25 | 28,20 |
14 | 27,63 | 28,57 |
14,5 | 27,98 | 28,87 |
15 | 28,30 | 29,11 |
15,5 | 28,60 | 29,29 |
16 | 28,88 | 29,43 |
16,5 | 29,14 | 29,56 |
17 | 29,41 | 29,69 |
17,5 | 29,70 | 29,84 |
18 | 30,00 | 30,00 |
Enfants (de 6 à < 12 ans)
Saxenda est indiqué en complément d’une alimentation saine et d’une augmentation de l’activité physique dans le contrôle du poids chez les enfants âgés de 6 à <12 ans ayant
• une obésité (IMC ≥ 95e percentile)* et
• un poids corporel ≥ 45 kg
Le traitement par Saxenda doit être interrompu et réévalué si les patients n’ont pas perdu au moins 4 % de leur IMC ou de leur Z-score d’IMC après 12 semaines à la dose de 3,0 mg/jour ou à la dose maximale tolérée.
*Les seuils de l'IMC du CDC pour l'obésité (≥ 95e percentile) par sexe pour les enfants de 6 à < 12 ans (voir tableau 2), en accord avec le plan de l'étude 4392, voir rubrique 5.1.
Tableau 2 Les seuils de l'IMC (Poids en kg/Taille en m²) pour l'obésité (≥ 95e percentile) par sexe chez les enfants de 6 à < 12 ans
Âge | Obésité | |
Garçons | Filles | |
6 | 18,41 | 18,84 |
6,5 | 18,76 | 19,23 |
7 | 19,15 | 19,68 |
7,5 | 19,59 | 20,17 |
8 | 20,07 | 20,70 |
8,5 | 20,57 | 21,25 |
9 | 21,09 | 21,82 |
9,5 | 21,62 | 22,40 |
10 | 22,15 | 22,98 |
10,5 | 22,69 | 23,57 |
11 | 23,21 | 24,14 |
11,5 | 23,73 | 24,71 |
4.2 Posologie et mode d’administration
Posologie
Adultes
La dose initiale est de 0,6 mg une fois par jour. La dose doit être augmentée jusqu’à 3,0 mg une fois par jour, par paliers de 0,6 mg espacés d’au moins une semaine, pour améliorer la tolérance gastro-intestinale (voir tableau 3). Si l’augmentation à la dose supérieure n’est pas tolérée pendant deux semaines consécutives, l’arrêt du traitement doit être envisagé. Une dose quotidienne supérieure à 3,0 mg n’est pas recommandée.
Tableau 3 Schéma d’augmentation de la dose
| Dose | Semaines |
Augmentation de la dose sur 4 semaines | 0,6 mg | 1 |
1,2 mg | 1 | |
1,8 mg | 1 | |
2,4 mg | 1 | |
Dose d’entretien | 3,0 mg | |
Adolescents (≥ 12 ans)
Pour les adolescents âgés de 12 ans à moins de 18 ans, un schéma d’escalade de dose similaire à celui utilisé pour les adultes doit être appliqué (voir tableau 3). La dose doit être augmentée jusqu’à 3,0 mg (dose d’entretien) ou jusqu’à la dose maximale tolérée. Une dose quotidienne supérieure à 3,0 mg n’est pas recommandée.
Enfants (de 6 à < 12 ans)
Pour les enfants âgés de 6 ans à moins de 12 ans, un schéma d'escalade de dose similaire à celui utilisé pour les adultes doit être appliqué (voir tableau 3). La dose doit être augmentée jusqu'à atteindre 3,0 mg (dose d'entretien) ou jusqu’à la dose maximale tolérée. Des doses quotidiennes supérieures à 3,0 mg ne sont pas recommandées. Le liraglutide chez les enfants doit être initié par un médecin expérimenté dans la gestion de l'obésité pédiatrique.
Doses oubliées
Si une dose est oubliée dans les 12 heures qui suivent l’heure d’administration habituelle, le patient doit prendre la dose oubliée dès que possible. S’il reste moins de 12 heures avant la dose suivante, le patient ne doit pas prendre la dose oubliée et doit reprendre la dose suivante prévue selon le schéma d’administration quotidienne. Une dose supplémentaire ou une dose plus importante ne doit pas être prise pour compenser la dose oubliée.
Patients ayant un diabète de type 2
Saxenda ne doit pas être utilisé en association à un autre agoniste des récepteurs du GLP-1.
Au début du traitement par Saxenda, une réduction de la dose d’insuline ou des sécrétagogues de l’insuline (tels que les sulfamides hypoglycémiants) administrés de façon concomitante doit être envisagée afin de réduire le risque d’hypoglycémie. Une autosurveillance glycémique est nécessaire pour ajuster la dose d’insuline et des sécrétagogues de l’insuline (voir rubrique 4.4).
Populations particulières
Sujets âgés (≥ 65 ans)
Aucun ajustement de la dose n’est nécessaire en fonction de l’âge. L’expérience clinique de ce traitement chez les patients ≥ 75 ans est limitée et l’utilisation chez ces patients n’est pas recommandée (voir rubriques 4.4 et 5.2).
Insuffisance rénale
Aucun ajustement de la dose n’est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée (clairance de la créatinine ≥ 30 ml/min). Saxenda n’est pas recommandé chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine < 30 ml/min), y compris les patients présentant une insuffisance rénale terminale (voir rubriques 4.4, 4.8 et 5.2).
Insuffisance hépatique
Aucun ajustement de la dose n’est recommandé chez les patients présentant une insuffisance hépatique légère ou modérée. Saxenda n’est pas recommandé chez les patients présentant une insuffisance hépatique sévère et doit être utilisé avec précaution chez les patients présentant une insuffisance hépatique légère ou modérée (voir rubriques 4.4 et 5.2).
Population pédiatrique
Aucun ajustement de la dose n’est nécessaire chez les adolescents et les enfants à partir de 6 ans.
La sécurité et l’efficacité de Saxenda chez les enfants de moins de 6 ans n’ont pas été établies (voir rubrique 5.1).
Mode d’administration
Saxenda doit être administré par voie sous-cutanée uniquement. Il ne doit pas être administré par voie intraveineuse ou intramusculaire.
Saxenda doit être administré une fois par jour, quel que soit le moment de la journée, indépendamment des repas. Il doit être injecté dans l’abdomen, la cuisse ou le haut du bras. Le site d’injection et le moment de l’injection peuvent être modifiés sans ajustement de la dose. Toutefois, il est préférable d’effectuer les injections de Saxenda à peu près au même moment de la journée, après avoir choisi l’heure la plus adaptée. Les sites d'injection doivent toujours être alternés afin de réduire le risque de dépôts amyloïdes au site d’injection (voir rubrique 4.8).
Pour les instructions plus détaillées concernant l’administration, voir la rubrique 6.6.
4.3 Contre-indications
Hypersensibilité au liraglutide ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité :
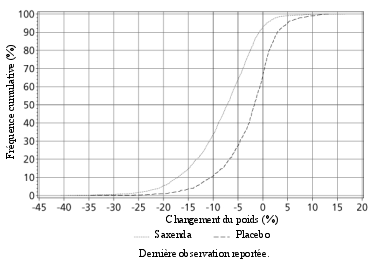
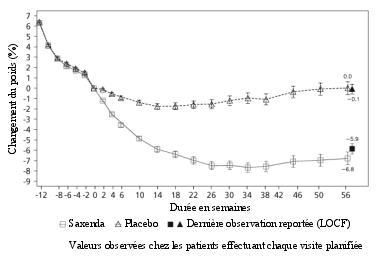
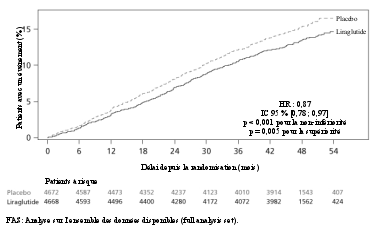
La sécurité de Saxenda a été évaluée au cours de 5 essais en double aveugle, contrôlés versus placebo dans lesquels ont été inclus 5 813 patients adultes avec un surpoids ou une obésité présentant au moins une comorbidité liée au poids. Dans l’ensemble, les réactions indésirables le plus fréquemment rapportées lors du traitement par Saxenda étaient les réactions gastro-intestinales (67,9 %) (voir rubrique « Description de certaines réactions indésirables »).
Liste tabulée des réactions indésirables
Le tableau 4 répertorie les réactions indésirables observées chez les adultes. Les réactions indésirables sont listées par classe de systèmes d’organes et par fréquence. Les catégories de fréquences sont définies de la manière suivante : très fréquent (≥ 1/10 ); fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les réactions indésirables sont présentées suivant un ordre décroissant de gravité.
Tableau 4 Réactions indésirables rapportées chez les adultes
Classes de systèmes d’organes MedDRA | Très fréquent | Fréquent | Peu fréquent | Rare | Fréquence indéterminée |
Affections du système immunitaire |
|
|
| Réaction anaphylactique |
|
Troubles du métabolisme et de la nutrition |
| Hypoglycémie* | Déshydratation |
|
|
Affections psychiatriques |
| Insomnie** |
|
|
|
Affections du système nerveux | Maux de tête | Vertiges |
|
|
|
Affections cardiaques |
|
| Tachycardie |
|
|
Affections gastro-intestinales | Nausées | Sécheresse buccale | Pancréatite*** |
| Obstruction intestinale† |
Affections hépatobiliaires |
| Lithiase biliaire *** | Cholécystite*** |
|
|
Affections de la peau et du tissu sous-cutané |
| Eruption cutanée | Urticaire |
| Amyloïdose cutanée |
Affections du rein et des voies urinaires |
|
|
| Insuffisance rénale aiguë |
|
Troubles généraux et anomalies au site d’administration |
| Réactions au site d’injection | Malaise |
|
|
Investigations |
| Lipase augmentée |
|
|
|
*Hypoglycémie (basée sur les symptômes rapportés par les patients eux-mêmes et non confirmée par une mesure de la glycémie) rapportée chez les patients ne présentant pas de diabète de type 2 traités par Saxenda en association à un régime alimentaire et de l’activité physique. Voir rubrique « Description de certaines réactions indésirables » pour plus d’informations.
**L’insomnie a été principalement observée pendant les 3 premiers mois de traitement.
***Voir rubrique 4.4.
****issu d’essais cliniques contrôlés de phase 2, 3a et 3b.
†Effets indésirables issus des sources post-commercialisation
Description de certaines réactions indésirables
Hypoglycémie chez les patients ne présentant pas de diabète de type 2
Lors des essais cliniques menés chez des patients obèses ou en surpoids sans diabète de type 2 et traités par Saxenda en association à un régime alimentaire et de l’activité physique, aucun événement hypoglycémique sévère (nécessitant l’intervention d’un tiers) n’a été rapporté. Des symptômes d’hypoglycémie ont été rapportés par 1,6 % des patients traités par Saxenda et par 1,1 % des patients du groupe placebo ; néanmoins, ces événements n’ont pas été confirmés par une mesure de la glycémie. La majorité de ces événements était d’intensité légère.
Hypoglycémie chez les patients ayant un diabète de type 2
Lors d’un essai clinique mené chez des patients obèses ou en surpoids ayant un diabète de type 2 et traités par Saxenda en association à un régime alimentaire et de l’activité physique, une hypoglycémie sévère (nécessitant l’intervention d’un tiers) a été rapportée par 0,7 % des patients traités par Saxenda et uniquement chez les patients traités de façon concomitante par sulfamide hypoglycémiant. De plus, chez ces patients, une hypoglycémie symptomatique documentée a été rapportée par 43,6 % des patients traités par Saxenda et par 27,3 % des patients recevant un placebo. Parmi les patients qui ne prenaient pas de traitement concomitant par sulfamide hypoglycémiant, 15,7 % des patients traités par Saxenda et 7,6 % des patients recevant un placebo ont rapporté des événements hypoglycémiques symptomatiques documentés (définis par une glycémie ≤ 3,9 mmol/l et la présence de symptômes).
Hypoglycémie chez les patients ayant un diabète de type 2 traités par une insuline
Lors d’un essai clinique mené chez des patients obèses ou en surpoids ayant un diabète de type 2 et traités par une insuline et liraglutide 3,0 mg/jour en association à un régime alimentaire, de l’activité physique et jusqu’à 2 antidiabétiques oraux, une hypoglycémie sévère (nécessitant l’intervention d’un tiers) a été rapportée par 1,5 % des patients traités par liraglutide 3,0 mg/jour. Dans cette étude, une hypoglycémie symptomatique documentée (définie par une glycémie ≤ 3,9 mmol/l et la présence de symptômes) a été rapportée par 47,2 % des patients traités par liraglutide 3,0 mg/jour et par 51,8 % des patients recevant un placebo. Parmi les patients traités de façon concomitante par sulfamide hypoglycémiant, 60,9 % des patients traités par liraglutide 3,0 mg/jour et 60,0 % des patients recevant un placebo ont rapporté des événements hypoglycémiques symptomatiques documentés.
Réactions indésirables gastro-intestinales
La majorité des événements gastro-intestinaux était d’intensité légère à modérée, transitoire et n’a pas nécessité l’arrêt du traitement. Ces réactions survenaient généralement pendant les premières semaines de traitement et diminuaient au bout de quelques jours ou semaines de poursuite du traitement.
Les patients ≥ 65 ans peuvent être davantage sujets aux effets indésirables gastro-intestinaux lorsqu’ils sont traités par Saxenda.
Les patients présentant une insuffisance rénale légère ou modérée (clairance de la créatinine ≥ 30 ml/min) peuvent être davantage sujets aux effets gastro-intestinaux lorsqu’ils sont traités par Saxenda.
Insuffisance rénale aiguë
Des cas d’insuffisance rénale aiguë ont été rapportés chez des patients traités par des agonistes des récepteurs du GLP-1. La majorité des événements rapportés est survenue chez des patients ayant présenté des nausées, des vomissements ou des diarrhées entraînant une déplétion hydrique (voir rubrique 4.4).
Réactions allergiques
Quelques cas de réactions anaphylactiques associées à des symptômes tels qu’une hypotension, des palpitations, une dyspnée et des œdèmes, ont été rapportés lors de la commercialisation du liraglutide. Les réactions anaphylactiques peuvent potentiellement engager le pronostic vital. Si une réaction anaphylactique est suspectée, le liraglutide doit être arrêté et le traitement ne doit pas être administré à nouveau (voir rubrique 4.3).
Réactions au site d’injection
Des réactions au site d’injection ont été rapportées chez des patients traités par Saxenda. Ces réactions étaient habituellement légères et transitoires et disparaissaient généralement lors de la poursuite du traitement.
Tachycardie
Lors des essais cliniques, des cas de tachycardie ont été rapportés chez 0,6 % des patients traités par Saxenda et chez 0,1 % des patients recevant un placebo. La majorité des événements était d’intensité légère ou modérée. Ces événements étaient isolés et la majorité d’entre eux s’est résolue lors de la poursuite du traitement par Saxenda.
Amyloïdose cutanée
Une amyloïdose cutanée peut apparaitre au site d’injection (voir rubrique 4.2).
Population pédiatrique
Lors d’un essai clinique conduit chez des adolescents obèses âgés de 12 ans à moins de 18 ans, 125 patients ont été exposés à Saxenda pendant 56 semaines.
Dans l’ensemble, la fréquence, la nature et la sévérité des effets indésirables chez les adolescents obèses ont été comparables à celles observées dans la population adulte. Les vomissements ont été deux fois plus fréquents chez les adolescents que chez les adultes.
Le pourcentage de patients rapportant au moins un épisode d’hypoglycémie cliniquement significative a été plus élevé avec le liraglutide (1,6 %) qu’avec le placebo (0,8 %). Aucun épisode d’hypoglycémie sévère n’est survenu pendant l’essai.
Lors d’un essai clinique conduit chez des enfants obèses âgés de 6 ans à moins de 12 ans (Essai 4392), 56 patients ont été exposés à Saxenda pendant 56 semaines.
Dans l’ensemble, la fréquence, la nature et la sévérité des effets indésirables chez les enfants obèses ont été comparables à celles observées dans la population adolescent et adulte.
Les enfants ont rapporté davantage d’événements gastro-intestinaux dans les groupes liraglutide et placebo par rapport aux adolescents et aux adultes, avec une augmentation des vomissements d’un facteur 2 observée chez les enfants par rapport aux adolescents.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance
Site internet : www.notifieruneffetindesirable.be
E-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Novo Nordisk A/S
Novo Alle 1
DK-2880 Bagsværd
Danemark
8. NUMÉROS D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/15/992/001-003
10. DATE DE MISE À JOUR DU TEXTE
06/2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3384401 | SAXENDA 6MG/ML SOL INJ STYLO PREREMPLI 5X3ML | A10BJ02 | € 244,99 | - | Oui | - | - |