RESUME DES CARACTERISTIQUES DU PRODUIT
1. DÉNOMINATION DU MEDICAMENT
MabThera 100 mg solution à diluer pour perfusion
MabThera 500 mg solution à diluer pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
MabThera 100 mg solution à diluer pour perfusion
Chaque mL contient 10 mg de rituximab.
Chaque flacon de 10 mL contient 100 mg de rituximab.
MabThera 500 mg solution à diluer pour perfusion
Chaque mL contient 10 mg de rituximab.
Chaque flacon de 50 mL contient 500 mg de rituximab.
Le rituximab est un anticorps monoclonal chimérique murin/humain obtenu par génie génétique ; il s'agit d'une immunoglobuline glycosylée associant d'une part les régions constantes d’une IgG1 humaine et d'autre part les régions variables des chaînes légères et lourdes d'origine murine. Cet anticorps est produit par une culture de cellules de mammifères (ovaires de hamster chinois) et purifié par chromatographie d’affinité et échange d’ions, comportant des procédés d’inactivation et d’élimination virales spécifiques.
Excipients à effet notoire
Chaque flacon de 10 mL contient 2,3 mmol (52,6 mg) de sodium.
Chaque flacon de 50 mL contient 11,5 mmol (263,2 mg) de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution à diluer pour perfusion.
Liquide limpide et incolore. Le pH de la solution est compris entre 6,2 et 6,8 et son osmolalité se situe entre 324 et 396 mOsmol/kg.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
MabThera est indiqué chez les patients adultes dans les indications suivantes :
Lymphomes non-hodgkiniens (LNH)
MabThera est indiqué en association à une chimiothérapie pour le traitement des patients adultes présentant un lymphome folliculaire de stade III-IV n’ayant jamais été précédemment traités.
MabThera en traitement d’entretien est indiqué chez les patients adultes présentant un lymphome folliculaire répondant à un traitement d’induction.
MabThera en monothérapie est indiqué pour le traitement des patients adultes atteints de lymphomes folliculaires de stade III-IV en cas de chimiorésistance ou à partir de la deuxième rechute après chimiothérapie.
MabThera est indiqué en association à une chimiothérapie "CHOP" (cyclophosphamide, doxorubicine, vincristine, prednisolone) pour le traitement des patients adultes présentant un lymphome non-hodgkinien agressif diffus à grandes cellules B, CD20 positif.
MabThera est indiqué en association à une chimiothérapie pour le traitement des patients pédiatriques (âgés de ≥ 6 mois à < 18 ans) non précédemment traités présentant à un stade avancé : un lymphome diffus à grandes cellules B (LDGCB) CD20 positif, un lymphome de Burkitt (LB)/une leucémie de Burkitt (leucémie aiguë à cellules B matures) (LA-B) ou un lymphome Burkitt-like (LB-like).
Leucémie lymphoïde chronique (LLC)
MabThera en association à une chimiothérapie est indiqué pour le traitement des patients atteints de LLC, non précédemment traités et en rechute ou réfractaires. Les données disponibles sur l'efficacité et la tolérance sont limitées chez les patients précédemment traités par des anticorps monoclonaux dont MabThera, ou chez les patients réfractaires à un traitement antérieur par MabThera en association à une chimiothérapie.
Voir rubrique 5.1 pour plus d’informations.
Polyarthrite rhumatoïde
MabThera en association au méthotrexate est indiqué pour le traitement de la polyarthrite rhumatoïde active, sévère, chez les patients adultes qui ont présenté une réponse inadéquate ou une intolérance aux traitements de fond, dont au moins un inhibiteur du facteur de nécrose tumorale (anti-TNF).
Il a été montré que MabThera, en association au méthotrexate, réduit le taux de progression des dommages structuraux articulaires mesurés par radiographie et améliore les capacités fonctionnelles.
Granulomatose avec polyangéite et polyangéite microscopique
MabThera, en association aux glucocorticoïdes, est indiqué pour le traitement des patients adultes atteints de granulomatose avec polyangéite (GPA) (maladie de Wegener) et de polyangéite microscopique (PAM), sévères et actives.
MabThera, en association aux glucocorticoïdes, est indiqué pour l’induction de la rémission chez les patients pédiatriques (âgés de ≥ 2 à < 18 ans) atteints de GPA (maladie de Wegener) et de PAM, sévères et actives.
Pemphigus vulgaris
MabThera est indiqué dans le traitement des patients atteints de pemphigus vulgaris (PV) modéré à sévère.
4.2 Posologie et mode d’administration
MabThera doit être administré sous étroit contrôle d’un professionnel de santé expérimenté et dans un environnement où l’ensemble des moyens de réanimation sont immédiatement disponibles (voir rubrique 4.4).
Prémédication et prophylaxie médicamenteuse
Une prémédication composée d’un antipyrétique et d’un antihistaminique, par exemple paracétamol et diphénhydramine, doit toujours être donnée avant chaque administration de MabThera.
Une prémédication par glucocorticoïde doit être envisagée si MabThera n’est pas associé à une chimiothérapie contenant un glucocorticoïde pour le traitement des patients adultes atteints d’un lymphome non-hodgkinien et d’une leucémie lymphoïde chronique.
Une prémédication par du paracétamol et un anti-histaminique H1 (= diphénhydramine ou équivalent) doit être administrée 30 à 60 minutes avant le début de la perfusion de MabThera chez les patients pédiatriques atteints d’un lymphome non hodgkinien. De plus, la prednisone doit être administrée comme indiqué dans le tableau 1.
Un traitement prophylactique par une hydratation appropriée et une administration d'uricostatiques 48 heures avant le début du traitement est recommandé chez les patients atteints de LLC pour réduire le risque de syndrome de lyse tumorale. Chez les patients atteints de LLC dont le nombre de lymphocytes est > 25 x 109/L, il est recommandé d'administrer 100 mg de prednisone/prednisolone par voie intraveineuse peu avant la perfusion de MabThera pour diminuer le taux et la sévérité des réactions aiguës liées à la perfusion et/ou le syndrome de relargage de cytokines.
Les patients atteints de polyarthrite rhumatoïde, de GPA, de PAM ou de pemphigus vulgaris, doivent recevoir une prémédication par 100 mg de méthylprednisolone par voie intraveineuse, qui doit être terminée 30 minutes avant chaque perfusion de MabThera, afin de réduire la fréquence et la sévérité des réactions liées à la perfusion (RLPs).
Chez les patients adultes atteints de GPA ou de PAM, l’administration de la méthylprednisolone par voie intraveineuse à une posologie de 1 000 mg par jour est recommandée pendant 1 à 3 jours avant la première perfusion de MabThera (la dernière dose de méthylprednisolone peut être administrée le même jour que la première perfusion de MabThera). Ce traitement doit être poursuivi par l’administration de prednisone orale à la dose de 1 mg/kg/jour (sans dépasser 80 mg/jour, et avec réduction progressive de la posologie aussi rapide que possible en fonction de la clinique) pendant et après les 4 semaines d’induction du traitement par MabThera.
La prophylaxie de la pneumonie à Pneumocystis jirovecii (PJP) est recommandée chez les patients adultes atteints de GPA, de PAM ou de PV pendant et après le traitement par MabThera, conformément aux recommandations cliniques locales.
Population pédiatrique
Chez les patients pédiatriques atteints de GPA ou de PAM, avant la première perfusion IV de MabThera, de la méthylprednisolone doit être administrée par voie IV à raison d’une dose quotidienne de 30 mg/kg/jour (sans dépasser 1 g/jour) pendant 3 jours pour traiter les symptômes sévères de vascularite. Jusqu’à trois doses quotidiennes supplémentaires de 30 mg/kg de méthylprednisolone par voie IV peuvent être administrées avant la première perfusion de MabThera.
Une fois l’administration de la méthylprednisolone par voie IV terminée, les patients doivent recevoir de la prednisone orale à la dose de 1 mg/kg/jour (sans dépasser 60 mg/jour), avec réduction progressive de la dose aussi rapide que possible en fonction de la clinique (voir rubrique 5.1).
La prophylaxie de la pneumonie à Pneumocystis jirovecii (PJP) est recommandée chez les patients pédiatriques atteints de GPA ou de PAM pendant et après le traitement par MabThera, conformément aux recommandations cliniques locales.
Posologie
Il est important de vérifier les étiquettes des médicaments afin de s’assurer que la formulation appropriée (intraveineuse ou sous-cutanée) est administrée au patient, conformément à la prescription.
Lymphomes non-hodgkiniens
Lymphome folliculaire non-hodgkinien
Association de traitement
La posologie de MabThera en association à une chimiothérapie en traitement d’induction chez les patients atteints de lymphome folliculaire n’ayant jamais été précédemment traités, en rechute ou réfractaires, est de 375 mg/m² de surface corporelle par cure et ce, jusqu’à 8 cures.
MabThera doit être administré le premier jour de chaque cure de chimiothérapie et ceci après administration intraveineuse du glucocorticoïde du protocole, si approprié.
Traitement d’entretien
Lymphome folliculaire non précédemment traité
La posologie de MabThera recommandée en traitement d’entretien, chez les patients atteints de lymphome folliculaire non précédemment traité ayant répondu à un traitement d’induction, est de 375 mg/m² de surface corporelle, administrés une fois tous les 2 mois (en commençant 2 mois après la dernière dose du traitement d’induction) jusqu’à progression de la maladie ou pendant une durée maximale de deux ans (12 perfusions au total).
Lymphome folliculaire en rechute ou réfractaire
La posologie de MabThera recommandée en traitement d’entretien, chez les patients atteints de lymphome folliculaire en rechute ou réfractaire ayant répondu à un traitement d’induction, est de 375 mg/m² de surface corporelle, administrés une fois tous les trois mois (en commençant 3 mois après la dernière dose du traitement d’induction) jusqu’à progression de la maladie ou pendant une durée maximale de deux ans (8 perfusions au total).
Monothérapie
Lymphome folliculaire en rechute ou réfractaire
La posologie de MabThera recommandée en monothérapie, dans le cadre d’un traitement d’induction chez les patients adultes atteints de lymphome folliculaire de stade III-IV chimiorésistants ou à partir de la deuxième rechute après chimiothérapie, est de 375 mg/m2 de surface corporelle, administrés en perfusion intraveineuse une fois par semaine pendant quatre semaines.
La posologie recommandée dans le cas d’un retraitement par MabThera en monothérapie chez les patients ayant un lymphome folliculaire en rechute ou réfractaire qui avaient répondu à un traitement antérieur par MabThera en monothérapie est de 375 mg/m² de surface corporelle, administrés en perfusion intraveineuse une fois par semaine pendant quatre semaines (voir rubrique 5.1).
Lymphome non-hodgkinien agressif diffus à grandes cellules B chez l’adulte
MabThera doit être utilisé en association avec une chimiothérapie "CHOP". La posologie recommandée est de 375 mg/m² de surface corporelle, administrés le premier jour de chaque cure de chimiothérapie, pendant 8 cures, après perfusion intraveineuse du glucocorticoïde du protocole "CHOP". La tolérance et l'efficacité de MabThera n'ont pas été démontrées en association à d'autres chimiothérapies en cas de lymphome non-hodgkinien agressif diffus à grandes cellules B.
Ajustements posologiques pendant le traitement
Aucune réduction de la dose de MabThera n’est recommandée. Lorsque MabThera est associé à une chimiothérapie, la réduction de dose pour les médicaments de chimiothérapie doit être appliquée selon le schéma habituel.
Leucémie lymphoïde chronique
La posologie recommandée de MabThera en association à une chimiothérapie chez les patients non précédemment traités et en rechute ou réfractaires est de 375 mg/m2 de surface corporelle, administrés à J0 du premier cycle, suivis par 500 mg/m2 de surface corporelle administrés à J1 de chaque cycle suivant, pour un total de 6 cycles. La chimiothérapie doit être administrée après la perfusion de MabThera.
Polyarthrite rhumatoïde
Les patients traités par MabThera doivent recevoir la carte de surveillance du patient lors de chaque perfusion.
Un cycle de traitement par MabThera est constitué de deux perfusions intraveineuses de 1000 mg. La posologie recommandée de MabThera est de 1000 mg par perfusion intraveineuse, suivie d’une deuxième perfusion intraveineuse de 1000 mg à deux semaines d'intervalle.
La nécessité de cycles supplémentaires doit être évaluée à la 24ème semaine après le cycle précédent. Un nouveau cycle doit être instauré après ce délai s’il persiste une activité résiduelle de la maladie. Sinon, le retraitement devra être reporté et instauré dès que la maladie redevient active.
Des données disponibles suggèrent que la réponse clinique est habituellement atteinte dans les 16 à 24 semaines suivant le cycle initial de traitement. La prolongation du traitement doit être reconsidérée avec précaution chez les patients pour lesquels le bénéfice thérapeutique durant cette période n’a pas été mis en évidence.
Granulomatose avec polyangéite (GPA) et polyangéite microscopique (PAM)
Les patients traités par MabThera doivent recevoir la carte de surveillance du patient lors de chaque perfusion.
Induction de la rémission chez l’adulte
La dose recommandée de MabThera pour le traitement d’induction de la rémission chez les patients adultes atteints de GPA et de PAM est de 375 mg/m² de surface corporelle, administrés en perfusion intraveineuse une fois par semaine pendant 4 semaines (quatre perfusions au total).
Traitement d’entretien chez l’adulte
Après l'induction de la rémission par MabThera, le traitement d'entretien chez les patients adultes atteints de GPA et de PAM doit être initié au plus tôt 16 semaines après la dernière perfusion de MabThera.
Après l'induction de la rémission avec d'autres immunosuppresseurs standards, le traitement d'entretien par MabThera doit être initié dans les 4 semaines suivant la rémission de la maladie.
MabThera doit être administré en deux perfusions IV de 500 mg espacées de deux semaines, suivies d'une perfusion IV de 500 mg tous les 6 mois. Les patients doivent recevoir MabThera pendant au moins 24 mois après rémission complète (absence de signes et de symptômes cliniques). Chez les patients qui présentent un risque plus élevé de rechute, les médecins peuvent envisager un traitement d'entretien par MabThera d'une durée plus longue, jusqu'à 5 ans.
Pemphigus vulgaris
Les patients traités par MabThera doivent recevoir la carte de surveillance du patient à chaque perfusion.
La posologie recommandée de MabThera pour le traitement du pemphigus vulgaris est de 1000 mg administrés en perfusion IV, suivie deux semaines plus tard d'une deuxième perfusion IV de 1000 mg en association avec des glucocorticoïdes dont la dose sera progressivement réduite.
Traitement d'entretien
Une perfusion IV d'entretien de 500 mg doit être administrée aux 12e et 18e mois, puis tous les 6 mois si besoin, en fonction de l'évaluation clinique.
Traitement de la rechute
En cas de rechute, les patients peuvent recevoir une perfusion IV de 1000 mg. Le médecin doit également envisager de reprendre ou d'augmenter la dose de glucocorticoïdes du patient en fonction de l'évaluation clinique.
Les prochaines perfusions ne peuvent être administrées qu’au plus tôt 16 semaines après la dernière perfusion.
Populations particulières
Population pédiatrique
Lymphomes non-hodgkiniens
Chez les patients pédiatriques âgés de ≥ 6 mois à < 18 ans non précédemment traités présentant à un stade avancé un(e) LDGCB CD20 positif/LB/LA-B/LB-like, MabThera doit être utilisé en association avec une chimiothérapie systémique de type Lymphome Malin B (LMB) (voir tableaux 1 et 2). La posologie recommandée de MabThera est de 375 mg/m2 de surface corporelle administrés en perfusion IV. Aucun autre ajustement posologique de MabThera n’est nécessaire.
La sécurité et l’efficacité de MabThera chez les patients pédiatriques âgés de ≥ 6 mois à < 18 ans n’ont pas été établies dans des indications autres que le/la LDGCB CD20 positif/LB/LA-B/LB-like de stade avancé, non précédemment traité(e). Les données disponibles chez les patients âgés de moins de 3 ans sont limitées. Voir rubrique 5.1 pour plus d’informations.
MabThera ne doit pas être utilisé chez les patients pédiatriques, de la naissance jusqu’à < 6 mois, présentant un lymphome diffus à grandes cellules B CD20 positif (voir rubrique 5.1).
Tableau 1 Schéma d’administration de MabThera chez les patients pédiatriques atteints d’un lymphome non hodgkinien
Cycle | Jour du traitement | Détails de l’administration |
Préphase (COP) | Pas d’administration de MabThera | - |
Cure d’induction 1 | Jour -2 | |
Jour 1 | | |
Cure d’induction 2 | Jour -2 | |
Jour 1 | | |
Cure de consolidation 1 | Jour 1 | |
Cure de consolidation 2 | Jour 1 | |
Cure d’entretien 1 (M1) | Jours 25 à 28 de la cure de consolidation 2 (CYVE) | |
Cure d’entretien 2 (M2) | Jour 28 de la cure d’entretien 1 (M1) | - |
ANC = nombre absolu de neutrophiles ; COP = Cyclophosphamide, Vincristine, Prednisone ; COPADM = Cyclophosphamide, Vincristine, Prednisolone, Doxorubicine, Méthotrexate ; CYM = CYtarabine (Aracytine, Ara-C), Méthotrexate ; CYVE = CYtarabine (Aracytine, Ara-C), VEpeside (VP16 ou etoposide) | ||
Tableau 2 Schéma thérapeutique pour les patients pédiatriques atteints d’un lymphome non hodgkinien : Administration de MabThera en association avec une chimiothérapie
Schéma thérapeutique | Stade de la maladie | Détails de l’administration |
Groupe B | Stade III avec un taux de LDH élevé (> N x 2), | Préphase suivie de 4 cures : |
Groupe C | Groupe C1 : | Préphase suivie de 6 cures : |
Groupe C3 : | ||
Les cures consécutives doivent être administrées dès que la numération de la formule sanguine et l’état du patient le permettent, à l’exception des cures d’entretien qui sont administrées à intervalles de 28 jours | ||
LA-B = leucémie de Burkitt (leucémie aiguë à cellules B matures) ; LCR = liquide céphalo-rachidien ; SNC = système nerveux central ; MTX-HD = méthotrexate à haute dose ; LDH = lactate déshydrogénase | ||
Granulomatose avec polyangéite (GPA) et polyangéite microscopique (PAM)
Induction de la rémission
La dose recommandée de MabThera pour le traitement d’induction de la rémission chez les patients pédiatriques atteints d’une forme sévère et active de GPA ou de PAM est de 375 mg/m2 de surface corporelle, administrés en perfusion IV une fois par semaine pendant 4 semaines.
La sécurité et l’efficacité de MabThera chez les patients pédiatriques (âgés de ≥ 2 à < 18 ans) n’ont pas été établies dans les indications autres que la forme sévère et active de GPA et de PAM.
MabThera ne doit pas être utilisé chez les patients pédiatriques âgés de moins de 2 ans atteints d’une forme sévère et active de GPA ou de PAM, en raison de la possibilité d’une réponse immunitaire inadéquate aux vaccinations contre les maladies infantiles fréquentes (p. ex. rougeole, oreillons, rubéole et poliomyélite) (voir rubrique 5.1).
Personnes âgées
Aucune adaptation posologique n’est nécessaire chez les patients âgés (plus de 65 ans).
Mode d’administration
La solution de MabThera préparée doit être administrée en perfusion intraveineuse réservée à ce seul produit. Elle ne doit pas être injectée rapidement ni en bolus.
Les patients doivent être étroitement surveillés en cas de début d’un syndrome de relargage de cytokines (voir rubrique 4.4). Chez les patients qui développent des signes évidents de réaction grave, notamment dyspnée sévère, bronchospasme ou hypoxie, la perfusion doit être interrompue immédiatement. Chez les patients atteints d’un lymphome non-hodgkinien, il faudra pratiquer des examens biologiques appropriés pour mettre en évidence un syndrome de lyse tumorale et une radiographie thoracique pour détecter un infiltrat pulmonaire. Chez tous les patients, la perfusion ne doit pas être reprise avant disparition complète de tous les symptômes et avant normalisation des résultats biologiques et des clichés pulmonaires. La perfusion peut ensuite être reprise à une vitesse réduite au moins de moitié par rapport à la vitesse initiale. Si des réactions indésirables graves surviennent de nouveau, l’arrêt du traitement doit être sérieusement envisagé au cas par cas.
Des réactions légères ou modérées liées à la perfusion (RLP) (voir rubrique 4.8) répondent habituellement à une réduction de la vitesse de la perfusion. Celle-ci peut être augmentée en fonction de l’amélioration des symptômes.
Première perfusion
Il est recommandé de débuter la perfusion à une vitesse de 50 mg/h ; après les 30 premières minutes, la vitesse de perfusion pourra être augmentée par paliers de 50 mg/h toutes les 30 minutes jusqu’à un maximum de 400 mg/h.
Perfusions ultérieures
Toutes les indications
Lors des perfusions ultérieures de MabThera, la vitesse initiale pourra être de 100 mg/h, puis augmentée de 100 mg/h toutes les 30 minutes, jusqu'à un maximum de 400 mg/h.
Patients pédiatriques – lymphomes non-hodgkiniens
Première perfusion
Il est recommandé de débuter la perfusion à une vitesse de 0,5 mg/kg/h (maximum 50 mg/h) ; la vitesse de perfusion pourra être augmentée par paliers de 0,5 mg/kg/h toutes les 30 minutes, en l’absence de réactions d’hypersensibilité ou de réactions liées à la perfusion, jusqu’à un maximum de 400 mg/h.
Perfusions ultérieures
Lors des perfusions ultérieures de MabThera, la vitesse initiale pourra être de 1 mg/kg/h (maximum 50 mg/h) ; la vitesse de perfusion pourra être augmentée par paliers de 1 mg/kg/h toutes les 30 minutes, jusqu’à un maximum de 400 mg/h.
Polyarthrite rhumatoïde uniquement
Possibilité d’un schéma de perfusion plus rapide pour les perfusions ultérieures.
Si les patients n’ont pas présenté de réactions graves liées à leur première perfusion ou aux suivantes administrées à la posologie de 1000 mg de MabThera selon le schéma de perfusion standard, une perfusion plus rapide peut être administrée lors de la deuxième perfusion et des suivantes en utilisant la même concentration que pour les précédentes perfusions (4 mg/mL dans un volume de 250 mL). Elles seront initiées à la vitesse de 250 mg/heure durant les 30 premières minutes, puis poursuivies à 600 mg/h au cours des 90 minutes suivantes. Si cette perfusion plus rapide est bien tolérée, ce schéma peut être utilisé lors des perfusions suivantes.
Les patients ayant une maladie cardiovasculaire cliniquement significative, notamment des arythmies, ou ayant présentés une réaction grave liée à la perfusion d’un précédent traitement biologique ou de rituximab, ne doivent pas recevoir ce schéma de perfusion plus rapide.
4.3 Contre-indications
Contre-indications d'utilisation dans les lymphomes non-hodgkiniens et dans la leucémie lymphoïde chronique
Hypersensibilité à la substance active ou aux protéines d’origine murine, ou à l'un des autres excipients mentionnés à la rubrique 6.1.
Infections sévères, évolutives (voir rubrique 4.4).
Patients ayant un déficit immunitaire sévère.
Contre-indications d'utilisation dans la polyarthrite rhumatoïde, la granulomatose avec polyangéite, la polyangéite microscopique et le pemphigus vulgaris.
Hypersensibilité à la substance active ou aux protéines d’origine murine, ou à l'un des autres excipients mentionnés à la rubrique 6.1.
Infections sévères, évolutives (voir rubrique 4.4).
Patients ayant un déficit immunitaire sévère.
Insuffisance cardiaque sévère (New York Heart Association (NYHA) Classe IV) ou maladie cardiaque sévère non contrôlée (voir rubrique 4.4 concernant les autres maladies cardiovasculaires).
4.8 Effets indésirables
Expérience dans le lymphome non-hodgkinien et dans la leucémie lymphoïde chronique chez l’adulte
Résumé du profil de sécurité d’emploi
Le profil général de tolérance de MabThera dans le lymphome non-hodgkinien et dans la leucémie lymphoïde chronique est issu de données acquises chez des patients au cours des études cliniques et depuis la mise sur le marché. Ces patients ont été traités avec MabThera en monothérapie (en traitement d’induction ou en traitement d’entretien après un traitement d’induction) ou en association à une chimiothérapie.
Les effets indésirables les plus fréquemment observés chez les patients recevant du MabThera étaient des RLPs, qui sont survenues lors de la première perfusion chez la plupart des patients. L’incidence des symptômes liés à la perfusion diminue considérablement lors des perfusions ultérieures pour atteindre moins de 1 % après la huitième cure de MabThera.
Des événements infectieux (principalement bactériens et viraux) sont survenus au cours des études cliniques chez approximativement 30 à 55 % des patients atteints de lymphome non-hodgkinien et chez 30 à 50 % des patients atteints de leucémie lymphoïde chronique.
Les effets indésirables graves les plus fréquemment rapportés ou observés étaient :
des RLPs (incluant le syndrome de relargage des cytokines, le syndrome de lyse tumorale), voir rubrique 4.4
des infections, voir rubrique 4.4
des événements cardio-vasculaires, voir rubrique 4.4
D’autres effets indésirables graves tels que des réactivations d’hépatite B et des leucoencéphalopathies multifocales progressives (LEMP) ont été rapportés (voir rubrique 4.4).
Liste tabulée des effets indésirables
Les fréquences des effets indésirables rapportés avec MabThera seul ou en association avec des chimiothérapies sont résumées dans le Tableau 3. Les fréquences sont définies comme très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1000), très rare (< 1/10 000) et non connue (ne peut être estimée à partir des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Les effets indésirables identifiés uniquement depuis la commercialisation, et pour lesquels la fréquence ne peut pas être estimée, sont listés dans la colonne « inconnu ».
Tableau 3 Effets indésirables rapportés au cours des études cliniques ou depuis la commercialisation chez des patients atteints de lymphome non-hodgkinien ou de leucémie lymphoïde chronique traités avec MabThera en monothérapie/entretien ou en association à une chimiothérapie
MedDRA | Très fréquent | Fréquent | Peu fréquent | Rare | Très rare | Non connue8 |
Infections et infestations | infections bactériennes, infections virales, +bronchites | septicémie, +pneumonie, |
| infections virales graves2 Infections à Pneumocystis jirovecii | LEMP | méningo-encéphalite à entérovirus2,3 |
Affections hématologiques et du système lymphatique | neutropénie, leucopénie, +neutropénie fébrile, + thrombopénie | anémie, +pancytopénie, + granulocytopénie | troubles de la coagulation, aplasie médullaire, anémie hémolytique, lymphadénopathie |
| augmentation transitoire des taux sériques d’IgM4 | neutropénie tardive4 |
Affections du système immunitaire | réactions liées à la perfusion5, angiœdème | hypersensibilité |
| anaphylaxie | syndrome de lyse tumorale, | thrombocytopénie aiguë réversible liée à la perfusion5 |
Troubles du métabolisme et de la nutrition |
| hyperglycémie, perte de poids, œdème périphérique, œdème du visage, augmentation des LDH, hypocalcémie |
|
|
|
|
Affections psychiatriques |
|
| dépression, nervosité |
|
|
|
Affections du système nerveux |
| paresthésies, hypoesthésie, agitation, insomnie, vasodilatation, vertiges, anxiété | dysgueusie |
| neuropathie périphérique, | neuropathie crânienne, |
Affections oculaires |
| troubles lacrymaux, conjonctivite |
|
| perte sévère de la vision6 |
|
Affections de l’oreille et du labyrinthe |
| acouphènes, otalgie |
|
|
| perte de l’audition6 |
Affections cardiaques |
| + infarctus du myocarde5,7, arythmie, | + insuffisance ventriculaire gauche, | troubles cardiaques sévères5,7 | insuffisance cardiaque5,7 |
|
Affections vasculaires |
| hypertension, hypotension orthostatique, hypotension |
|
| vascularite (à prédominance cutanée), |
|
Affections respiratoires, thoraciques et médiastinales |
| Bronchospasme5, troubles respiratoires, douleurs thoraciques, dyspnée, toux accrue, rhinite | asthme, bronchiolite oblitérante, troubles pulmonaires, hypoxie | pneumopathie interstitielle8 | insuffisance respiratoire5 | infiltrats pulmonaires |
Affections gastro-intestinales | nausées | vomissements, diarrhées, douleurs abdominales, dysphagie, stomatite, constipation, dyspepsie, anorexie, irritation laryngée | dilatation abdominale |
| perforation gastro-intestinale8 |
|
Affections de la peau et du tissu sous-cutané | prurit, rash, +alopécie | urticaire, sudation, sueurs nocturnes, +affections cutanées |
|
| réactions cutanées bulleuses sévères, syndrome de Stevens-Johnson, |
|
Affections musculo-squelettiques et systémiques |
| hypertonie, myalgie, arthralgie, douleurs dorsales, douleurs cervicales, douleurs |
|
|
|
|
Affections du rein et des voies urinaires |
|
|
|
| insuffisance rénale5 |
|
Troubles généraux et anomalies au site d’administration | fièvre, frissons, asthénie, céphalées | douleurs d’origine tumorale, bouffées vasomotrices, malaise, rhume, +fatigue, +tremblements, +défaillance multi-viscérale5 | douleurs au site de perfusion |
|
|
|
Investigations | diminution des taux d’IgG |
|
|
|
|
|
Pour chacun des termes, le calcul de la fréquence a été basé sur les effets de tous grades (de peu grave à grave), excepté pour les termes avec la marque "+" où la fréquence était basée sur les effets graves (≥ au grade 3 des critères de toxicité courants de l’Institut National de cancérologie (NCI)). Seules les fréquences les plus élevées observées lors des études cliniques ont été rapportées. | ||||||
Les événements suivants, rapportés comme effets indésirables durant les études cliniques, ont été rapportés selon une incidence similaire ou moindre dans le groupe MabThera comparé au groupe contrôle : hématotoxicité, infection neutropénique, infection des voies urinaires, troubles sensoriels, pyrexie.
Des signes et symptômes suggérant une réaction liée à la perfusion ont été rapportés chez plus de 50 % des patients au cours des études cliniques, et ont principalement été observés lors de la première perfusion, habituellement dans les deux premières heures. Ces symptômes comprenaient principalement fièvre, frissons et tremblements. D’autres symptômes ont inclus bouffées vasomotrices, angio-œdème, bronchospasme, vomissements, nausées, urticaire/rash, fatigue, céphalées, irritation laryngée, rhinite, prurit, douleur, tachycardie, hypertension, hypotension, dyspnée, dyspepsie, asthénie et symptômes évocateurs du syndrome de lyse tumorale. Des réactions sévères liées à la perfusion (telles que bronchospasme, hypotension) sont survenues au maximum dans 12 % des cas. D’autres réactions ont été rapportées : infarctus du myocarde, fibrillation auriculaire, œdème pulmonaire et thrombopénie aiguë réversible. Des exacerbations de troubles cardiaques pré-existants tels que angine de poitrine, insuffisance cardiaque congestive ou troubles cardiaques sévères (insuffisance cardiaque, infarctus du myocarde, fibrillation auriculaire), œdème pulmonaire, défaillance multi-viscérale, syndrome de lyse tumorale, syndrome de relargage des cytokines, insuffisance rénale et insuffisance respiratoire ont été rapportés à des fréquences plus faibles ou pas connues. L’incidence des symptômes liés à la perfusion a considérablement diminué lors des perfusions ultérieures pour atteindre moins de 1% à la huitième cure de MabThera.
Description de certains effets indésirables
Infections
MabThera induit une déplétion en lymphocytes B chez environ 70 à 80 % des patients, mais est associé à une diminution du taux sérique d’immunoglobulines seulement chez une minorité de patients.
Des infections localisées à Candida ainsi que des zonas ont été rapportés avec une incidence plus élevée dans le groupe MabThera lors des études randomisées. Des infections sévères ont été rapportées chez environ 4 % des patients traités par MabThera en monothérapie. Des fréquences plus élevées d’infections, incluant les infections de grade 3 ou 4, ont été observées avec MabThera en traitement d’entretien jusqu’à 2 ans comparé au groupe observation. Aucune toxicité cumulative en termes d’infections n’a été rapportée sur les 2 ans de la période d’entretien. De plus, d’autres infections virales graves, nouvelles, réactivées ou exacerbées, dont certaines ont été fatales, ont été rapportées lors de traitement par MabThera. La plupart des patients ont reçu MabThera en association à une chimiothérapie ou dans le cadre d’une greffe de cellules souches hématopoïétiques. Ces infections virales graves sont par exemple des infections à Herpes Virus (Cytomegalovirus, Herpesvirus Varicellae, et Herpes Simplex Virus), à virus JC (Leucoencéphalopathie Multifocale Progressive (LEMP)), entérovirus (méningo-encéphalite) et au virus de l’hépatite C (voir rubrique 4.4). Des cas de LEMP fatale ont également été rapportés après une progression de la maladie et un retraitement dans les études cliniques. Des cas de réactivation d’hépatite B ont été rapportés, la majorité d’entre eux était survenue chez les patients traités par MabThera en association à une chimiothérapie cytotoxique. Chez les patients atteints de LLC en rechute ou réfractaires, l’incidence des hépatites B de grade 3/4 (réactivation et primo-infection) a été de 2 % dans le groupe R-FC versus 0 % dans le groupe FC. Une progression du sarcome de Kaposi a été observée chez des patients ayant un sarcome de Kaposi pré-existant et exposés à MabThera. Ces cas sont survenus dans des indications non approuvées et la majorité de ces patients étaient VIH-positif.
Effets indésirables hématologiques
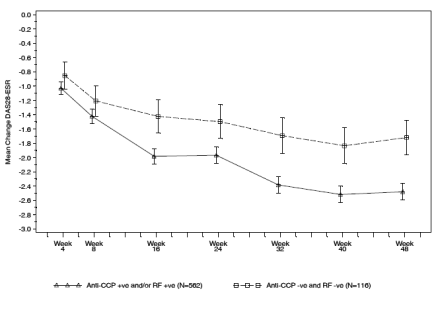
Lors des études cliniques avec MabThera en monothérapie pendant 4 semaines, des anomalies hématologiques, habituellement discrètes et réversibles, sont survenues chez une minorité de patients. Une neutropénie sévère (grade 3/4) a été rapportée chez 4,2 % des patients, une anémie chez 1,1 % des patients et une thrombopénie chez 1,7 % des patients. Lors de la phase d’entretien par MabThera jusqu’à 2 ans, une leucopénie (5 % vs 2 %, de grade 3/4) et une neutropénie (10 % vs 4 %, de grade 3/4) ont été rapportées avec une incidence plus élevée comparée au groupe observation. L’incidence des thrombopénies était faible (< 1 %, grade 3/4) et n’était pas différente entre les groupes de traitement. Au cours du traitement, dans les études cliniques avec MabThera en association à une chimiothérapie, une leucopénie de grade 3/4 (R-CHOP 88 % vs CHOP 79 %, R-FC 23 % vs FC 12 %), une neutropénie de grade 3/4 (R-CVP 24 % vs CVP 14 % ; R-CHOP 97 % vs CHOP 88 %, R-FC 30 % vs FC 19 % chez les patients LLC non précédemment traités), une pancytopénie de grade 3 / 4 (R-FC 3 % vs FC 1 % chez les patients LLC non précédemment traités) ont été généralement rapportées avec des fréquences plus élevées comparées à la chimiothérapie seule. Cependant, l’incidence plus élevée de neutropénie chez les patients traités avec MabThera et une chimiothérapie n’était pas associée à une incidence plus élevée d’infections et d’infestations comparée aux patients traités avec une chimiothérapie seule. Les études chez les patients LLC non précédemment traités et en rechute ou réfractaires ont mis en évidence, chez au maximum 25% des patients traités par R-FC, une neutropénie prolongée (définie par un nombre de neutrophiles restant inférieur à 1 x 109/l entre les 24e et 42e jours suivant la dernière perfusion) ou ayant un délai de survenue tardif (défini par un nombre de neutrophiles inférieur à 1 x 109/l survenant plus de 42 jours après la dernière perfusion chez des patients n’ayant pas précédemment présenté de neutropénie prolongée ou ayant présenté une neutropénie normalisée en moins de 42 jours) après un traitement par MabThera associé à FC. Aucune différence n’a été rapportée dans l’incidence des anémies. Des cas de neutropénies tardives sont survenus plus de quatre semaines après la dernière perfusion de MabThera. Dans l’étude en première ligne de traitement dans la LLC, les patients ayant un stade C de Binet dans le groupe R-FC ont présenté plus d’effets indésirables que ceux du groupe FC (R-FC 83% vs FC 71%). Dans l’étude LLC en rechute ou réfractaire, des thrombopénies de grade 3/4 ont été rapportées chez 11 % des patients du groupe R-FC, comparées à 9 % des patients du groupe FC.
Dans les études avec MabThera chez des patients atteints de macroglobulinémie de Waldenström, des augmentations transitoires des taux sériques d’IgM, qui peuvent être associées à un syndrome d’hyperviscosité et aux symptômes correspondants, ont été observées après l’initiation du traitement. En général, l’augmentation transitoire des IgM est revenue au moins au taux basal dans les quatre mois.
Effets indésirables cardio-vasculaires
Lors des études cliniques avec MabThera en monothérapie, des réactions cardio-vasculaires ont été rapportées chez 18,8 % des patients avec comme événements les plus fréquemment rapportés une hypotension et une hypertension. Des arythmies de grade 3 ou 4 (incluant des tachycardies ventriculaires et supra-ventriculaires) et des angines de poitrine ont été rapportées lors de la perfusion. Lors du traitement d’entretien, l’incidence des troubles cardiaques de grade 3/4 a été comparable entre les patients traités avec MabThera et le groupe observation. Des événements cardiaques ont été rapportés comme événements indésirables graves (incluant fibrillation auriculaire, infarctus du myocarde, insuffisance ventriculaire gauche, ischémie cardiaque) chez 3 % des patients traités avec MabThera comparés à moins de 1 % dans le groupe observation. Lors des études évaluant MabThera en association à une chimiothérapie, l’incidence des arythmies de grade 3 à 4, principalement des arythmies supraventriculaires telles que tachycardie et flutter/fibrillation auriculaire, a été plus élevée dans le groupe R-CHOP (14 patients, 6,9%) que dans le groupe CHOP (3 patients, 1,5%). Toutes ces arythmies étaient survenues soit pendant la perfusion de MabThera, soit étaient associées à des facteurs de prédisposition tels que fièvre, infections, infarctus aigu du myocarde ou à des pathologies respiratoires et cardio-vasculaires pré-existantes. Aucune différence entre les groupes R-CHOP et CHOP n’a été observée en ce qui concerne l’incidence des autres événements cardiaques de grade 3 à 4 incluant insuffisance cardiaque, myocardiopathie et manifestations de coronaropathie. Dans la LLC, l’incidence globale des troubles cardiaques de grade 3 et 4 était faible dans l’étude en première ligne (R-FC 4 % vs FC 3 %) et dans celle en rechute ou réfractaire (R-FC 4 % vs FC 4 %).
Système respiratoire
Des cas de maladie interstitielle pulmonaire, dont certains d’issue fatale, ont été rapportés.
Troubles neurologiques
Pendant la période de traitement (phase d’induction comprenant R-CHOP pendant au maximum huit cycles), 4 patients (2 %) du groupe R-CHOP ayant tous des facteurs de risque cardio-vasculaire ont présenté des accidents vasculaires cérébraux thromboemboliques pendant le premier cycle de traitement. Aucune différence n’a été observée entre les deux groupes en ce qui concerne l’incidence des autres événements thromboemboliques. A contrario, 3 patients (1,5 %) du groupe CHOP ont présenté des événements vasculaires cérébraux qui se sont tous produits pendant la période de suivi. Dans la LLC, l’incidence globale des troubles du système nerveux de grade 3 et 4 était faible dans l’étude en première ligne (R-FC 4 % vs FC 4 %) et dans celle en rechute ou réfractaire (R-FC 3 % vs FC 3 %).
Des cas de syndrome d’encéphalopathie postérieure réversible (SEPR) / syndrome de leucoencéphalopathie postérieure réversible (SLPR) ont été rapportés. Les signes et symptômes comprenaient des troubles visuels, céphalées, convulsions et altération mentale, avec ou sans hypertension associée. Un diagnostic de SEPR/SLPR nécessite une confirmation par imagerie cérébrale. Les cas rapportés présentaient des facteurs de risque connus de SEPR/SLPR dont la maladie sous-jacente des patients, l’hypertension, le traitement immunosuppresseur et/ou la chimiothérapie.
Affections gastro-intestinales
Des cas de perforation gastro-intestinale, conduisant dans certains cas au décès, ont été observés chez des patients recevant MabThera pour le traitement d’un lymphome non-hodgkinien. Dans la majorité de ces cas, MabThera était associé à une chimiothérapie.
Taux sériques des IgG
Dans les études cliniques évaluant MabThera en traitement d’entretien dans le lymphome folliculaire réfractaire ou en rechute, les taux sériques médians d’IgG étaient en-dessous de la limite inférieure de la normale (< 7 g/l) après le traitement d’induction dans les deux groupes observation et MabThera. Dans le groupe observation, le taux sérique médian des IgG est ensuite monté au-dessus de la limite inférieure de la normale, alors qu’il est demeuré constant dans le groupe MabThera. La proportion de patients présentant des taux sériques d’IgG en-dessous de la limite inférieure de la normale était d’environ 60 % durant les 2 ans de traitement dans le groupe traité par MabThera, alors qu’elle a diminué dans le groupe observation (36 % après 2 ans).
Un petit nombre de cas d’hypogammaglobulinémie rapportés de manière spontanée ou issus de la littérature a été observé chez des enfants traités par MabThera, dans certains cas sévères et nécessitant un traitement de substitution à long terme par immunoglobulines. Les conséquences de la déplétion en lymphocytes B à long terme chez les enfants ne sont pas connues.
Affections de la peau et du tissu sous-cutané
Des cas de syndrome de Lyell (nécrolyse épidermique toxique) et de syndrome de Stevens-Johnson, dont certains d’issue fatale, ont été très rarement rapportés.
Populations particulières de patients - MabThera en monothérapie
Patients âgés ( 65 ans) :
L'incidence des effets indésirables de tous grades ainsi que des effets indésirables de grade 3 / 4 était similaire chez les patients âgés comparée aux patients jeunes (< 65 ans).
Forte masse tumorale
L’incidence des effets indésirables de grade 3 / 4 a été plus élevée chez les patients présentant une forte masse tumorale que chez les patients n'ayant pas de forte masse tumorale (25,6 % versus 15,4 %). L'incidence des effets indésirables de tous grades a été comparable dans les deux groupes.
Retraitement
Dans la population retraitée par MabThera, le pourcentage de patients ayant rapporté un effet indésirable a été comparable à celui observé dans la population de patients traitée une première fois (pour les effets indésirables de tous grades et ceux de grade 3 / 4).
Populations particulières de patients - MabThera en association
Patients âgés ( 65 ans)
L’incidence des effets indésirables hématologiques/lymphatiques de grade 3/4 était plus élevée chez les patients âgés comparée aux patients plus jeunes (< 65 ans), dans la LLC non précédemment traitée, en rechute ou réfractaire.
Expérience acquise en pédiatrie dans le/la LDGCB/LB/LA-B/LB-like
Résumé du profil de sécurité
Une étude multicentrique, randomisée, en ouvert, évaluant la chimiothérapie de type Lymphome Malin B (LMB) seule ou en association avec MabThera a été conduite chez des patients pédiatriques (âgés de ≥ 6 mois à < 18 ans) non précédemment traités présentant à un stade avancé un(e) LDGCB CD20 positif/LB/LA-B/LB-like.
Au total, 309 patients pédiatriques ont reçu MabThera et ont été inclus dans la population évaluée pour la tolérance. Les patients pédiatriques randomisés dans le bras chimiothérapie de type LMB avec MabThera ou inclus dans la partie monobras de l’étude ont reçu MabThera à une dose de 375 mg/m2 de surface corporelle et ils ont reçu un total de six perfusions IV de MabThera (deux perfusions au cours de chacune des deux cures d’induction et une perfusion au cours de chacune des deux cures de consolidation du schéma de chimiothérapie de type LMB).
Le profil de tolérance de MabThera chez les patients pédiatriques (âgés de ≥ 6 mois à < 18 ans) non précédemment traités présentant à un stade avancé un(e) LDGCB CD20 positif/LB/LA-B/LB-like a été généralement cohérent en termes de type, nature et sévérité avec le profil de tolérance connu chez les patients adultes atteints d’un LNH ou d’une LLC. L’association de MabThera à la chimiothérapie a présenté un risque plus élevé de survenue de certains événements, dont des infections (y compris des septicémies), comparée à la chimiothérapie seule.
Expérience acquise dans la polyarthrite rhumatoïde
Résumé du profil de sécurité d’emploi
Le profil général de tolérance de MabThera dans la polyarthrite rhumatoïde est issu de données acquises chez des patients au cours des études cliniques et depuis la commercialisation.
Le profil de tolérance de MabThera chez des patients atteints de polyarthrite rhumatoïde sévère est résumé dans les rubriques ci-après. Au cours des essais cliniques, plus de 3100 patients ont reçu au moins un traitement et ont été suivis pendant des périodes allant de 6 mois à plus de 5 ans ; environ 2400 patients ont reçu deux cycles de traitement ou plus dont plus de 1000 ont reçu au moins 5 cycles. Les données de tolérance collectées sur MabThera depuis sa commercialisation reflètent le profil d’effets indésirables attendu tel que décrit dans les études cliniques de MabThera (voir rubrique 4.4).
Les patients ont reçu 2 x 1000 mg de MabThera à deux semaines d’intervalle, ainsi que du méthotrexate (10-25 mg/semaine). Les perfusions de MabThera ont été administrées après une perfusion intraveineuse de 100 mg de méthylprednisolone ; la majorité des patients a également reçu un traitement par prednisone orale pendant 15 jours.
Liste tabulée des effets indésirables
Les effets indésirables sont listés dans le Tableau 4. Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000) et non connue (ne peut être estimée à partir des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Les effets indésirables les plus fréquents considérés comme liés à l’administration de MabThera ont été les RLPs. L’incidence globale des réactions liées à la perfusion dans les essais cliniques a été de 23% lors de la première perfusion et a diminué lors des perfusions ultérieures. Les réactions graves liées à la perfusion ont été peu fréquentes (0,5% des patients) et ont été observées principalement lors du 1er cycle. Outre les effets indésirables observés lors des essais cliniques PR avec MabThera, des leucoencéphalopathies multifocales progressives (LEMP) (voir rubrique 4.4) ainsi que des réactions de type sérique ont été rapportées depuis la commercialisation de MabThera.
Tableau 4 Résumé des effets indésirables survenant chez des patients atteints de polyarthrite rhumatoïde traités par MabThera au cours des études cliniques et depuis la commercialisation
MedDRA | Très fréquent | Fréquent
| Peu fréquent | Rare | Très rare | Non connue |
Infections et infestations | infections des voies respiratoires hautes, infections des voies urinaires | bronchite, sinusite, gastroentérite, pied d’athlète |
|
| LEMP, réactivation d’hépatite B | infections virales graves1, méningo-encéphalite à entérovirus2 |
Affections hématologiques et du système lymphatique |
| Neutropénie3 |
| neutropénie tardive4 | réaction de type maladie sérique |
|
Affections du système immunitaire | 5réactions liées à la perfusion (hypertension, nausées, rash, fièvre, prurit, urticaire, irritation pharyngée, bouffées vasomotrices, hypotension, rhinite, frissons, tachycardie, fatigue, douleur oropharyngée, œdème périphérique, érythème) |
| 5réactions liées à la perfusion (œdème généralisé, bronchospasme, sifflements respiratoires, œdème laryngé, œdème de Quincke, prurit généralisé, anaphylaxie, réactions anaphylactoïdes) |
|
|
|
Troubles généraux et anomalies au site d’administration |
|
|
| |||
Troubles du métabolisme et de la nutrition |
| hypercholestérolémie |
|
|
|
|
Affections psychiatriques |
| dépression, anxiété |
|
|
|
|
Affections du système nerveux | céphalée | paresthésies, migraine, étourdissement, sciatique |
|
|
|
|
Affections cardiaques |
|
|
| angine de poitrine, fibrillation auriculaire, insuffisance cardiaque, infarctus du myocarde | flutter auriculaire |
|
Affections gastro-intestinales |
| dyspepsie, diarrhée, reflux gastro-œsophagien, ulcération buccale, douleur abdominale haute |
|
|
|
|
Affections de la peau et du tissu sous-cutané |
| alopécie |
|
| nécrolyse épidermique toxique (syndrome de Lyell), syndrome de Stevens-Johnson7 |
|
Affections musculo-squelettiques et systémiques |
| arthralgie/douleurs ostéo-musculaires, arthrose, bursite |
|
|
|
|
Investigations | diminution des taux d’IgM6 | diminution des taux d’IgG6 |
|
|
|
|
1 Voir également la section Infections ci-dessous. | ||||||
Retraitement
Le profil de tolérance de retraitement des patients est similaire à celui observé après le traitement initial. Le taux de tous les effets indésirables survenus après une première exposition à MabThera a été plus élevé durant les six premiers mois, puis a diminué. Ceci est principalement dû aux RLPs (effets indésirables les plus fréquents au cours du premier cycle de traitement), à l’exacerbation de la polyarthrite rhumatoïde et aux infections qui ont été plus fréquentes durant les 6 premiers mois de traitement.
Description de certains effets indésirables
Réactions liées à la perfusion
Les effets indésirables les plus fréquents suivant l’administration de MabThera au cours des essais cliniques ont été les RLPs (cf. tableau 4). Parmi les 3189 patients traités par MabThera, 1135 (36%) ont présenté au moins une réaction liée à la perfusion, avec 733/3189 (23%) des patients présentant une réaction liée à la perfusion après la première perfusion du traitement initial. L’incidence des RLPs diminuait avec les perfusions ultérieures. Au cours des essais cliniques, moins de 1% (17/3189) des patients ont eu une réaction grave liée à la perfusion. Aucun décès, ni événement CTC de grade 4 lié à une réaction à la perfusion n’a été observé dans les essais cliniques. La proportion d’événements CTC de grade 3, ainsi que des réactions liées à la perfusion ayant conduit à un arrêt de traitement, a diminué avec le nombre de perfusions et a été rare à partir de 3 cycles de traitement. La prémédication avec un glucocorticoïde par voie intraveineuse a réduit significativement l’incidence et la sévérité des réactions liées à la perfusion (voir les rubriques 4.2 et 4.4). Des RLPs sévères d’évolution fatale ont été rapportées depuis la commercialisation.
Dans un essai destiné à évaluer la sécurité d’une perfusion plus rapide de MabThera chez des patients atteints de polyarthrite rhumatoïde, les patients atteints de polyarthrite rhumatoïde active modérée à sévère qui n’ont pas présenté de RLP grave durant ou dans les 24 heures suivant leur première perfusion, étaient autorisés à recevoir une perfusion intraveineuse de MabThera de 2 heures. Les patients ayant un antécédent de réaction grave liée à la perfusion de traitement biologique de la polyarthrite rhumatoïde étaient exclus de l’étude. L’incidence, les types et la sévérité des RLPs étaient conformes à ceux observés antérieurement. Aucune RLP grave n’a été observée.
Infections
Le taux global d’infection sous MabThera rapporté lors des essais cliniques a été d’environ 94 pour 100 patient-années. Les infections étaient principalement légères à modérées et étaient principalement des infections respiratoires hautes et des infections urinaires. L'incidence des infections graves ou ayant nécessité des antibiotiques par voie intraveineuse, a été environ de 4 pour 100 patient-années. Il n’y a pas eu d’augmentation significative du taux d’infection grave après plusieurs cycles de MabThera. Des infections des voies respiratoires basses (y compris pneumonie) ont été rapportées durant les essais cliniques, avec une incidence similaire dans les bras MabThera et dans les bras contrôle.
Depuis la commercialisation, des infections virales graves ont été rapportées chez des patients atteints de polyarthrite rhumatoïde traités par le rituximab.
Des cas de leucoencéphalopathie multifocale progressive avec issue fatale ont été rapportés après utilisation de MabThera dans le traitement de maladies auto-immunes. Celles-ci incluent la polyarthrite rhumatoïde et des maladies auto-immunes hors AMM dont le lupus érythémateux disséminé (LED) et les vascularites.
Des cas de réactivation d’une hépatite B ont été rapportés chez des patients atteints d’un lymphome non-hodgkinien traités par MabThera en association à une chimiothérapie cytotoxique (voir lymphomes non hodgkiniens). Des réactivations d’infection d’hépatite B ont aussi été très rarement rapportées chez des patients atteints de polyarthrite rhumatoïde traités par MabThera (voir rubrique 4.4).
Effets indésirables cardio-vasculaires
Un taux de 1,3 pour 100 patient-années d’effets cardiaques graves a été rapporté chez les patients traités par MabThera comparé à un taux de 1,3 pour 100 patient-années chez les patients ayant reçu le placebo. La proportion de patients ayant présenté des effets cardiaques (graves ou non) n’a pas augmenté avec le nombre de cycles de traitement.
Evénements neurologiques
Des cas de syndrome d’encéphalopathie postérieure réversible (SEPR) / syndrome de leucoencéphalopathie postérieure réversible (SLPR) ont été rapportés. Les signes et symptômes comprenaient des troubles visuels, céphalées, convulsions et altération mentale, avec ou sans hypertension associée. Un diagnostic de SEPR/SLPR nécessite une confirmation par imagerie cérébrale. Les cas rapportés présentaient des facteurs de risque connus de SEPR/SLPR dont la maladie sous-jacente des patients, l’hypertension, le traitement immunosuppresseur et/ou la chimiothérapie.
Neutropénie
Des cas de neutropénie associés au traitement par MabThera ont été observés, la majorité d’entre eux ayant été transitoires et d’intensité légère à modérée. Une neutropénie peut survenir plusieurs mois après l’administration de MabThera (voir rubrique 4.4).
Dans la période des essais cliniques contrôlée versus placebo, 0,94% (13/1382) des patients traités par MabThera et 0,27% (2/731) des patients sous placebo ont présenté une neutropénie sévère.
Des cas de neutropénie, y compris des cas de neutropénie sévère tardive et persistante, ont été rarement rapportés depuis la commercialisation, certains d’entre eux ont été associés à des infections d’évolution fatale.
Affections de la peau et du tissu sous-cutané
Des cas de syndrome de Lyell (nécrolyse épidermique toxique) et de syndrome de Stevens-Johnson, dont certains d’issue fatale, ont été très rarement rapportés.
Anomalies des paramètres biologiques
Une hypogammaglobulinémie (IgG ou IgM en dessous de la limite inférieure de la normale) a été observée chez des patients PR traités par MabThera. Globalement il n’a pas été observé d’augmentation du taux d’infections ou d’infections graves après la survenue d’un taux bas des IgG ou IgM (voir rubrique 4.4).
Un petit nombre de cas d’hypogammaglobulinémie rapportés de manière spontanée ou issus de la littérature a été observé chez des enfants traités par MabThera, dans certains cas sévères et nécessitant un traitement de substitution à long terme par immunoglobulines. Les conséquences de la déplétion en lymphocytes B à long terme chez les enfants ne sont pas connues.
Expérience acquise dans la granulomatose avec polyangéite (GPA) et la polyangéite microscopique (PAM)
Induction de la rémission chez l’adulte (Etude 1 GPA/PAM)
Dans l’étude clinique 1 dans la GPA/PAM, 99 patients adultes ont été traités pour une induction de la rémission d’une GPA et d’une PAM avec MabThera (375 mg/m2, une fois par semaine pendant 4 semaines) et des glucocorticoïdes (voir rubrique 5.1).
Les effets indésirables indiqués dans le Tableau 5 sont tous les événements indésirables survenus avec une incidence ≥ 5 % dans le groupe ayant reçu MabThera et à une fréquence plus importante que pour le comparateur.
Tableau 5 Effets indésirables survenus à 6 mois chez ≥ 5 % des patients adultes traités par MabThera lors de l’étude clinique 1 dans la GPA/PAM (Rituximab n=99, à une fréquence plus importante que pour le comparateur), ou dans le cadre de la surveillance depuis la commercialisation.
MedDRA Classe de systèmes d’organes | Fréquence |
Infections et infestations | |
Infections des voies urinaires | 7% |
Bronchites | 5% |
Zona | 5% |
Rhinopharyngites | 5% |
Infections virales graves1,2 | non connue |
Méningo-encéphalite à entérovirus1 | non connue |
Affections hématologiques et du système lymphatique | |
Thrombopénie | 7% |
Affections du système immunitaire | |
Syndrome de relargage des cytokines | 5% |
Troubles du métabolisme et de la nutrition | |
Hyperkaliémie | 5% |
Affections psychiatriques | |
Insomnie | 14% |
Affections du système nerveux | |
Vertiges | 10% |
Tremblements | 10% |
Affections vasculaires | |
Hypertension | 12% |
Bouffées vasomotrices | 5% |
Affections respiratoires, thoraciques et médiastinales | |
Toux | 12% |
Dyspnée | 11% |
Epistaxis | 11% |
Congestion nasale | 6% |
Affections gastro-intestinales | |
Diarrhée | 18% |
Dyspepsie | 6% |
Constipation | 5% |
Affection de la peau et des tissus sous-cutanés | |
Acné | 7% |
Affections musculo-squelettiques et systémiques | |
Spasmes musculaires | 18% |
Arthralgies | 15% |
Douleurs dorsales | 10% |
Faiblesse musculaire | 5% |
Douleurs musculo-squelettiques | 5% |
Douleurs aux extrémités | 5% |
Troubles généraux et anomalies au site d’administration | |
Œdèmes périphériques | 16% |
Investigations | |
Diminution de l’hémoglobine | 6% |
1Observées dans le cadre de la surveillance depuis la commercialisation.
2Voir également la section Infections ci-dessous.
Traitement d’entretien chez l’adulte (Etude 2 GPA/PAM)
Dans l’étude clinique 2 dans la GPA/PAM, 57 patients adultes atteints de formes actives et sévères de GPA et de PAM ont été traités par MabThera pour l’entretien de la rémission (voir rubrique 5.1).
Tableau 6 Effets indésirables survenus chez ≥ 5 % des patients adultes ayant reçu MabThera lors de l’étude clinique 2 dans la GPA/PAM (Rituximab n=57), à une fréquence plus importante que pour le comparateur, ou dans le cadre de la surveillance depuis la commercialisation.
MedDRA Classe de systèmes d’organes | Fréquence |
Infections et infestations |
|
Bronchite | 14% |
Rhinite | 5% |
Infections virales graves1 | non connue |
Méningo-encéphalite à entérovirus1 | non connue |
Affections respiratoires, thoraciques et | |
Dyspnée | 9% |
Affections gastro-intestinales | |
Diarrhée | 7% |
Troubles généraux et anomalies au site d'administration |
|
Pyrexie | 9% |
Syndrome grippal | 5% |
Œdème périphérique | 5% |
Lésions, intoxications et complications d'interventions |
|
Réactions liées à la perfusion3 | 12% |
1 Observées dans le cadre de la surveillance depuis la commercialisation. | |
Le profil général de tolérance était conforme au profil de tolérance établi pour MabThera dans les indications de maladies auto-immunes approuvées, y compris la GPA et la PAM. Dans l'ensemble, 4 % des patients du groupe ayant reçu MabThera ont présenté des événements indésirables entraînant l’arrêt du traitement. Pour ce groupe de patients, la plupart des événements indésirables étaient d'intensité légère ou modérée et aucun patient n'a présenté d’événements indésirables d’évolution fatale.
Les réactions liées à la perfusion et les infections ont été les événements considérés comme des effets indésirables les plus fréquemment rapportés.
Suivi à long terme (Etude 3 GPA/PAM)
Dans une étude observationnelle sur la tolérance menée à long terme, 97 patients atteints de GPA et de PAM ont reçu un traitement par MabThera (moyenne de 8 perfusions [intervalle de 1-28]) pendant une période maximale de 4 ans, selon la pratique habituelle de leur médecin et à la discrétion de celui-ci. Le profil général de tolérance était conforme au profil de tolérance bien établi de MabThera dans la polyarthrite rhumatoïde, la GPA et la PAM, et aucun effet indésirable nouveau n'a été rapporté.
Population pédiatrique
Une étude en ouvert à un seul bras a été conduite chez 25 patients pédiatriques atteints d’une forme sévère et active de GPA ou de PAM. L’ensemble de la période de l’étude comprenait une phase d’induction de la rémission de 6 mois avec un suivi d’au moins 18 mois, pouvant durer jusqu’à 4,5 ans. Pendant la phase de suivi, MabThera a été administré à la discrétion de l’investigateur (17 patients sur 25 ont reçu un traitement supplémentaire par MabThera). L’administration concomitante d’un autre traitement immunosuppresseur était autorisée (voir rubrique 5.1).
Les effets indésirables correspondent à tous les événements indésirables survenus avec une incidence ≥ 10 %, à savoir : infections (17 patients [68 %] dans la phase d’induction de la rémission ; 23 patients [92 %] sur l’ensemble de la période de l’étude), RLPs (15 patients [60 %] dans la phase d’induction de la rémission ; 17 patients [68 %] sur l’ensemble de la période de l’étude), et nausées (4 patients [16 %] dans la phase d’induction de la rémission ; 5 patients [20 %] sur l’ensemble de la période de l’étude).
Sur l’ensemble de la période de l’étude, le profil de tolérance de MabThera était conforme à celui rapporté pendant la phase d’induction de la rémission.
Le profil de tolérance de MabThera chez les patients pédiatriques atteints de GPA ou de PAM était conforme en termes de type, de nature et de sévérité au profil de tolérance connu chez les patients adultes dans les indications auto-immunes autorisées, y compris les adultes atteints de GPA ou de PAM.
Description des effets indésirables sélectionnés
Réactions liées à la perfusion
Dans l’étude clinique 1 dans la GPA/PAM (étude de l’induction de la rémission chez l’adulte), les RLPs ont été définies comme tout événement indésirable survenu dans les 24 heures suivant une perfusion et considéré comme lié à la perfusion par les investigateurs dans la population évaluée pour la tolérance. Sur les 99 patients traités par MabThera, 12 (12 %) ont présenté au moins une réaction liée à la perfusion. Toutes les réactions liées à la perfusion ont été de grade 1 ou 2 selon la classification CTC. Les réactions liées à la perfusion les plus fréquemment observées ont été les suivantes : syndrome de relargage des cytokines, bouffées vasomotrices, irritation de la gorge et tremblements. MabThera a été administré en association aux glucocorticoïdes intraveineux, qui ont pu réduire l’incidence et la sévérité de ces événements.
Dans l'étude clinique 2 dans la GPA/PAM (étude du traitement d’entretien chez l’adulte), 7/57 patients (12 %) du groupe ayant reçu MabThera ont présenté au moins une réaction liée à la perfusion. L'incidence des symptômes des RLPs était plus élevée pendant ou après la première perfusion (9 %) et diminuait avec les perfusions suivantes (< 4 %). Tous les symptômes des RLPs étaient légers ou modérés et la plupart d'entre eux ont été rapportés dans les classes de systèmes d’organes des affections respiratoires, thoraciques et médiastinales et des affections de la peau et du tissu sous-cutané.
Dans l’essai clinique conduit chez des patients pédiatriques atteints de GPA ou de PAM, les RLPs rapportées ont été principalement observées lors de la première perfusion (8 patients [32 %]), puis ont diminué avec le temps, avec les perfusions suivantes de MabThera (20 % avec la deuxième perfusion, 12 % avec la troisième perfusion et 8 % avec la quatrième perfusion). Les symptômes de RLP les plus fréquemment rapportés pendant la phase d’induction de la rémission étaient les suivants : céphalées, éruption cutanée, rhinorrhée et pyrexie (8 % pour chaque symptôme). Les symptômes de RLP observés étaient similaires à ceux connus chez les patients adultes atteints de GPA ou de PAM traités par MabThera. La majorité des RLPs était de grade 1 et 2, il y a eu deux RLPs de grade 3 non graves, et aucune RLP de grade 4 ou 5 n’a été rapportée. Une RLP de grade 2 grave (œdème généralisé résolu avec un traitement) a été rapportée chez un patient (voir rubrique 4.4).
Infections
Dans l’étude clinique 1 dans la GPA/PAM, le taux global d’infections a été d’environ 237 pour 100 patient-années (IC à 95 % : 197-285) à 6 mois. Les infections le plus souvent de sévérité légère à modérée, ont été principalement des infections des voies respiratoires supérieures, un zona et des infections des voies urinaires. Le taux d’infections graves a été d’environ 25 pour 100 patient-années. L’infection grave la plus fréquemment rapportée dans le groupe MabThera a été la pneumonie qui est survenue à une fréquence de 4 %.
Dans l'étude clinique 2 dans la GPA/PAM, 30/57 des patients (53%) du groupe ayant reçu MabThera ont présenté des infections. L'incidence des infections de tout grade était semblable d'un groupe à l'autre. Les infections étaient principalement légères à modérées. Les infections les plus courantes dans le groupe ayant reçu MabThera comprenaient les infections des voies respiratoires supérieures, les gastro-entérites, les infections des voies urinaires et le zona. L'incidence des infections graves était semblable dans les deux groupes (environ 12 %). L'infection grave la plus souvent rapportée dans ce groupe était une bronchite légère ou modérée.
Dans l’essai clinique mené chez les patients pédiatriques atteints d’une forme sévère et active de GPA ou de PAM, 91 % des infections rapportées étaient non graves et 90 % étaient légères à modérées.
Les infections les plus fréquentes dans l’ensemble de la période de l’étude étaient les suivantes : infections des voies aériennes supérieures (48 %), grippe (24 %), conjonctivite (20%), rhinopharyngite (20 %), infections des voies aériennes inférieures (16 %), sinusite (16 %), infections virales des voies aériennes supérieures (16%), infection auriculaire (12 %), gastro-entérite (12 %), pharyngite (12 %) et infection des voies urinaires (12 %). Des infections graves ont été rapportées chez 7 patients (28 %), les événements les plus fréquemment rapportés étant une grippe (2 patients [8 %]) et une infection des voies aériennes inférieures (2 patients [8 %]).
Depuis la commercialisation, des infections virales graves ont été rapportées chez des patients atteints de GPA/PAM traités par le rituximab.
Affections malignes
Dans l’étude clinique 1 dans la GPA/PAM, l’incidence des affections malignes chez les patients traités par MabThera a été de 2,00 pour 100 patient-années à la date de clôture générale de l’étude (lorsque le dernier patient a terminé la période de suivi). Sur la base des ratios d’incidence standardisés, l’incidence des affections malignes apparaît similaire à celle précédemment rapportée chez les patients atteints de vascularite à ANCA.
Dans l’essai clinique pédiatrique avec une période de suivi allant jusqu’à 54 mois, aucune affection maligne n’a été rapportée.
Effets indésirables cardiovasculaires
Dans l’étude clinique 1 dans la GPA/PAM, des événements cardiaques sont survenus à un taux approximatif de 273 pour 100 patient-années (IC à 95 % : 149-470) à 6 mois. Le taux d’événements cardiaques graves était de 2,1 pour 100 patient-années (IC à 95 % : 3 -15). Les événements les plus fréquemment rapportés étaient une tachycardie (4%) et une fibrillation auriculaire (3%) (voir rubrique 4.4).
Evénements neurologiques
Des cas de syndrome d’encéphalopathie postérieure réversible (SEPR) / syndrome de leucoencéphalopathie postérieure réversible (SLPR) ont été rapportés dans les maladies auto-immunes. Les signes et symptômes comprenaient des troubles visuels, céphalées, convulsions et altération mentale, avec ou sans hypertension associée. Un diagnostic de SEPR/SLPR nécessite une confirmation par imagerie cérébrale. Les cas rapportés présentaient des facteurs de risque connus de SEPR/SLPR dont la maladie sous-jacente des patients, l’hypertension, le traitement immunosuppresseur et/ou la chimiothérapie.
Réactivation du virus de l’hépatite B
Depuis la commercialisation, un faible nombre de cas de réactivation du virus de l’hépatite B, dont certains ayant eu une issue fatale, ont été rapportés chez des patients atteints de granulomatose avec polyangéite et polyangéite microscopique recevant MabThera.
Hypogammaglobulinémies
Une hypogammaglobulinémie (IgA, IgG ou IgM inférieures à la limite inférieure de la normale) a été observée chez des patients adultes et pédiatriques atteints de GPA et de PAM traités par MabThera.
Dans l’étude clinique 1 dans la GPA/PAM, à 6 mois, il y avait dans le groupe MabThera, respectivement 27 %, 58 % et 51 % des patients présentant des niveaux d’immunoglobulines normaux à l’inclusion qui ont présenté des taux faibles d’IgA, d’IgG et d’IgM par rapport à 25 %, 50% et 46 % des patients du groupe cyclophosphamide. Le taux global d’infections et d’infections graves n’a pas augmenté après l’apparition de faibles taux d’IgA, d’IgG ou d’IgM.
Au cours de l'étude clinique 2 dans la GPA/PAM, aucune différence cliniquement significative n’a été observée entre les deux groupes de traitement ni de diminution des taux d'immunoglobulines totales, d'IgG, d'IgM ou d'IgA.
Dans l’essai clinique pédiatrique, sur l’ensemble de la période de l’étude, 3 patients sur 25 (12 %) ont présenté un événement de type hypogammaglobulinémie, 18 patients (72 %) ont présenté des taux faibles prolongés (à savoir des taux inférieurs à la limite inférieure de la normale pendant au moins 4 mois) d’IgG (parmi lesquels 15 patients présentaient également des taux faibles prolongés d’IgM). Trois patients ont reçu un traitement par immunoglobulines intraveineuses (IgIV). Les données limitées ne permettent pas d’établir avec certitude l’existence d’un lien entre les taux faibles prolongés d’IgG et d’IgM et un risque accru d’infection grave chez ces patients. Les conséquences d’une déplétion lymphocytaire B à long terme chez les enfants ne sont pas connues.
Neutropénie
Dans l’étude clinique 1 dans la GPA/PAM, 24 % des patients du groupe MabThera (un seul cycle) et 23 % des patients du groupe cyclophosphamide ont développé une neutropénie de grade ≥ 3 selon la classification CTC. La neutropénie n’a pas été associée à une augmentation des infections graves chez les patients traités par MabThera.
Dans l'étude clinique 2 dans la GPA/PAM, l'incidence des neutropénies de tout grade était de 0 % chez les patients traités par MabThera versus 5 % chez les patients traités par azathioprine.
Affections de la peau et du tissu sous-cutané
Des cas de syndrome de Lyell (nécrolyse épidermique toxique) et de syndrome de Stevens-Johnson, dont certains d’issue fatale, ont été très rarement rapportés.
Expérience acquise dans le pemphigus vulgaris
Résumé du profil de tolérance lors de l’étude 1 dans le PV (Etude ML22196) et de l’étude 2 dans le PV (Etude WA29330)
Le profil de tolérance de MabThera en association avec des glucocorticoïdes à faible dose et pendant une courte durée dans le traitement de patients atteints de pemphigus vulgaris a été étudié dans un essai de phase 3, randomisé, contrôlé, multicentrique, en ouvert, mené auprès de 38 patients atteints de pemphigus vulgaris (PV), randomisés dans le groupe ayant reçu MabThera (Etude 1 PV). Les patients randomisés dans ce groupe ont reçu une première dose de 1000 mg en perfusion IV le 1er jour de l'étude (J1) et une seconde dose de 1000 mg en perfusion IV le jour 15. Des doses d'entretien de 500 mg en perfusion IV ont été administrées aux 12e et 18e mois. Les patients pouvaient recevoir une dose de 1000 mg en perfusion IV au moment de la rechute (voir rubrique 5.1).
Dans l’étude clinique 2 PV, randomisée, en double aveugle, en double insu, multicentrique versus comparateur actif, évaluant l’efficacité et la sécurité de MabThera versus mycophénolate mofétil (MMF) menée chez les patients atteints de PV modéré à sévère nécessitant un traitement par corticoïdes oraux, 67 patients atteints de PV ont reçu un traitement par MabThera (à la dose de 1 000 mg en IV le Jour 1 de l’étude, et une deuxième dose de 1 000 mg en IV le Jour 15 de l’étude, répétées à la Semaine 24 et Semaine 26) jusqu’à 52 semaines (voir rubrique 5.1).
Le profil général de tolérance dans le PV était conforme au profil de tolérance établi pour MabThera dans les indications de maladies auto-immunes approuvées.
Tableau listant les effets indésirables des études 1 et 2 dans le PV
Les effets indésirables recueillis lors des études 1 et 2 dans le PV sont présentés dans le tableau 7. Dans l’étude 1 PV, les effets indésirables ont été définis comme les effets survenus à un taux 5 % chez les patients atteints de PV traités par MabThera, avec une différence absolue d’incidence 2 % entre le groupe traité par MabThera et le groupe recevant la dose standard de prednisone jusqu'au 24e mois. Aucun patient n'est sorti de l’étude 1 PV suite à un effet indésirable. Dans l’étude 2 PV, les effets indésirables ont été définis comme les effets survenus à un taux 5 % chez les patients traités par MabThera et considérés comme reliés au traitement.
Tableau 7. Effets indésirables chez les patients atteints de pemphigus vulgaris traités par MabThera lors de l’étude 1 PV (jusqu’au Mois 24) et de l’étude 2 PV (jusqu’à la Semaine 52), ou dans le cadre de la surveillance depuis la commercialisation
MedDRA Classe de systèmes d’organes | Très Fréquent | Fréquent | Non connue |
Infections et infestations | Infection des voies respiratoires supérieures | Infection par le virus de l’herpès | infections virales graves1,2 |
Tumeurs bénignes, malignes et non précisées (incl. kystes et |
| Papillome cutané |
|
Affections psychiatriques | Trouble dépressif chronique | Dépression majeure |
|
Affections du système nerveux | Céphalées | Vertiges |
|
Affections cardiaques |
| Tachycardie |
|
Affections gastro-intestinales |
| Douleurs abdominales hautes |
|
Affections de la peau et du tissu sous-cutané | Alopécie | Prurit |
|
Affections musculo-squelettiques, du tissu conjonctif et des os |
| Douleurs musculo-squelettiques |
|
Troubles généraux et anomalies au site d'administration |
| Fatigue |
|
Lésions, intoxications et complications | Réactions liées à la perfusion3 |
|
|
1Observées dans le cadre de la surveillance depuis la commercialisation. | |||
Description de certains effets indésirables
Réactions liées à la perfusion
Dans l’étude 1 PV, les réactions liées à la perfusion étaient fréquentes (58 %). Presque toutes les réactions liées à la perfusion étaient légères à modérées. La proportion de patients ayant présenté une réaction liée à la perfusion était de 29 % (11 patients), 40 % (15 patients), 13 % (5 patients) et 10 % (4 patients) respectivement après les première, deuxième, troisième et quatrième perfusions. Aucun patient n'a arrêté le traitement en raison de réactions liées à la perfusion. Les symptômes des réactions liées à la perfusion étaient de même nature et de même sévérité que ceux observés chez les patients atteints de PR et de GPA/PAM.
Dans l’étude 2 PV, les réactions liées à la perfusion (RLPs) sont survenues principalement à la première perfusion et la fréquence des RLPs a diminué lors des perfusions suivantes : 17,9%, 4,5%, 3% et 3% des patients ont présenté des RLPs respectivement aux première, deuxième, troisième et quatrième perfusions. Chez 11 patients sur 15 ayant présenté au moins une RLP, les RLPs étaient de grade 1 ou 2. Chez 4 patients sur 15, les RLPs de grade ≥ 3 ont été rapportées et ont conduit à l'arrêt du traitement par MabThera; sur ces quatre patients, trois patients ont présenté des RLPs graves (engageant le pronostic vital). Ces RLPs graves sont survenues lors de la première perfusion (2 patients) ou de la seconde perfusion (1 patient) et ont disparu après un traitement symptomatique.
Infections
Dans l’étude 1 PV, 14 patients (37 %) du groupe ayant reçu MabThera ont présenté des infections liées au traitement, comparativement à 15 patients (42 %) du groupe recevant la dose standard de prednisone. Les infections les plus fréquentes dans le groupe MabThera étaient les infections à herpes simplex et le zona, les bronchites, les infections de la voie urinaire, les infections fongiques et les conjonctivites. Trois patients (8 %) du groupe MabThera ont présenté un total de 5 infections graves (pneumonie à Pneumocystis jirovecii, thrombose infectieuse, spondylodiscite, infection pulmonaire, septicémie à staphylocoques) et un patient (3 %) du groupe traité par la prednisone à dose standard a présenté une infection grave (pneumonie à Pneumocystis jirovecii).
Dans l’étude 2 PV, 42 patients (62,7%) du bras MabThera ont présenté des infections. Les infections les plus fréquentes dans le groupe traité par MabThera étaient : infection des voies respiratoires supérieures, rhinopharyngite, candidose buccale et infection des voies urinaires. Six patients (9%) du bras MabThera ont présenté des infections graves.
Depuis la commercialisation, des infections virales graves ont été rapportées chez des patients atteints de PV traités par le rituximab.
Anomalies des paramètres biologiques
Dans l'étude 2 PV, dans le bras MabThera, des diminutions transitoires du nombre de lymphocytes, s’expliquant par une diminution des populations de lymphocytes T périphériques, ainsi qu'une diminution transitoire du taux de phosphore ont été très fréquemment observées après la perfusion. Celles-ci ont été considérées comme induites par la perfusion IV de méthylprednisolone en prémédication.
Dans l'étude 2 PV, de faibles taux d'IgG ont été fréquemment observés et de faibles taux d'IgM ont été très fréquemment observés. Cependant, il n'y avait aucune preuve de risque accru d'infections graves suite à l’apparition de faibles taux d’IgG ou IgM.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration (voir ci-dessous).
Pour la Belgique
Agence fédérale des médicaments et des produits de santé
Division Vigilance
Avenue Galilée 5/03 | Boîte Postale 97 |
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@afmps.be
Pour le Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Allemagne
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
MabThera 100 mg solution à diluer pour perfusion
EU/1/98/067/001
MabThera 500 mg solution à diluer pour perfusion
EU/1/98/067/002
10. DATE DE MISE A JOUR DU TEXTE
16 août 2023
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu/
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1415363 | MABTHERA 100MG/10ML FL INJ 2 | L01FA01 | - | € 385,21 | Oui | - | - |
| 1415371 | MABTHERA 500MG/50ML FL INJ 1 | L01FA01 | - | € 971,36 | Oui | - | - |