RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
Haemate® P 600 UI FvW / 250 UI FVIII
Poudre et solvant pour solution injectable /pour perfusion
Haemate® P 1200 UI FvW / 500 UI FVIII
Poudre et solvant pour solution injectable /pour perfusion
Haemate® P 2400 UI FvW / 1000 UI FVIII
Poudre et solvant pour solution injectable /pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon Haemate P 600 UI FvW / 250 UI FVIII contient nominalement :
250 UI du facteur VIII de coagulation humain (FVIII)
600 UI du facteur Von Willebrand (FvW)
Après reconstitution avec 5 ml d’eau pour préparations injectables la solution contient 50 UI/ml du FVIII et 120 UI/ml du FvW.
Un flacon Haemate P 1200 UI FvW / 500 UI FVIII contient nominalement :
500 UI du facteur VIII de coagulation humain (FVIII)
1200 UI du facteur Von Willebrand (FvW)
Après reconstitution avec 10 ml d’eau pour préparations injectables la solution contient 50 UI/ml du FVIII et 120 UI/ml du FvW.
Un flacon Haemate P 2400 UI FvW / 1000 UI FVIII contient nominalement :
1000 UI du facteur VIII de coagulation humain (FVIII)
2400 UI du facteur Von Willebrand (FvW)
Après reconstitution avec 15 ml d’eau pour préparations injectables la solution contient 66,6 UI/ml du FVIII et 160 UI/ml du FvW.
L’activité (UI) du facteur VIII (FVIII) est déterminée par le dosage chromogène de la Pharmacopée européenne. L’activité spécifique d’Haemate P est d’environ 2-6 UI de FVIII/mg de protéine.
L’activité du FvW (UI) est déterminée à l’aide d'un test de liaison à la glycoprotéine IbM (FvW:GPIbM) et est exprimée en unités internationales d’activité du co-facteur de la ristocétine du FvW (FvW:RCo).
L’activité spécifique du FvW d’Haemate P est d’environ 5-17 UI de FvW:RCo/mg de protéine.
Haemate P est dérivé du plasma humain.
Excipients :
Sodium :
Haemate P 600 UI FvW / 250 UI FVIII / et Haemate P 1200 UI FvW/500 UI FVIII: environ 113 mmol/l (2,6 mg/ml)
Haemate P 2400 UI FvW / 1000 UI FVIII: environ 150 mmol/l (3,5 mg/ml)
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable/perfusion.
Le lyophilisat se présente sous la forme d'une poudre blanche ou jaune pâle ou d'un solide friable et solvant pour solution pour injection/pour perfusion claire et incolore.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Maladie de Von Willebrand (MVW)
Prophylaxie et traitement des hémorragies et des saignements d’origine chirurgicale quand le traitement par la desmopressine (DDAVP) seule est inefficace ou contre-indiqué.
Hémophilie A (déficit congénital en facteur VIII)
Prophylaxie et traitement des hémorragies chez des patients avec hémophilie A.
Ce médicament peut être utilisé pour la prise en charge du déficit acquis en facteur VIII et pour le traitement de patients présentant des anticorps dirigés contre le facteur VIII.
4.2 Posologie et mode d'administration
Le traitement de la maladie de Von Willebrand et de hémophilie A doit être supervisé par un médecin spécialiste dans le traitement des troubles hémostatiques.
Posologie
Maladie de Von Willebrand
Il est important que la dose soit calculé sur base de la quantité UI de FvW :RCo spécifié.
De façon générale, l’administration de 1UI/kg de FvW:RCo fait augmenter le taux plasmatique de FvW:RCo de 0,02 UI/ml (2 %).
Des concentrations de FvW:RCo > 0,6 UI/ml (60 %) et de FVIII:C > 0,4 UI/ml (40 %) doivent être obtenues.
Généralement, les posologies recommandées pour obtenir une hémostase satisfaisante sont de 40-80 UI/kg de facteur Von Willebrand (FvW:RCo) et de 20-40 UI de FVIII:C/kg de poids corporel (p.c).
Il peut être nécessaire d’instaurer une dose initiale de 80 UI/kg de facteur Von Willebrand, notamment chez les patients souffrant d’une maladie de Von Willebrand de type 3, pour laquelle le maintien de concentrations appropriées nécessite l’administration de doses plus fortes que dans les autres types de maladie de Von Willebrand.
Prévention des hémorragies en cas d’intervention chirurgicale ou de traumatisme sévère :
Pour la prévention des hémorragies pendant ou après une intervention chirurgicale, l’injection doit commencer 1 à 2 heures avant l’intervention.
Une dose appropriée doit être ré-administrée toutes les 12-24 heures. La dose et la durée du traitement dépendent de l’état clinique du patient, du type et de la sévérité de l’hémorragie et à la fois des concentrations de FVW:RCo et de FVIII:C.
Comme pour tout produit contenant un facteur VIII avec un facteur Von Willebrand, un traitement prolongé peut provoquer une augmentation excessive du FVIII:C. Par conséquent, après 24-48 heures de traitement, le médecin traitant devra envisager de diminuer les doses administrées et/ou d’augmenter les intervalles posologiques, pour éviter une élévation incontrôlée des taux de FVIII:C.
Population pédiatrique
La posologie chez l’enfant est calculée en fonction du poids corporel et est donc généralement fondée sur les mêmes recommandations que pour l’adulte. La fréquence d'administration doit toujours tenir compte de l’efficacité clinique au cas par cas.
Hémophilie A
Surveillance du traitement
Pendant le traitement, il est conseillé de surveiller les taux de facteur VIII pour adapter la posologie à administrer et la fréquence des perfusions. En cas d’interventions chirurgicales majeures, notamment, il est indispensable d’effectuer régulièrement un bilan de coagulation (activité plasmatique du facteur VIII) pour assurer une surveillance précise du traitement de substitution. La réponse au facteur VIII est variable d’un patient à l’autre et les concentrations atteintes in vivo, ainsi que les demi-vies, peuvent être très différentes.
L’apparition d’inhibiteurs du facteur VIII devra faire l’objet d’une surveillance chez tous les patients Voir aussi la rubrique 4.4.
La posologie et la durée du traitement de substitution dépendent de la sévérité du déficit en facteur VIII, de la localisation et de l’ampleur de l’hémorragie, ainsi que de l'état clinique du patient.
Il est important que la dose soit calculé sur base de la quantité UI de FVIII :C spécifié.
Le nombre d’unités de facteur VIII administrées est exprimé en Unités Internationales (UI), sur la base de la norme actuelle de l’OMS pour les concentrés de facteur VIII. L’activité du facteur VIII dans le plasma est exprimée en pourcentage (par rapport à un plasma humain normal) ou de préférence en UI (par rapport à une norme internationale pour le facteur VIII dans le plasma).
Une UI d’activité de facteur VIII est équivalente à la quantité de facteur VIII dans un ml de plasma humain normal.
Traitement selon nécessité (on-demand)
Le calcul de la posologie de facteur VIII nécessaire est fondé sur des données empiriques montrant que l’administration d’1 UI de facteur VIII par kg de poids corporel augmente l’activité plasmatique du facteur VIII d’environ 2 % (2 UI/dl) par rapport à l’activité normale.
Le calcul de la posologie nécessaire repose sur la formule suivante :
Unités nécessaires = poids corporel [kg] x augmentation souhaitée du facteur VIII [% ou UI/dl] x 0,5.
La quantité administrée et la fréquence d'administration doivent toujours être guidées par l’efficacité clinique au cas par cas.
En présence des événements hémorragiques suivants, l’activité du facteur VIII ne doit pas être inférieure à l’activité plasmatique indiquée (en % de la normale ou en UI/dl) pour la période correspondante. Le tableau suivant peut notamment être utilisé à titre indicatif pour établir la posologie la plus appropriée pendant des épisodes hémorragiques et des interventions chirurgicales :
Degré d’hémorragie/ | Taux de facteur VIII | Fréquence d’administration (heures) |
Hémorragie |
|
|
Début d’hémarthrose, saignement musculaire ou buccal | 20 - 40 | Répéter l’administration toutes les 12-24 heures. |
Hémarthrose plus étendue, hémorragie musculaire ou hématome | 30 - 60 | Répéter la perfusion toutes les 12-24 heures pendant 3-4 jours ou plus, jusqu’à la résolution de la douleur ou de l’invalidité aiguë. |
Hémorragie à risque vital | 60 - 100 | Répéter la perfusion toutes les 8-24 heures jusqu’à la disparition du risque vital. |
Chirurgie |
|
|
Mineure | 30 - 60 | Répéter la perfusion toutes les 24 heures, pendant au moins 1 jour, jusqu’à la cicatrisation. |
Majeure | 80 - 100 | Répéter la perfusion toutes les 8-24 heures, jusqu’à la cicatrisation appropriée de la plaie, puis administration pendant au moins 7 jours supplémentaires pour maintenir une activité du facteur VIII de 30-60 % (UI/dl). |
Prophylaxie
Pour une prophylaxie à long terme contre les hémorragies chez les patients atteints d’hémophilie A sévère, la posologie habituelle est de 20 à 40 UI de facteur VIII par kg, tous les 2 à 3 jours. Dans certains cas, surtout chez les patients jeunes, il peut être nécessaire de recourir à des intervalles posologiques plus courts ou à des doses plus élevées.
Population pédiatrique
Les études cliniques n’ont pas fourni de données concernant la posologie d’ Haemate P chez l’enfant.
Mode d’administration
Voie intraveineuse.
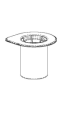
Reconstituer le produit conformément aux instructions de la rubrique 6.6. La préparation reconstituée doit être réchauffée à température ambiante ou à température corporelle avant son administration. Injecter lentement par voie intraveineuse à un débit confortable pour le patient. Une fois le produit transféré dans la seringue, il doit être utilisé immédiatement.
Si les quantités à injecter sont importantes, il est possible de recourir à une perfusion. Le produit reconstitué devra alors être transféré dans un système de perfusion approuvé.
Le débit d’injection ou de perfusion ne doit pas dépasser 4 ml par minute. Surveiller le patient pour vérifier l’absence de réaction immédiate. En cas de réaction pouvant être due à l’administration d’Haemate P il convient de diminuer le débit de perfusion ou d’arrêter l’injection, en fonction de l’état du patient (voir également la rubrique 4.4).
4.3 Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Les événements indésirables suivants reposent sur les résultats des données après-commercialisation.
Résumé du profil de sécurité
Pendant le traitement avec Haemate P chez les adultes et les adolescents les effets indésirables suivants peuvent survenir : une hypersensibilité ou des réactions allergiques, des événements thromboemboliques et pyrexie. De plus les patients peuvent développer des inhibiteurs du FVIII et FvW.
Liste des effets indésirables
Le tableau présenté ci-dessous est fondé sur la classification système-organe MedDRA.
Les fréquences ont été définies selon les critères suivants: très fréquent (≥ 1/10), fréquent (≥ 1/100 à <1/10), peu fréquent (≥ 1/1 000 à <1/100), rare (≥ 1 / 10 000 à <1/1 000), très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
MedDRA SOC | Effet indésirable | Fréquence |
Affections hématologiques et du système lymphatique | Hypervolémie | Indéterminée |
Troubles généraux et anomalies au site d’administration | fièvre | Très rare |
Affections du système immunitaire | Hypersensibilité (réactions allergiques) | Très rare |
Affections vasculaires | Thrombose | Très rare |
* La fréquence est déterminée d’après des études sur des produits de facteur VIII menées auprès de patients atteints d’hémophilie A sévère. PTPs= patients préalablement traités. PUPs = patients non préalablement traités.
Description de certains effets indésirables
• Affections hématologiques et du système lymphatique
L’apparition de signes d’une hypervolémie devra être étroitement surveillée chez tous les patients, notamment en cas d’administration de doses très importantes ou répétées, de présence d’inhibiteurs ou de soins pré- et post-chirurgicaux. De plus, l’apparition de signes d’hémolyse intravasculaire et/ou de diminution de l’hématocrite devra être surveillée chez les patients des groupes sanguins A, B et AB.
• Troubles généraux et anomalies au site d’administration
Une fièvre a été observée en de très rares occasions.
• Affections du système immunitaire
Des réactions allergiques ou d’hypersensibilité (pouvant inclure angio-œdème, sensations de brûlures et de picotements au site de perfusion, frissons, bouffées vasomotrices, urticaire généralisée ou non, céphalées, hypotension, léthargie, nausées, agitation, tachycardie, oppression thoracique, fourmillements, vomissements, sifflements respiratoires) ont été observées très rarement et peuvent, dans certains cas, évoluer vers une anaphylaxie sévère (y compris un choc).
Maladie de Von Willebrand
• Affections hématologiques et du système lymphatique
Des anticorps neutralisants (inhibiteurs) du facteur Von Willebrand peuvent apparaître, très rarement, chez les patients souffrant de maladie de Von Willebrand, notamment de type 3. Dans ce cas, on observera une réponse clinique insuffisante. Il s’agit d’anticorps précipitants, qui peuvent apparaître en même temps que les réactions anaphylactiques. La présence d’inhibiteur devra donc être évaluée chez les patients présentant une réaction anaphylactique.
Dans ces cas, il est recommandé de contacter un centre spécialisé dans le traitement de l’hémophilie.
- Affections vasculaires
Il existe très rarement un risque de survenue d’événements thrombotiques/thrombo-emboliques (incluant une embolie pulmonaire). Une surveillance minutieuse des doses et des heures d’administration est indispensable, surtout chez les patients à haut risque de thrombo-embolie (grand âge, obésité et utilisation concomitante de contraceptifs oraux). Une évaluation clinique doit en outre être réalisée, sous l’angle du risque de thrombose, chez les patients qui subissent une intervention chirurgicale.
L’administration de facteur Von Willebrand peut s’accompagner d’une élévation excessive et prolongée des taux plasmatiques de FVIII:C, susceptible d’augmenter le risque d’événements thrombotiques (voir également rubrique 4.4).
Hémophilie A
• Affections hématologiques et du système lymphatique
Des anticorps neutralisants (inhibiteurs) peuvent apparaître chez des patients atteints d’hémophilie A traités avec le facteur VIII, y compris avec Haemate P. Une telle apparition peut se manifester par une réponse clinique insuffisante. Dans ce cas, il est recommandé de contacter un centre spécialisé dans le traitement de l’hémophilie.
Pour les informations relatives à la sécurité virale, voir rubrique 4.4.
Population pédiatrique
La fréquence, le type et la sévérité des effets secondaires chez les enfants sont supposés comparables à ceux de l’adulte.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via
Belgique:
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg:
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
CSL Behring GmbH
Emil-von-Behring Strasse 76
35041 Marburg
Allemagne
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
Belgique :
Haemate® P 600 UI FvW / 250 UI FVIII : BE154481
Haemate® P 1200 UI FvW / 500 UI FVIII : BE179015
Haemate® P 2400 UI FvW / 1000 UI FVIII : BE179024
Luxembourg:
Haemate P 600 UI vWF/250 UI FVIII : 1997095755
- 0137829
Haemate P 1200 UI vWF/500 UI FVIII : 1997095756
- 0137538
Haemate P 2400 UI vWF/1000 UI FVIII : 1987095757
- 0137541
10. DATE DE MISE A JOUR DU TEXTE
Date d’approbation: 06/2024
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1378785 | HAEMATE P FL 1000 IU (2400 IU VWF) | B02BD06 | € 1020,33 | - | Oui | - | - |
| 1378793 | HAEMATE P FL 500 IU (1200IU VWF) | B02BD06 | € 518,12 | - | Oui | - | - |
| 1378801 | HAEMATE P FL 250 IU ( 600 IU VWF) | B02BD06 | € 194,51 | - | Oui | - | - |
 1
1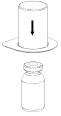 2
2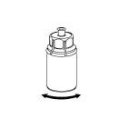 6
6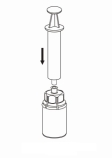 7
7