ANNEXE I
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
Nilemdo 180 mg comprimés pelliculés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé pelliculé contient 180 mg d’acide bempédoïque.
Excipient(s) à effet notoire :
Chaque comprimé pelliculé de 180 mg contient 28,5 mg de lactose.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé.
Comprimé pelliculé blanc à blanc cassé, ovale, mesurant environ 13,97 mm × 6,60 mm × 4,80 mm avec impression en creux de la mention « 180 » d’un côté et « ESP » de l’autre.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Hypercholestérolémie et dyslipidémie mixte
Nilemdo est indiqué chez l’adulte présentant une hypercholestérolémie primaire (hétérozygote familiale et non familiale) ou une dyslipidémie mixte, en complément d’un régime alimentaire :
- en association avec une statine ou une statine avec d’autres traitements hypolipidémiants chez les patients ne pouvant pas atteindre les objectifs de cholestérol à lipoprotéines de basse densité (LDL-C) sous statine à dose maximale tolérée (voir rubriques 4.2, 4.3 et 4.4) ou
- en monothérapie ou en association avec d’autres traitements hypolipidémiants chez les patients qui sont intolérants aux statines ou chez qui les statines sont contre-indiquées.
Maladie cardiovasculaire
Nilemdo est indiqué chez l’adulte présentant une maladie cardiovasculaire athéroscléreuse avérée ou ayant un risque élevé de maladie cardiovasculaire athéroscléreuse pour réduire le risque cardiovasculaire en diminuant le taux de LDL-C, en complément de la correction des autres facteurs de risque :
- chez les patients traités par une statine à la dose maximale tolérée avec ou sans ézétimibe ou,
- seul ou en association avec l’ézétimibe chez les patients qui sont intolérants aux statines ou chez qui les statines sont contre-indiquées.
Pour les résultats de l’étude en termes d’effets sur le LDL-C, d’événements cardiovasculaires et pour les populations étudiées, voir la rubrique 5.1.
4.2 Posologie et mode d’administration
Posologie
La dose recommandée de Nilemdo est d’un comprimé pelliculé de 180 mg une fois par jour.
Traitement concomitant par la simvastatine
Lorsque Nilemdo est administré conjointement à la simvastatine, la prise de simvastatine doit être limitée à 20 mg par jour (ou 40 mg par jour chez les patients présentant une hypercholestérolémie sévère et un risque élevé de complications cardiovasculaires, qui n’ont pas atteint les objectifs thérapeutiques fixés à une dose plus faible et lorsque les bénéfices attendus sont supérieurs aux risques potentiels) (voir rubriques 4.4 et 4.5).
Populations particulières
Patients âgés
Aucun ajustement posologique n’est nécessaire pour les patients âgés (voir rubrique 5.2).
Patients atteints d’une insuffisance rénale
Aucun ajustement posologique n’est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée. Les données disponibles sur les patients atteints d’insuffisance rénale sévère (définie comme un débit de filtration glomérulaire [DFG] estimé inférieur à 30 mL/min/1,73 m2) sont limitées ; en outre, les patients atteints d’insuffisance rénale terminale (IRT) sous dialyse n’ont pas été étudiés. Une surveillance supplémentaire concernant les effets indésirables peut être justifiée chez ces patients lorsque Nilemdo est administré (voir rubrique 4.4).
Patients présentant une insuffisance hépatique
Aucun ajustement posologique n’est nécessaire chez les patients présentant une insuffisance hépatique légère ou modérée (classe A ou B de Child-Pugh). Aucune donnée n’est disponible chez les patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh). Des bilans hépatiques réguliers doivent être envisagés pour les patients souffrant d’une insuffisance hépatique sévère (voir rubrique 4.4).
Population pédiatrique
La sécurité et l’efficacité de Nilemdo chez les enfants âgés de moins de 18 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
Mode d’administration
Les comprimés pelliculés doivent être pris par voie orale au cours ou en dehors des repas. Les comprimés doivent être avalés entiers.
4.3 Contre-indications
- Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
- Grossesse (voir rubrique 4.6).
- Allaitement (voir rubrique 4.6).
- Administration concomitante de simvastatine > 40 mg par jour (voir rubriques 4.2, 4.4 et 4.5).
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment signalés avec l’acide bempédoïque lors des essais pivots étaient l’hyperuricémie (3,8 %), les douleurs aux extrémités (3,1 %), l’anémie (2,5 %) et la goutte (1,4 %). Davantage de patients traités par acide bempédoïque que de patients traités par placebo ont arrêté le traitement en raison de spasmes musculaires (0,7 % contre 0,3 %), de diarrhées (0,5 % contre < 0,1 %), de douleurs aux extrémités (0,4 % contre 0) et de nausées (0,3 % contre 0,2 %), même si les différences entre l’acide bempédoïque et le placebo n’étaient pas significatives.
Tableau récapitulatif des effets indésirables
Les effets indésirables rapportés suite à la prise d’acide bempédoïque, sur la base des taux d’incidence dans les études de phase 3 menées dans l’hyperlipidémie primaire et des taux d’incidence ajustés en fonction de l’exposition dans l’étude CLEAR Outcomes, sont présentés par classe de système d’organe et par fréquence dans le tableau 1.
Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 1 : Effets indésirables
Classe de systèmes d’organes (SOC) | Effets indésirables | Catégories de fréquence |
Affections hématologiques et du système lymphatique | Anémie | Fréquent |
Diminution des taux d’hémoglobine | Peu fréquent | |
Troubles du métabolisme et de la nutrition | Goutte | Fréquent |
Hyperuricémiea | Fréquent | |
Perte de poidsb | Peu fréquent | |
Affections hépatobiliaires | Augmentation des taux d’aspartate aminotransférase | Fréquent |
Augmentation des taux d’alanine aminotransférase | Peu fréquent | |
Résultats élevés du bilan hépatique | Peu fréquent | |
Affections musculosquelettiques et du tissu conjonctif | Douleurs aux extrémités | Fréquent |
Affections du rein et des voies urinaires | Débit de filtration glomérulaire diminué | Fréquent |
Créatinine sanguine augmentée | Peu fréquent | |
Urée sanguine augmentée | Peu fréquent |
- L’hyperuricémie comprend l’hyperuricémie et l’augmentation de l’acide urique sanguin.
- (Étude CLEAR Outcomes) – La perte de poids n’a été observée que chez les patients qui avaient un indice de masse corporelle (IMC) ≥ 30 kg/m2 à l’inclusion, avec une perte de poids moyenne de 2,28 kg au mois 36. La perte de poids moyenne était ≤ 0,5 kg chez les patients ayant un IMC de 25 à < 30 kg/m2 à l’inclusion. Il n’a pas été rapporté de variation moyenne du poids avec l’acide bempédoïque chez les patients ayant un IMC < 25 kg/m2 à l’inclusion.
Description de certains effets indésirables
Élévation des taux d’enzymes hépatiques
Des augmentations des transaminases sériques (ASAT ou ALAT) ont été signalées avec l’acide bempédoïque. Dans les études de phase 3 menées dans l’hyperlipidémie primaire, l’incidence des élévations (≥ 3 × LSN) des taux de transaminases hépatiques était de 0,7 % chez les patients traités par acide bempédoïque et de 0,3 % chez ceux sous placebo. Dans l’étude CLEAR Outcomes, des élévations des taux de transaminases hépatiques ≥ 3 × LSN sont également survenues plus fréquemment chez les patients traités par acide bempédoïque (1,6 %) que chez les patients sous placebo (1,0 %). Ces élévations des taux de transaminases n’étaient pas associées à d’autres signes d’insuffisance hépatique (voir rubrique 4.4).
Augmentation des taux sériques d’acide urique
Des augmentations de l’acide urique sérique ont été observées lors d’études cliniques avec l’acide bempédoïque, possiblement en raison d’une inhibition de l’OAT2 dans les tubules rénaux (voir rubrique 4.5). Dans les études de phase 3 menées dans l’hyperlipidémie primaire, une augmentation moyenne de 47,6 micromole/L (0,8 mg/dL) des taux d’acide urique par rapport aux taux initiaux a été observée sous acide bempédoïque à la 12e semaine. Les augmentations des taux sériques d’acide urique se sont généralement produites durant les quatre premières semaines du traitement, avec un retour aux taux initiaux après arrêt du traitement. Dans les études de phase 3 menées dans l’hyperlipidémie primaire, des crises de goutte ont été rapportées chez 1,4 % des patients traités par acide bempédoïque et chez 0,4 % des patients sous placebo (voir rubrique 4.4). Dans l’étude CLEAR Outcomes, une augmentation moyenne de 47,6 micromole/L (0,8 mg/dL) des taux d’acide urique par rapport aux taux initiaux a été observée sous acide bempédoïque au 3e mois et des crises de goutte ont également été rapportées plus fréquemment chez les patients traités par acide bempédoïque (3,1 %) que chez les patients sous placebo (2,1 %). Dans chacun des groupes de traitement, les patients ayant rapporté des crises de goutte étaient plus susceptibles de présenter des antécédents médicaux de goutte et/ou des taux initiaux d’acide urique supérieurs à la LSN.
Effets sur les taux sériques de créatinine et les taux d’azote uréique sanguin
Il a été démontré que l’acide bempédoïque augmente les taux sériques de créatinine et les taux d’azote uréique sanguin. Dans les études de phase 3 menées dans l’hyperlipidémie primaire, une augmentation moyenne de 4,4 micromole/L (0,05 mg/dL) des taux sériques de créatinine et une augmentation moyenne de 0,61 mmol/L (1,7 mg/dL) des taux d’azote uréique sanguin par rapport aux taux initiaux, ont été observées sous acide bempédoïque à la 12e semaine. L’élévation des taux sériques de créatinine et d’azote uréique sanguin a généralement été observée durant les quatre premières semaines de traitement, puis ces taux se sont stabilisés avant de revenir aux taux initiaux après arrêt du traitement. Des augmentations moyennes comparables des taux sériques de créatinine (5,8 micromole/L [0,066 mg/dL]) et d’azote uréique sanguin (0,82 mmol/L [2,3 mg/dL]) ont été observées sous acide bempédoïque dans l’étude CLEAR Outcomes.
Les élévations des taux sériques de créatinine observés peuvent être associées à une inhibition par l’acide bempédoïque de la sécrétion OAT2-dépendante de créatinine dans les tubules rénaux (voir rubrique 4.5), ce qui représente une interaction entre un médicament et un substrat endogène et ne semble pas indiquer une aggravation de la fonction rénale. Cet effet doit être pris en considération lors de l’interprétation de changements de la clairance estimée de la créatinine chez des patients traités par Nilemdo, en particulier chez des patients atteints de pathologies ou traités par des médicaments nécessitant une surveillance de la clairance estimée de la créatinine.
Diminution des taux d’hémoglobine
Des diminutions du taux d’hémoglobine ont été observées lors d’études cliniques avec l’acide bempédoïque. Dans les études de phase 3 menées dans l’hyperlipidémie primaire, une diminution des taux d’hémoglobine ≥ 20 g/L et < à la limite inférieure de la normale (LIN) par rapport aux taux initiaux, observée chez 4,6 % des patients du groupe ayant reçu de l’acide bempédoïque, contre 1,9 % des patients sous placebo. Des diminutions de plus de 50 g/L et inférieures à la LIN des taux d’hémoglobine ont été rapportées à des fréquences similaires dans les groupes traités par acide bempédoïque et sous placebo (0,2 % contre 0,2 %, respectivement). Les diminutions des taux d’hémoglobine se sont généralement produites durant les quatre premières semaines de traitement, avec un retour aux taux initiaux après arrêt du traitement. Parmi les patients dont les taux d’hémoglobine à l’inclusion étaient normaux, les taux d’hémoglobine étaient inférieurs à la LIN pendant le traitement chez 1,4 % des patients traités par acide bempédoïque et chez 0,4 % des patients sous placebo. Dans les études de phase 3 menées dans l’hyperlipidémie primaire, une anémie a été rapportée chez 2,5 % des patients traités par acide bempédoïque et chez 1,6 % des patients sous placebo. Dans l’étude CLEAR Outcomes, des diminutions comparables des taux d’hémoglobine ont été observées et une anémie a également été rapportée plus fréquemment chez les patients traités par acide bempédoïque (4,7 %) que chez les patients sous placebo (3,9 %).
Patients âgés
Parmi les 3 621 patients traités par acide bempédoïque dans les études de phase 3 menées dans l’hyperlipidémie primaire, 2 098 (58 %) avaient plus de 65 ans. Dans l’étude CLEAR Outcomes, 4 141 patients (59 %) traités par acide bempédoïque étaient âgés de 65 ans et plus et 1 066 patients (15 %) traités par acide bempédoïque étaient âgés de 75 ans et plus. Aucune différence générale en termes de sécurité n’a été observée entre la population âgée et la population plus jeune.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Daiichi Sankyo Europe GmbH
Zielstattstrasse 48
81379 Munich
Allemagne
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/20/1425/001 - 011
10. DATE DE MISE À JOUR DU TEXTE
11/2024
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 4265096 | NILEMDO 180MG COMP PELL 98 | C10AX15 | € 223,59 | - | Oui | € 15,5 | € 10,2 |
| 4265104 | NILEMDO 180MG COMP PELL 50 X 1 | C10AX15 | € 126,8 | € 110 | Oui | - | - |
| 4265112 | NILEMDO 180MG COMP PELL 28 | C10AX15 | € 71,38 | - | Oui | € 12,5 | € 8,3 |
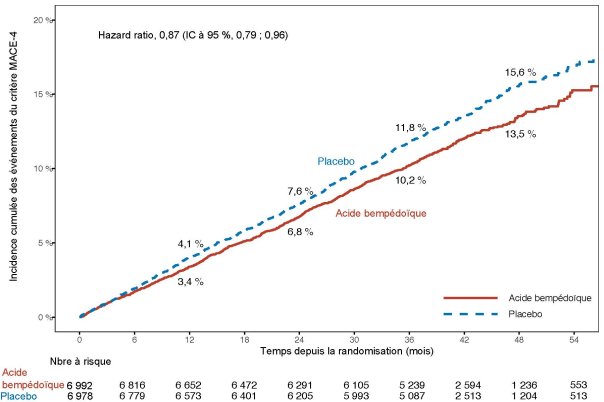
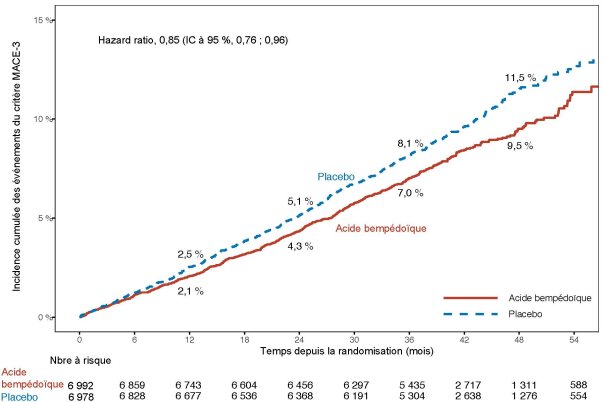 MACE = événement indésirable cardiovasculaire majeur.
MACE = événement indésirable cardiovasculaire majeur.