RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
AJOVY 225 mg solution injectable en seringue préremplie
AJOVY 225 mg solution injectable en stylo prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Seringue préremplie
Une seringue préremplie contient 225 mg de frémanezumab.
Stylo prérempli
Un stylo prérempli contient 225 mg de frémanezumab.
Le frémanezumab est un anticorps monoclonal humanisé produit à partir de cellules d’ovaire de hamster chinois (CHO) par la technologie de l’ADN recombinant.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution injectable (injection)
Solution limpide à opalescente, incolore à légèrement jaune, avec un pH de 5,5 et une osmolalité comprise entre 320 et 420 mOsm/kg.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
AJOVY est indiqué dans la prophylaxie de la migraine chez l’adulte présentant au moins 4 jours de migraine par mois.
4.2 Posologie et mode d’administration
Le traitement doit être instauré par un médecin expérimenté dans le diagnostic et le traitement de la migraine.
Posologie
Deux options posologiques sont disponibles :
- 225 mg une fois par mois (administration mensuelle) ou
- 675 mg tous les trois mois (administration trimestrielle)
En cas de changement de schéma posologique, la première dose du nouveau schéma doit être administrée à la date d’administration prévue par le schéma posologique précédent.
Lors de l’instauration du traitement par le frémanezumab, le traitement préventif concomitant de la migraine peut être poursuivi, si le prescripteur l’estime nécessaire (voir rubrique 5.1).
Le bénéfice du traitement doit être évalué dans les 3 mois suivant l’instauration du traitement. La décision de poursuivre le traitement doit être prise au cas par cas. Il est ensuite recommandé d’évaluer régulièrement la nécessité de poursuivre le traitement.
Oubli d’une dose
En cas d’oubli d’une injection de frémanezumab à la date prévue, l’administration doit reprendre dès que possible à la dose et au schéma indiqués. Il ne faut pas administrer de dose double pour compenser une dose oubliée.
Populations particulières
Personnes âgées
Les données disponibles sont limitées concernant l’utilisation du frémanezumab chez les patients âgés de 65 ans. D’après les résultats de l’analyse pharmacocinétique de population, aucune adaptation posologique n’est requise (voir rubrique 5.2).
Insuffisance rénale ou hépatique
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance rénale ou hépatique légère à modérée (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité d’AJOVY chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
Mode d’administration
Voie sous-cutanée.
AJOVY doit être administré uniquement par injection sous-cutanée. AJOVY peut être injecté dans les zones de l’abdomen, de la cuisse ou de la partie supérieure du bras, qui ne sont pas sensibles, ne présentent pas d’ecchymose, de rougeur ou d’induration. En cas d’injections multiples, les sites d’injection doivent être alternés.
Les patients peuvent faire les injections eux-mêmes s’ils ont été formés à la technique d’auto-injection sous-cutanée par un professionnel de santé. Pour des instructions plus détaillées sur l’administration, voir rubrique 6.6.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité
Au total, plus de 2 500 patients (plus de 1 900 patient-années) ont été traités par AJOVY au cours des études déposées lors de l’enregistrement du médicament. Plus de 1 400 patients ont été traités pendant au moins 12 mois.
Les effets indésirables (EI) fréquemment rapportés ont été des réactions locales au site d’injection (douleur [24 %], induration [17 %], érythème [16 %] et prurit [2 %]).
Tableau récapitulatif des effets indésirables
Les EI rapportés pendant les études cliniques et dans le cadre des notifications post-commercialisation sont présentés selon la classification MedDRA par classe de systèmes d’organes. Au sein de chaque groupe de fréquence, les EI sont présentés suivant un ordre décroissant de gravité. Les catégories de fréquence sont définies selon la convention suivante : très fréquent (1/10) ; fréquent (1/100, 1/10) ; peu fréquent (1/1 000, 1/100) ; rare (1/10 000, 1/1 000) ; très rare (1/10 000). Au sein de chaque classe de systèmes d’organes, les EI sont présentés par fréquence, les EI les plus fréquents étant cités en premier.
Les EI suivants ont été identifiés avec AJOVY (tableau 1).
Tableau 1 : effets indésirables observés
Classe de systèmes d’organes selon MedDRA | Fréquence | Effet indésirable |
Affections du système immunitaire | Peu fréquent | Réactions d’hypersensibilité telles que rash, prurit, urticaire et gonflement |
Rare | Réaction anaphylactique | |
Troubles généraux et anomalies au site d’administration | Très fréquent | Douleur au site d’injection |
Induration au site d’injection | ||
Érythème au site d’injection | ||
Fréquent | Prurit au site d’injection | |
Peu fréquent | Rash au site d’injection |
Description de certains effets indésirables particuliers
Réactions au site d'injection
Les réactions locales les plus fréquemment observées au site d’injection ont été la douleur, l’induration et l’érythème. Toutes les réactions locales au site d’injection ont été transitoires et principalement de sévérité légère à modérée. La douleur, l’induration et l’érythème ont été typiquement observés immédiatement après l’injection alors que le prurit et le rash sont apparus dans un délai médian de respectivement 24 et 48 heures. Toutes les réactions au site d’injection se sont résolues, le plus souvent dans les quelques heures ou jours qui ont suivi. Les réactions au site d’injection n’ont généralement pas nécessité l’arrêt du médicament.
Réactions d’hypersensibilité graves
Des réactions anaphylactiques ont été rapportées dans de rares cas. La plupart de ces réactions se sont produites dans les 24 heures suivant l’administration, bien que certaines réactions aient été plus tardives.
Immunogénicité
Au cours des études contrôlées versus placebo, 0,4 % des patients (6 patients sur 1 701) traités par le frémanezumab ont développé des anticorps anti-médicament. Les taux de ces anticorps étaient faibles. Un de ces six patients a développé des anticorps neutralisants. Après 12 mois de traitement, des anticorps anti-médicament ont été détectés chez 2,3 % des patients (43 sur 1 888), avec 0,95 % des patients ayant développé des anticorps neutralisants. La sécurité et l’efficacité du frémanezumab n’ont pas été affectées par le développement d’anticorps anti-médicament.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté
- en Belgique via l’Agence fédérale des médicaments et des produits de santé – www.afmps.be -Division Vigilance - Site internet : www.notifieruneffetindesirable.be - e-mail : adr@fagg-afmps.be,
- au Luxembourg via le Centre Régional de Pharmacovigilance de Nancy ou la Division de la pharmacie et des médicaments de la Direction de la santé – Site internet : www.guichet.lu/pharmacovigilance.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
TEVA GmbH
Graf-Arco-Str. 3
89079 Ulm
Allemagne
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
Seringue préremplie
EU/1/19/1358/001 – 1 seringue préremplie
EU/1/19/1358/002 – 3 seringues préremplies
Stylo prérempli
EU/1/19/1358/003 – 1 stylo prérempli
EU/1/19/1358/004 – 3 stylos préremplis
10. DATE DE MISE À JOUR DU TEXTE
03/2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3960788 | AJOVY 225MG SOL INJ SERINGUE PREREMPLIE 1 | N02CD03 | € 496,6 | - | Oui | € 12,5 | € 8,3 |
| 3960796 | AJOVY 225MG SOL INJ SERINGUE PREREMPLIE 3 | N02CD03 | € 1468,33 | - | Oui | € 12,5 | € 8,3 |
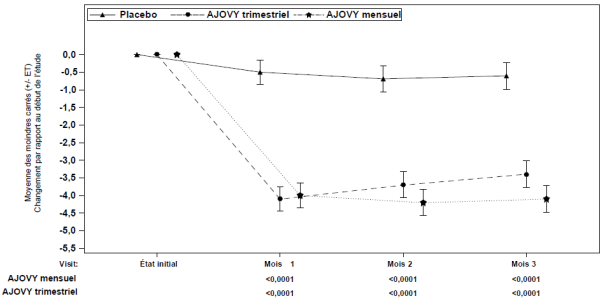
 Moyenne à l’inclusion (moyenne mensuelle du nombre de jours de migraine) : Placebo : 9,1, AJOVY trimestriel : 9,2, AJOVY mensuel : 8,9.
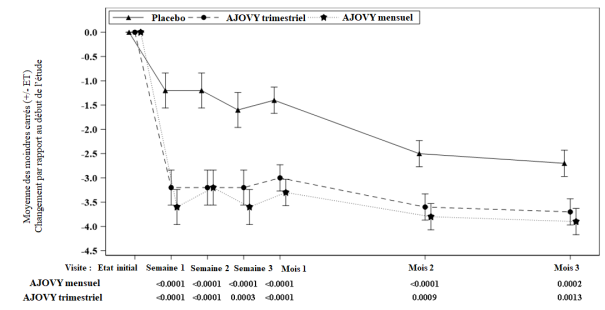
Moyenne à l’inclusion (moyenne mensuelle du nombre de jours de migraine) : Placebo : 9,1, AJOVY trimestriel : 9,2, AJOVY mensuel : 8,9.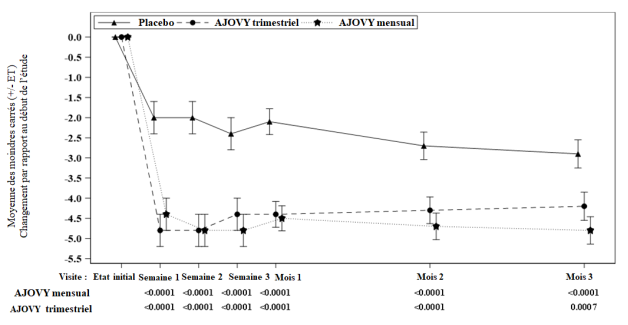 Moyenne à l’inclusion (nombre mensuel moyen de jours de céphalées d’intensité au moins modérée pour l’Étude 2) : Placebo : 13,3, AJOVY trimestriel : 13,2, AJOVY mensuel : 12,8.
Moyenne à l’inclusion (nombre mensuel moyen de jours de céphalées d’intensité au moins modérée pour l’Étude 2) : Placebo : 13,3, AJOVY trimestriel : 13,2, AJOVY mensuel : 12,8.