RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
RINVOQ 15 mg comprimés à libération prolongée
RINVOQ 30 mg comprimés à libération prolongée
RINVOQ 45 mg comprimés à libération prolongée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
RINVOQ 15 mg comprimés à libération prolongée
Chaque comprimé à libération prolongée contient de l’upadacitinib hémihydraté, équivalent à 15 mg d’upadacitinib.
RINVOQ 30 mg comprimés à libération prolongée
Chaque comprimé à libération prolongée contient de l’upadacitinib hémihydraté, équivalent à 30 mg d’upadacitinib.
RINVOQ 45 mg comprimés à libération prolongée
Chaque comprimé à libération prolongée contient de l’upadacitinib hémihydraté, équivalent à 45 mg d’upadacitinib.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé à libération prolongée
RINVOQ 15 mg comprimés à libération prolongée
Comprimés à libération prolongée violets, de forme oblongue biconvexe, 14 x 8 mm et portant l’inscription « a15 » sur un côté.
RINVOQ 30 mg comprimés à libération prolongée
Comprimés à libération prolongée rouges, de forme oblongue biconvexe, 14 x 8 mm et portant l’inscription « a30 » sur un côté.
RINVOQ 45 mg comprimés à libération prolongée
Comprimés à libération prolongée jaunes à jaunes mouchetés, de forme oblongue biconvexe, 14 x 8 mm et portant l’inscription « a45 » sur un côté.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Polyarthrite rhumatoïde
RINVOQ est indiqué dans le traitement de la polyarthrite rhumatoïde active modérée à sévère chez les patients adultes qui ont présenté une réponse inadéquate ou une intolérance à un ou plusieurs traitements de fond (DMARDs). RINVOQ peut être utilisé en monothérapie ou en association avec le méthotrexate.
Rhumatisme psoriasique
RINVOQ est indiqué dans le traitement du rhumatisme psoriasique actif chez les patients adultes qui ont présenté une réponse inadéquate ou une intolérance à un ou plusieurs DMARD. RINVOQ peut être utilisé en monothérapie ou en association avec le méthotrexate.
Spondyloarthrite axiale
Spondyloarthrite axiale non radiographique (nr-axSpA)
RINVOQ est indiqué dans le traitement de la spondyloarthrite axiale non radiographique active chez les patients adultes, avec des signes objectifs d’inflammation, se traduisant par un taux élevé de protéine C réactive (CRP) et/ou des signes visibles à l’imagerie par résonance magnétique (IRM), en cas de réponse inadéquate aux anti-inflammatoires non stéroïdiens (AINS).
Spondylarthrite ankylosante (SA, spondyloarthrite axiale radiographique)
RINVOQ est indiqué dans le traitement de la spondylarthrite ankylosante active chez les patients adultes qui ont présenté une réponse inadéquate au traitement conventionnel.
Artérite à cellules géantes
RINVOQ est indiqué dans le traitement de l’artérite à cellules géantes chez les patients adultes.
Dermatite atopique
RINVOQ est indiqué dans le traitement de la dermatite atopique modérée à sévère chez les adultes et les adolescents âgés de 12 ans et plus qui nécessitent un traitement systémique.
Rectocolite hémorragique
RINVOQ est indiqué dans le traitement de la rectocolite hémorragique active modérée à sévère chez les patients adultes ayant présenté une réponse inadéquate, une perte de réponse ou une intolérance au traitement conventionnel ou à un agent biologique.
Maladie de Crohn
RINVOQ est indiqué dans le traitement de la maladie de Crohn active modérée à sévère chez les patients adultes ayant présenté une réponse inadéquate, une perte de réponse ou une intolérance au traitement conventionnel ou à un agent biologique.
4.2 Posologie et mode d’administration
Le traitement par l’upadacitinib doit être initié et supervisé par un médecin spécialisé dans le diagnostic et le traitement de pathologies pour lesquelles l’upadacitinib est indiqué.
Posologie
Polyarthrite rhumatoïde, rhumatisme psoriasique et spondyloarthrite axiale
La dose recommandée d’upadacitinib est de 15 mg une fois par jour.
Une interruption du traitement devra être envisagée chez les patients atteints de spondyloarthrite axiale n’ayant pas répondu après 16 semaines de traitement. Chez certains patients ayant obtenu une réponse initiale partielle, une amélioration ultérieure peut être observée en poursuivant le traitement au‑delà de 16 semaines.
Artérite à cellules géantes
La dose recommandée d’upadacitinib est de 15 mg une fois par jour en association à une corticothérapie dégressive. L’upadacitinib ne doit pas être utilisé en monothérapie pour le traitement des rechutes aiguës (voir rubrique 4.4).
En raison de la nature chronique de l’artérite à cellules géantes, l’upadacitinib 15 mg une fois par jour peut être poursuivi en monothérapie après l’arrêt des corticoïdes. Le traitement au-delà de 52 semaines doit être guidé par l’activité de la maladie, l’avis du médecin et le choix du patient.
Dermatite atopique
La dose recommandée d’upadacitinib est de 15 mg ou 30 mg une fois par jour, selon les caractéristiques individuelles de chaque patient.
- Une dose de 15 mg est recommandée pour les patients présentant un risque accru de maladie thromboembolique veineuse (MTEV), d'événements indésirables cardiovasculaires majeurs (EICM) et de tumeur maligne (voir rubrique 4.4).
- Une dose de 30 mg une fois par jour peut être appropriée pour les patients ayant un fort retentissement de la maladie qui ne présentent pas un risque accru de MTEV, de EICM et de tumeur maligne (voir rubrique 4.4) ou pour les patients ayant présenté une réponse inadéquate à la dose de 15 mg une fois par jour.
- Chez les adolescents (12 à 17 ans) pesant au moins 30 kg, une dose de 15 mg est recommandée. Si le patient ne répond pas de façon adéquate à la dose de 15 mg une fois par jour, la dose peut être augmentée à 30 mg une fois par jour.
- La dose efficace la plus faible permettant le maintien de la réponse doit être utilisée.
Pour les patients âgés de 65 ans et plus, la dose recommandée est de 15 mg une fois par jour (voir rubrique 4.4).
Traitements topiques concomitants
L’upadacitinib peut être utilisé avec ou sans dermocorticoïdes topiques. Des inhibiteurs de la calcineurine topiques peuvent être utilisés pour les zones sensibles telles que le visage, le cou et les zones intertrigineuses et génitales.
Une interruption du traitement par l’upadacitinib devra être envisagée chez tout patient ne montrant pas de signe de bénéfice clinique après 12 semaines de traitement.
Rectocolite hémorragique
Induction
La dose d’induction recommandée d'upadacitinib est de 45 mg une fois par jour pendant 8 semaines. Les patients qui n’ont pas obtenu un bénéfice thérapeutique adéquat à la semaine 8 peuvent poursuivre l'upadacitinib à la dose de 45 mg une fois par jour pendant 8 semaines supplémentaires (voir rubrique 5.1). Le traitement par l'upadacitinib doit être interrompu chez tout patient ne montrant pas de signe de bénéfice thérapeutique à la semaine 16.
Entretien
La dose d'entretien recommandée d'upadacitinib est de 15 mg ou 30 mg une fois par jour, selon les caractéristiques individuelles de chaque patient :
- Une dose de 15 mg est recommandée pour les patients présentant un risque accru de maladie thromboembolique veineuse (MTEV), d’événements indésirables cardiovasculaires majeurs (EICM) et de tumeur maligne (voir rubrique 4.4).
- Une dose de 30 mg une fois par jour peut être appropriée pour certains patients, comme ceux ayant un fort retentissement de la maladie ou ayant nécessité un traitement d'induction de 16 semaines qui ne présentent pas un risque accru de MTEV, de EICM et de tumeur maligne (voir rubrique 4.4) ou qui ne montrent pas un bénéfice thérapeutique adéquat à la dose de 15 mg une fois par jour.
- La dose efficace la plus faible permettant le maintien de la réponse doit être utilisée.
Pour les patients âgés de 65 ans et plus, la dose recommandée est de 15 mg une fois par jour (voir rubrique 4.4).
Chez les patients ayant répondu au traitement par l’upadacitinib, les corticoïdes peuvent être réduits et/ou interrompus, conformément aux soins habituels.
Maladie de Crohn
Induction
La dose d’induction recommandée d’upadacitinib est de 45 mg une fois par jour pendant 12 semaines. Chez les patients qui n’ont pas obtenu un bénéfice thérapeutique adéquat après le traitement d’induction initial de 12 semaines, un traitement d’induction prolongé pendant 12 semaines supplémentaires à la dose de 30 mg une fois par jour peut être considéré. Chez ces patients, le traitement par l’upadacitinib doit être interrompu en l’absence de signe de bénéfice thérapeutique après 24 semaines.
Entretien
La dose d’entretien recommandée d’upadacitinib est de 15 mg ou 30 mg une fois par jour, selon les caractéristiques individuelles de chaque patient :
- Une dose de 15 mg est recommandée pour les patients présentant un risque accru de maladie thromboembolique veineuse (MTEV), d’événements indésirables cardiovasculaires majeurs (EICM) et de tumeur maligne (voir rubrique 4.4).
- Une dose de 30 mg une fois par jour peut être appropriée pour les patients ayant un fort retentissement de la maladie qui ne présentent pas un risque accru de MTEV, d’EICM et de tumeur maligne (voir rubrique 4.4) ou qui ne montrent pas un bénéfice thérapeutique adéquat à la dose de 15 mg une fois par jour.
- La dose efficace la plus faible permettant le maintien de la réponse doit être utilisée.
Pour les patients âgés de 65 ans et plus, la dose d’entretien recommandée est de 15 mg une fois par jour (voir rubrique 4.4).
Chez les patients ayant répondu au traitement par l’upadacitinib, les corticoïdes peuvent être réduits et/ou interrompus, conformément aux soins habituels.
Interactions
Pour les patients atteints de rectocolite hémorragique et de la maladie de Crohn recevant des inhibiteurs puissants du cytochrome P450 (CYP) 3A4 (par exemple, kétoconazole, clarithromycine), la dose d'induction recommandée est de 30 mg une fois par jour et la dose d'entretien recommandée est de 15 mg une fois par jour (voir rubrique 4.5).
Instauration du traitement
Le traitement ne doit pas être instauré chez les patients présentant un nombre absolu de lymphocytes (NAL) < 0,5 x 109 cellules/L, un nombre absolu de neutrophiles (NAN) < 1 x 109 cellules/L ou dont le taux d’hémoglobine (Hb) est < 8 g/dL (voir rubriques 4.4 et 4.8).
Interruption du traitement
Le traitement doit être interrompu si un patient développe une infection grave et ce jusqu’à ce que l’infection soit contrôlée.
L’interruption du traitement peut être nécessaire pour la gestion des résultats d’analyse anormaux décrits dans le Tableau 1.
Tableau 1 Paramètres biologiques et recommandations de surveillance
Paramètres biologiques | Action | Recommandations de surveillance |
Nombre Absolu de Neutrophiles (NAN) | Le traitement doit être interrompu si le NAN est < 1 x 109 cellules/L et peut être redémarré dès que le NAN repasse au-dessus de cette valeur | Évaluer au départ, puis au plus tard 12 semaines après l’instauration du traitement. Par la suite, évaluer selon la prise en charge individuelle du patient. |
Nombre Absolu de Lymphocytes (NAL) | Le traitement doit être interrompu si le NAL est < 0,5 x 109 cellules/L et peut être redémarré dès que le NAL repasse au-dessus de cette valeur | |
Hémoglobine (Hb) | Le traitement doit être interrompu si le taux d’Hb est < 8 g/dl et peut être redémarré dès que le taux d’Hb repasse au‑dessus de cette valeur | |
Transaminases hépatiques | Le traitement doit être interrompu temporairement si une lésion hépatique liée au médicament est suspectée | Évaluer au départ et ensuite selon la prise en charge habituelle du patient. |
Lipides | Les patients doivent être pris en charge conformément aux recommandations cliniques internationales sur l’hyperlipidémie | Évaluer 12 semaines après le début du traitement et ensuite conformément aux recommandations cliniques internationales sur l’hyperlipidémie |
Populations particulières
Personnes âgées
Polyarthrite rhumatoïde, rhumatisme psoriasique et spondyloarthrite axiale
Les données disponibles chez les patients âgés de 75 ans et plus sont limitées (voir rubrique 4.4).
Dermatite atopique
Pour la dermatite atopique, des doses supérieures à 15 mg une fois par jour ne sont pas recommandées chez les patients âgés de 65 ans et plus (voir rubriques 4.4 et 4.8).
Rectocolite hémorragique et maladie de Crohn
Pour la rectocolite hémorragique et la maladie de Crohn, des doses supérieures à 15 mg une fois par jour en traitement d'entretien ne sont pas recommandées chez les patients âgés de 65 ans et plus (voir rubriques 4.4 et 4.8). La tolérance et l’efficacité de l'upadacitinib chez les patients âgés de 75 ans et plus n’ont pas encore été établies.
Insuffisance rénale
Aucun ajustement posologique n’est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée. Les données disponibles sont limitées sur l’utilisation de l’upadacitinib chez les patients ayant une insuffisance rénale sévère (voir rubrique 5.2). L’upadacitinib doit être utilisé avec précaution chez les patients ayant une insuffisance rénale sévère, comme décrit dans le tableau 2. L’utilisation de l’upadacitinib chez les patients en insuffisance rénale terminale n’a pas été étudiée et n’est par conséquent pas recommandée chez ces patients.
Tableau 2 Dose recommandée en cas d'insuffisance rénale sévèrea
Indication thérapeutique | Dose recommandée une fois par jour |
Polyarthrite rhumatoïde, rhumatisme psoriasique, spondyloarthrite axiale, artérite à cellules géantes, dermatite atopique | 15 mg |
Rectocolite hémorragique, maladie de Crohn | Induction : 30 mg |
Entretien : 15 mg | |
aDébit de filtration glomérulaire estimé (DFGe) de 15 à < 30 mL/min/1,73 m² | |
Insuffisance hépatique
Aucun ajustement posologique n’est nécessaire chez les patients ayant une insuffisance hépatique légère (grade A de Child-Pugh) ou modérée (grade B de Child-Pugh) (voir rubrique 5.2). L’upadacitinib ne doit pas être utilisé chez les patients ayant une insuffisance hépatique sévère (grade C de Child-Pugh) (voir rubrique 4.3).
Population pédiatrique
La tolérance et l’efficacité de RINVOQ chez les enfants atteints de dermatite atopique âgés de moins de 12 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
La tolérance et l’efficacité de RINVOQ chez les enfants et les adolescents atteints de polyarthrite rhumatoïde, de rhumatisme psoriasique, de spondyloarthrite axiale, de rectocolite hémorragique et de la maladie de Crohn âgés de 0 à moins de 18 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
Il n’existe pas d’utilisation justifiée de RINVOQ dans la population pédiatrique dans l’indication de l’artérite à cellules géantes.
Mode d’administration
RINVOQ doit être pris par voie orale une fois par jour avec ou sans aliments et peut être pris à tout moment de la journée. Les comprimés doivent être avalés entiers et ne doivent pas être cassés, écrasés ou mâchés afin d’assurer que toute la dose est correctement administrée.
4.3 Contre-indications
- Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
- Tuberculose (TB) active ou infections graves actives (voir rubrique 4.4).
- Insuffisance hépatique sévère (voir rubrique 4.2).
- Grossesse (voir rubrique 4.6).
4.8 Effets indésirables
Résumé du profil de tolérance
Dans les essais cliniques contrôlés par placebo pour la polyarthrite rhumatoïde, le rhumatisme psoriasique et la spondyloarthrite axiale, les effets indésirables les plus fréquemment rapportés (≥2 % des patients dans au moins une des indications avec le taux le plus élevé parmi les indications présentées) avec l’upadacitinib 15 mg ont été les infections des voies respiratoires supérieures (19,5 %), l’augmentation de la créatine phosphokinase (CPK) dans le sang (8,6 %), l’augmentation de l’alanine transaminase (4,3 %), les bronchites (3,9 %), les nausées (3,5 %), la neutropénie (2,8 %), la toux (2,2 %), l’augmentation de l’aspartate transaminase (2,2 %) et l’hypercholestérolémie (2,2 %).
Dans les essais cliniques contrôlés par placebo pour la dermatite atopique, les effets indésirables les plus fréquemment rapportés (≥2 % des patients) avec l’upadacitinib 15 mg ou 30 mg ont été les infections des voies respiratoires supérieures (25,4 %), l’acné (15,1 %), l’herpès (8,4 %), les céphalées (6,3 %), l’augmentation de la créatine phosphokinase (CPK) dans le sang (5,5 %), la toux (3,2 %), la folliculite (3,2 %), les douleurs abdominales (2,9 %), les nausées (2,7 %), la neutropénie (2,3 %), la pyrexie (2,1 %) et la grippe (2,1 %).
Dans les essais cliniques contrôlés par placebo dans la rectocolite hémorragique et la maladie de Crohn en traitement d'induction et d'entretien, les effets indésirables les plus fréquemment rapportés (≥ 3 % des patients) avec l’upadacitinib 45 mg, 30 mg ou 15 mg ont été les infections des voies respiratoires supérieures (19,9 %), la pyrexie (8,7 %), l’augmentation de la CPK dans le sang (7,6 %), l’anémie (7,4 %), les céphalées (6,6 %), l'acné (6,3 %), le zona (6,1 %), la neutropénie (6,0 %), le rash (5,2 %), la pneumonie (4,1 %), l'hypercholestérolémie (4,0 %), la bronchite (3,9 %), l’augmentation de l’aspartate aminotransférase (3,9 %), la fatigue (3,9 %), la folliculite (3,6 %), l’augmentation de l’alanine aminotransférase (3,5 %), l'herpès (3,2 %) et la grippe (3,2 %).
Les effets indésirables graves les plus fréquents ont été les infections graves (voir rubrique 4.4).
Le profil de tolérance de l’upadacitinib lors d’un traitement à long terme a été généralement similaire au profil de tolérance observé pendant la phase contrôlée par placebo dans l’ensemble des indications.
Liste tabulée des effets indésirables
La liste suivante d’effets indésirables est basée sur les études cliniques et sur l’expérience après commercialisation. La fréquence des effets indésirables listés ci-dessous est définie selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100). Les fréquences indiquées dans le Tableau 3 reposent sur les taux d’effets indésirables les plus élevés signalés avec RINVOQ dans les essais cliniques sur les maladies rhumatismales (15 mg), la dermatite atopique (15 mg et 30 mg), la rectocolite hémorragique (15 mg, 30 mg et 45 mg) ou la maladie de Crohn (15 mg, 30 mg et 45 mg). Lorsque des différences notables de fréquence ont été observées entre les indications, ces différences sont présentées dans les notes en dessous du tableau.
Tableau 3 Effets indésirables
Classe de système d’organe | Très fréquent | Fréquent | Peu fréquent |
Infections et infestations | Infections des voies respiratoires supérieuresa | Bronchitea,b | Candidose buccale |
Tumeurs bénignes, malignes et non précisées (incluant kystes et polypes) |
| Cancer cutané non mélanomef |
|
Affections hématologiques et du système lymphatique |
| Anémiea |
|
Affections du système immunitaire |
| Urticairec,g | Réactions d’hypersensibilité gravesa,e |
Troubles du métabolisme et de la nutrition |
| Hypercholestérolémiea,b | Hypertriglycéridémie |
Affections du système nerveux |
| Céphaléesa,j |
|
Affections de l’oreille et du labyrinthe |
| Vertigesa |
|
Affections respiratoires, thoraciques et médiastinales |
| Toux |
|
Affections gastro-intestinales |
| Douleurs abdominalesa | Perforation gastro-intestinalei |
Affections de la peau et du tissu sous‑cutané | Acnéa,c,d,g | Rasha |
|
Troubles généraux et anomalies au site d’administration |
| Fatigue |
|
Investigations |
| Augmentation de la CPK dans le sang |
|
a Présentées par terme groupé | |||
Description des effets indésirables sélectionnés
Polyarthrite rhumatoïde
Infections
Dans les études cliniques contrôlées par placebo en association avec des DMARDs, la fréquence des infections pendant 12/14 semaines dans le groupe upadacitinib 15 mg était de 27,4 % par rapport à 20,9 % dans le groupe placebo. Dans des études contrôlées par le méthotrexate (MTX), la fréquence des infections pendant 12/14 semaines dans le groupe monothérapie upadacitinib 15 mg était de 19,5 % par rapport à 24,0 % dans le groupe MTX. Le taux global d’infections à long terme pour le groupe upadacitinib 15 mg au cours des cinq études cliniques de phase 3 (2 630 patients) était de 93,7 évènements pour 100 patients-années.
Dans des études cliniques contrôlées par placebo en association avec des DMARDs, la fréquence des infections graves pendant 12/14 semaines dans le groupe upadacitinib 15 mg était de 1,2 %, par rapport à 0,6 % dans le groupe placebo. Dans des études contrôlées par MTX, la fréquence des infections graves pendant 12/14 semaines dans le groupe monothérapie upadacitinib 15 mg était de 0,6 % par rapport à 0,4 % dans le groupe MTX. Le taux global d’infections graves à long terme pour le groupe upadacitinib 15 mg au cours des cinq études cliniques de phase 3 était de 3,8 événements pour 100 patients-années. L’infection grave la plus fréquente était la pneumonie. Le taux d’infections graves est resté stable lors d’une exposition à long terme.
Infections opportunistes (à l’exclusion de la tuberculose)
Dans les études cliniques contrôlées par placebo en association avec des DMARDs, la fréquence des infections opportunistes pendant 12/14 semaines dans le groupe upadacitinib 15 mg était de 0,5 %, par rapport à 0,3 % dans le groupe placebo. Dans des études contrôlées par MTX, il n’y a pas eu de cas d’infection opportuniste pendant 12/14 semaines dans le groupe monothérapie upadacitinib 15 mg et 0,2 % dans le groupe MTX. Le taux global d’infections opportunistes à long terme pour le groupe upadacitinib 15 mg au cours des cinq études cliniques de phase 3 était de 0,6 événements pour 100 patients-années.
Le taux à long terme de zona pour le groupe upadacitinib 15 mg au cours des cinq études cliniques de phase 3 a été de 3,7 événements pour 100 patients-années. La plupart des cas de zona impliquaient un seul dermatome et étaient non graves.
Augmentation des transaminases hépatiques
Dans des études contrôlées par placebo en association avec des DMARDs, pendant 12/14 semaines, une augmentation de l’alanine transaminase (ALAT) et de l’aspartate transaminase (ASAT) ≥ 3 x la limite supérieure de la normale (LSN) dans au moins une mesure a été observée chez 2,1 % et 1,5 % des patients traités avec l’upadacitinib 15 mg, par rapport à 1,5 % et 0,7 %, respectivement, des patients traités avec le placebo. Sur les 22 cas d’augmentation des transaminases hépatiques, la plupart étaient asymptomatiques et transitoires.
Dans des études contrôlées par MTX, pendant 12/14 semaines, une augmentation d’ALAT et d’ASAT ≥ 3 x LSN dans au moins une mesure a été observée chez 0,8 % et 0,4 % des patients traités avec l’upadacitinib 15 mg, par rapport à 1,9 % et 0,9 %, respectivement, chez des patients traités au MTX.
La tendance et l’incidence de l’augmentation de l’ALAT/ASAT sont restées stables au cours du temps, y compris dans les études d’extension à long terme.
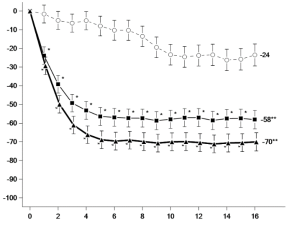
Augmentations des lipides
Le traitement avec l’upadacitinib 15 mg a été associé à des augmentations des paramètres lipidiques, incluant le cholestérol total, les triglycérides, le LDL- cholestérol et le HDL-cholestérol. Le rapport LDL/HDL n’a pas changé. Des augmentations ont été observées après 2 à 4 semaines de traitement et sont restées stables avec un traitement à long terme.
Parmi les patients des études contrôlées dont les valeurs initiales étaient inférieures aux limites définies, un dépassement des limites définies a été observé au moins une fois pendant 12/14 semaines aux fréquences suivantes (y compris les patients qui ont une valeur élevée isolée) :
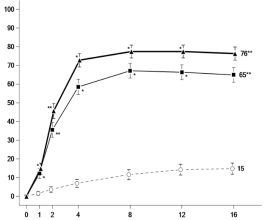
- Cholestérol total ≥ 5,17 mmol/l (200 mg/dl) : 62 % par rapport à 31 %, dans les groupes upadacitinib 15 mg et placebo, respectivement
- Cholestérol LDL≥ 3,36 mmol/l (130 mg/dl) : 42 % par rapport à 19 %, dans les groupes upadacitinib 15 mg et placebo, respectivement
- Cholestérol HDL ≥ 1,03 mmol/l (40 mg/dl) : 89 % par rapport à 61 %, dans les groupes upadacitinib 15 mg et placebo, respectivement
- Triglycérides ≥ 2,26 mmol/l (200 mg/dl) : 25 % par rapport à 15 %, dans les groupes upadacitinib 15 mg et placebo, respectivement
Créatine phosphokinase
Dans des études contrôlées par placebo en association avec des DMARDs, pendant 12/14 semaines, une augmentation des valeurs de CPK a été observée. Des augmentations de CPK > 5 x la limite supérieure de la normale (LSN) ont été rapportées chez 1,0 % et 0,3 % des patients pendant 12/14 semaines dans les groupes upadacitinib 15 mg et placebo, respectivement. La plupart des augmentations > 5 x LSN étaient transitoires et n’ont pas nécessité l’arrêt du traitement. Les valeurs moyennes de CPK ont augmenté après 4 semaines avec une augmentation moyenne de 60 U /l à 12 semaines, puis sont restées stables à des valeurs élevées par la suite, y compris avec un traitement prolongé.
Neutropénie
Dans les études contrôlées par placebo en association avec des DMARDs, pendant 12/14 semaines, une diminution du nombre de neutrophiles en dessous de 1 x 109 cellules/L dans au moins une mesure est survenue chez 1,1 % et < 0,1 % des patients des groupes upadacitinib 15 mg et placebo, respectivement. Dans les études cliniques, le traitement a été interrompu en réponse à un NAN < 1 x 109 cellules/L (voir rubrique 4.2). Le nombre moyen de neutrophiles a diminué en 4 à 8 semaines. La diminution du nombre de neutrophiles est restée stable à des valeurs inférieures à la valeur initiale au cours du temps, y compris avec un traitement prolongé.
Rhumatisme psoriasique
Globalement, le profil de tolérance observé chez les patients atteints de rhumatisme psoriasique actif traités avec l’upadacitinib 15 mg était similaire à celui observé chez les patients atteints de polyarthrite rhumatoïde. Un taux d’infections graves plus élevé (2,6 événements pour 100 patients‑année et 1,3 événement pour 100 patients-année, respectivement) et une augmentation des transaminases hépatiques (élévations des ALAT de grade 3 et taux plus élevés 1,4 % et 0,4 %, respectivement) ont été observés chez les patients traités avec l’upadacitinib en association au MTX par rapport aux patients traités en monothérapie.
Spondyloarthrite axiale
Globalement, le profil de tolérance observé chez les patients atteints de spondyloarthrite axiale active traités avec l’upadacitinib 15 mg était similaire à celui observé chez les patients atteints de polyarthrite rhumatoïde. Aucun nouveau signal de tolérance n’a été identifié.
Artérite à cellules géantes
Globalement, le profil de tolérance observé chez les patients atteints d’artérite à cellules géantes traités avec l’upadacitinib 15 mg était généralement similaire au profil de tolérance connu de l’upadacitinib.
Infections graves
Dans l’étude clinique contrôlée par placebo, la fréquence des infections graves sur 52 semaines était de 5,7 % dans le groupe upadacitinib 15 mg et de 10,7 % dans le groupe placebo. Le taux à long terme d’infections graves dans le groupe upadacitinib 15 mg était de 2,9 événements pour 100 patients-années.
Infections opportunistes (à l’exclusion de la tuberculose)
Dans l’étude clinique contrôlée par placebo, la fréquence des infections opportunistes (à l’exclusion de la tuberculose et du zona) sur 52 semaines était de 1,9 % dans le groupe upadacitinib 15 mg et de 0,9 % dans le groupe placebo. Le taux à long terme d’infections opportunistes (à l’exclusion de la tuberculose et du zona) dans le groupe upadacitinib 15 mg était de 0,6 événement pour 100 patients-années.
Dans l’étude clinique contrôlée par placebo, la fréquence du zona sur 52 semaines était de 5,3 % dans le groupe upadacitinib 15 mg et de 2,7 % dans le groupe placebo. Le taux à long terme de zona dans le groupe upadacitinib 15 mg était de 4,1 événements pour 100 patients-années.
Dermatite atopique
Infections
Pendant la phase contrôlée par placebo des études cliniques, la fréquence des infections pendant 16 semaines dans les groupes upadacitinib 15 mg et 30 mg était, respectivement, de 39 % et 43 %, contre 30 % dans le groupe placebo. Le taux à long terme d’infections dans les groupes upadacitinib 15 mg et 30 mg était, respectivement, de 98,5 et 109,6 événements pour 100 patients-années.
Dans les études cliniques contrôlées par placebo, la fréquence des infections graves pendant 16 semaines dans les groupes upadacitinib 15 mg et 30 mg était, respectivement, de 0,8 % et 0,4 %, contre 0,6 % dans le groupe placebo. Le taux à long terme d’infections graves dans les groupes upadacitinib 15 mg et 30 mg était, respectivement, de 2,3 et 2,8 événements pour 100 patients-années.
Infections opportunistes (à l’exclusion de la tuberculose)
Pendant la phase contrôlée par placebo des études cliniques, toutes les infections opportunistes signalées (à l’exclusion de la tuberculose et du zona) étaient des cas d’eczéma herpétiforme. La fréquence d’eczéma herpétiforme pendant 16 semaines dans les groupes upadacitinib 15 mg et 30 mg était respectivement de 0,7 % et 0,8 %, contre 0,4 % dans le groupe placebo. Le taux à long terme d’eczéma herpétiforme dans les groupes upadacitinib 15 mg et 30 mg était respectivement de 1,6 et 1,8 événement pour 100 patients-années. Un cas de candidose œsophagienne a été signalé avec l’upadacitinib 30 mg.
Le taux à long terme de zona dans les groupes upadacitinib 15 mg et 30 mg était respectivement de 3,5 et 5,2 événements pour 100 patients-années. La plupart des cas de zona impliquaient un seul dermatome et étaient non graves.
Anomalies biologiques
Les variations dose-dépendantes d’augmentation de l’ALAT et/ou d’augmentation de l’ASAT (≥ 3 x LSN), des paramètres lipidiques, des valeurs de la CPK (> 5 x LSN) et de la neutropénie (NAN < 1 x 109 cellules/L) associées au traitement par l’upadacitinib ont été similaires à celles observées dans les études cliniques sur les maladies rhumatismales.
De faibles augmentations du LDL-cholestérol ont été observées après la semaine 16 dans les études sur la dermatite atopique. A la semaine 52, l’augmentation moyenne du LDL-cholestérol par rapport à l’inclusion était de 0,41 mmol/L pour upadacitinib 15 mg et de 0,56 mmol/L pour upadacitinib 30 mg.
Rectocolite hémorragique
Le profil de tolérance global observé chez les patients atteints de rectocolite hémorragique était généralement similaire à celui observé chez les patients atteints de polyarthrite rhumatoïde.
Un taux de zona plus élevé a été observé avec un traitement d’induction de 16 semaines qu’avec un traitement de 8 semaines.
Infections
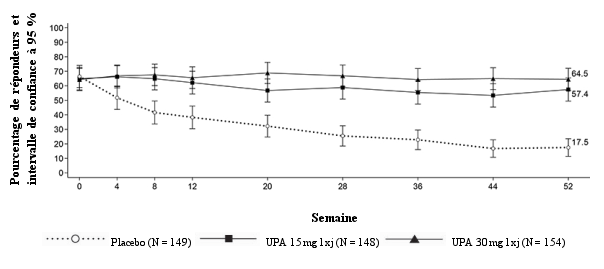
Dans les études d’induction contrôlées par placebo, la fréquence des infections pendant 8 semaines dans le groupe upadacitinib 45 mg était de 20,7 %, contre 17,5 % dans le groupe placebo. Dans l'étude d’entretien contrôlée par placebo, la fréquence des infections pendant 52 semaines dans les groupes upadacitinib 15 mg et 30 mg était de 40,4 % et 44,2 %, respectivement, contre 38,8 % dans le groupe placebo. Le taux d’infections à long terme dans les groupes upadacitinib 15 mg et 30 mg était respectivement de 64,5 et 77,8 événements pour 100 patient-années.
Dans les études d’induction contrôlées par placebo, la fréquence des infections graves pendant 8 semaines était de 1,3 % dans le groupe upadacitinib 45 mg et dans le groupe placebo. Aucune infection grave supplémentaire n'a été observée pendant les 8 semaines supplémentaires de traitement par l’upadacitinib 45 mg. Dans l'étude d’entretien contrôlée par placebo, la fréquence des infections graves pendant 52 semaines dans les groupes upadacitinib 15 mg et 30 mg était de 3,6 % et 3,2 %, respectivement, contre 3,3 % dans le groupe placebo. Le taux d’infections graves à long terme dans les groupes upadacitinib 15 mg et 30 mg était, respectivement, de 3,0 et 4,6 événements pour 100 patient-années. L'infection grave la plus fréquemment rapportée dans les phases d'induction et d'entretien était la pneumonie à Covid-19.
Infections opportunistes (à l’exclusion de la tuberculose)
Dans les études d’induction contrôlées par placebo de 8 semaines, la fréquence des infections opportunistes (à l’exclusion de la tuberculose et du zona) dans le groupe upadacitinib 45 mg était de 0,4 %, contre 0,3 % dans le groupe placebo. Aucune infection opportuniste supplémentaire (à l’exclusion de la tuberculose et du zona) n'a été observée pendant les 8 semaines supplémentaires de traitement par l’upadacitinib 45 mg. Dans l'étude d’entretien contrôlée par placebo de 52 semaines, la fréquence des infections opportunistes (à l’exclusion de la tuberculose et du zona) dans les groupes upadacitinib 15 mg et 30 mg était de 0,8 % et 0,8 %, respectivement, contre 0,8 % dans le groupe placebo. Le taux d’infections opportunistes à long terme (à l’exclusion de la tuberculose et du zona) dans les groupes upadacitinib 15 mg et 30 mg était respectivement de 0,3 et 0,6 événement pour 100 patient-années.
Dans les études d’induction contrôlées par placebo de 8 semaines, la fréquence du zona dans le groupe upadacitinib 45 mg était de 0,6 %, contre 0 % dans le groupe placebo. La fréquence du zona était de 3,9 % pendant le traitement de 16 semaines par l’upadacitinib 45 mg. Dans l'étude d’entretien contrôlée par placebo de 52 semaines, la fréquence du zona dans les groupes upadacitinib 15 mg et 30 mg était de 4,8 % et 5,6 %, respectivement, contre 0 % dans le groupe placebo. Le taux de zona à long terme dans les groupes upadacitinib 15 mg et 30 mg était respectivement de 4,5 et 7,2 événements pour 100 patient-années.
Perforations gastro-intestinales
Au cours de la période d’entretien contrôlée par placebo, une perforation gastro-intestinale a été rapportée chez 1 patient recevant le placebo (1,5 pour 100 patients-années) et chez aucun patient traité par l’upadacitinib 15 mg ou 30 mg. Dans l’étude d’extension à long terme, 1 patient traité par l’upadacitinib 15 mg (0,1 pour 100 patients-années) et 1 patient traité par l’upadacitinib 30 mg (<0,1 pour 100 patients-années) ont rapporté des événements.
Anomalies biologiques
Dans les études cliniques d'induction et d'entretien, les variations des paramètres biologiques telles que l’augmentation de l’ALAT et/ou de l’ASAT (≥ 3 x LSN), des valeurs de la CPK (> 5 x LSN) et de la neutropénie (NAN < 1 x 109 cellules/L) associées au traitement par l’upadacitinib ont été généralement similaires à celles observées dans les études cliniques sur les maladies rhumatismales et la dermatite atopique. Des variations dose-dépendantes de ces paramètres biologiques associées au traitement par l’upadacitinib 15 mg et 30 mg ont été observées.
Dans les études d’induction contrôlées par placebo jusqu’à 8 semaines, des diminutions du nombre de lymphocytes au-dessous de 0,5 x 109 cellules/L lors d'au moins une mesure sont survenues chez 2,0 % et 0,8 % des patients des groupes upadacitinib 45 mg et placebo, respectivement. Dans l'étude d’entretien contrôlée par placebo jusqu’à 52 semaines, des diminutions du nombre de lymphocytes au-dessous de 0,5 x 109 cellules/L lors d'au moins une mesure sont survenues chez 1,6 %, 1,2 % et 0,8 % des patients des groupes upadacitinib 15 mg, 30 mg et placebo, respectivement. Dans les études cliniques, le traitement a été interrompu suite à un NAL < 0,5 x 109 cellules/L (voir rubrique 4.2). Aucune variation moyenne notable du nombre de lymphocytes n'a été observée au cours du temps pendant le traitement par l’upadacitinib.
Des élévations des paramètres lipidiques ont été observées à 8 semaines de traitement par l’upadacitinib 45 mg et sont généralement restées stables avec un traitement à plus long terme par l’upadacitinib 15 mg et 30 mg. Parmi les patients des études d’induction contrôlées par placebo dont les valeurs initiales étaient inférieures aux limites définies, un dépassement des limites définies a été observé au moins une fois pendant 8 semaines aux fréquences suivantes (y compris les patients qui ont une valeur élevée isolée) :
- Cholestérol total ≥ 5,17 mmol/l (200 mg/dl) : 49 % par rapport à 11 %, dans les groupes upadacitinib 45 mg et placebo, respectivement
- Cholestérol LDL ≥ 3,36 mmol/l (130 mg/dl) : 27 % par rapport à 9 %, dans les groupes upadacitinib 45 mg et placebo, respectivement
- Cholestérol HDL ≥ 1,03 mmol/l (40 mg/dl) : 79 % par rapport à 36 %, dans les groupes upadacitinib 45 mg et placebo, respectivement
- Triglycérides ≥ 2,26 mmol/l (200 mg/dl) : 6 % par rapport à 4 % dans les groupes upadacitinib 45 mg et placebo, respectivement
Maladie de Crohn
Globalement, le profil de tolérance observé chez les patients atteints de la maladie de Crohn traités par l’upadacitinib concordait avec le profil de tolérance connu du médicament.
Infections graves
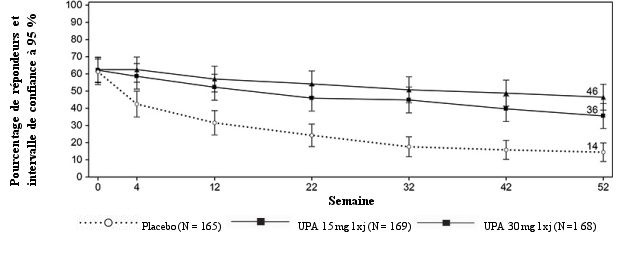
Dans les études d’induction contrôlées par placebo, la fréquence des infections graves pendant 12 semaines dans le groupe upadacitinib 45 mg était de 1,9 % contre 1,7 % dans le groupe placebo. Dans l’étude d’entretien contrôlée par placebo, la fréquence des infections graves pendant 52 semaines dans les groupes upadacitinib 15 mg et 30 mg était de 3,2 % et 5,7 % respectivement, contre 4,5 % dans le groupe placebo. Chez les patients ayant répondu à l’upadacitinib 45 mg en traitement d’induction, le taux d’infections graves à long terme dans les groupes upadacitinib 15 mg et 30 mg était de 5,1 et 7,3 événements pour 100 patients‑années respectivement. Les infections graves les plus fréquemment rapportées dans les études d’induction et d’entretien étaient les infections gastro‑intestinales.
Perforations gastro-intestinales
Au cours de la période des études d’induction de phase 3 contrôlées par placebo, une perforation gastro-intestinale a été rapportée chez 1 patient (0,1%) traité par l’upadacitinib 45 mg et chez aucun patient recevant le placebo au terme des 12 semaines. Chez tous les patients traités par l’upadacitinib 45 mg (n=938) au cours des études d'induction, une perforation gastro-intestinale a été rapportée chez 4 patients (0,4%).
Au cours de la période à long terme contrôlée par placebo, une perforation gastro-intestinale a été rapportée chez 1 patient traité par placebo (0,7 pour 100 patients-années), 1 patient traité par l’upadacitinib 15 mg (0,4 pour 100 patients-années) et 1 patient traité par l’upadacitinib 30 mg (0,4 pour 100 patients-années). Parmi tous les patients recevant un traitement de secours par l’upadacitinib 30 mg (n=336), une perforation gastro-intestinale a été rapportée chez 3 patients (0,8 pour 100 patients-années) au cours du traitement à long terme.
Anomalies biologiques
Dans les études cliniques d’induction et d’entretien, les variations des paramètres biologiques telles que l’augmentation de l’ASAT et/ou de l’ALAT (≥ 3 x LSN), des valeurs de la CPK (> 5 x LSN), de la neutropénie (NAN < 1 x 109 cellules/L) et des paramètres lipidiques associées au traitement par l’upadacitinib ont été généralement similaires à celles observées dans les études cliniques sur les maladies rhumatismales, la dermatite atopique et la rectocolite hémorragique. Des variations dose‑dépendantes de ces paramètres biologiques associées au traitement par l’upadacitinib 15 mg et 30 mg ont été observées.
Dans les études d’induction contrôlées par placebo d’une durée allant jusqu’à 12 semaines, des diminutions du nombre de lymphocytes au‑dessous de 0,5 x 109 cellules/L lors d’au moins une mesure sont survenues chez 2,2 % et 2,0 % des patients des groupes upadacitinib 45 mg et placebo, respectivement. Dans l’étude d’entretien contrôlée par placebo d’une durée allant jusqu’à 52 semaines, des diminutions du nombre de lymphocytes au‑dessous de 0,5 x 109 cellules/L lors d’au moins une mesure sont survenues chez 4,6 %, 5,2 % et 1,8 % des patients des groupes upadacitinib 15 mg, 30 mg et placebo, respectivement. Dans les études cliniques, le traitement a été interrompu suite à un NAL < 0,5 x 109 cellules/L (voir rubrique 4.2). Aucune variation moyenne notable du nombre de lymphocytes n’a été observée au cours du temps pendant le traitement par l’upadacitinib.
Dans les études d’induction contrôlées par placebo d’une durée allant jusqu’à 12 semaines, des diminutions du taux d’hémoglobine au-dessous de 8 g/dL lors d’au moins une mesure sont survenues chez 2,7 % et 1,4 % des patients des groupes upadacitinib 45 mg et placebo, respectivement. Dans l’étude d’entretien contrôlée par placebo d’une durée allant jusqu’à 52 semaines, des diminutions du taux d’hémoglobine au-dessous de 8 g/dL lors d’au moins une mesure sont survenues chez 1,4 %, 4,4 % et 2,8 % des patients des groupes upadacitinib 15 mg, 30 mg et placebo, respectivement. Dans les études cliniques, le traitement a été interrompu suite à un taux d’hémoglobine < 8 g/dL (voir rubrique 4.2). Aucune variation moyenne notable du taux d’hémoglobine n’a été observée au cours du temps pendant le traitement par l’upadacitinib.
Personnes âgées
D’après les données limitées chez des patients âgés de 65 ans et plus atteints de dermatite atopique, de rectocolite hémorragique ou de la maladie de Crohn, le taux global d’événements indésirables a été plus élevé avec la dose de 30 mg d’upadacitinib qu’avec la dose de 15 mg (voir rubrique 4.4).
Population pédiatrique
Au total, 541 adolescents âgés de 12 à 17 ans atteints de dermatite atopique ont été traités dans les études mondiales de phase 3 (n=343) et dans les sous-études complémentaires chez l’adolescent (n=198), parmi lesquels 264 ont été exposés à la dose de 15 mg et 265 ont été exposés à la dose de 30 mg. Le profil de tolérance de l’upadacitinib 15 mg et 30 mg chez les adolescents a été similaire à celui observé chez les adultes. Lors d’une exposition à long terme, l’effet indésirable papillome cutané a été rapporté chez 3,4% et 6,8% des patients adolescents atteints de dermatite atopique dans les groupes upadacitinib 15 mg et 30 mg, respectivement.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance :
Site internet : www.notifieruneffetindesirable.be
e-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la
Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
AbbVie Deutschland GmbH & Co. KG
Knollstrasse
67061 Ludwigshafen
Allemagne
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/19/1404/001
EU/1/19/1404/002
EU/1/19/1404/003
EU/1/19/1404/004
EU/1/19/1404/005
EU/1/19/1404/006
EU/1/19/1404/007
EU/1/19/1404/008
EU/1/19/1404/009
EU/1/19/1404/010
EU/1/19/1404/011
10. DATE DE MISE À JOUR DU TEXTE
06/2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3963147 | RINVOQ 15MG LIBERATION PROLONGEE COMP 28 | L04AA44 | € 821,74 | - | Oui | € 12,5 | € 8,3 |
| 3963154 | RINVOQ 15MG LIBEERATION PROLONGEE COMP 98 | L04AA44 | € 2507,85 | - | Oui | € 15,5 | € 10,2 |
| 4404877 | RINVOQ 30MG LIBERATION PROLONGEE COMP 28 | L04AA44 | € 1220,84 | - | Oui | € 12,5 | € 8,3 |
| 4404885 | RINVOQ 30MG LIBERATION PROLONGEE COMP 98 | L04AA44 | € 3399,06 | - | Oui | € 15,5 | € 10,2 |
| 4550802 | RINVOQ 45MG LIBERATION PROLONGEE COMP 28 | € 1851,44 | - | Oui | € 12,5 | € 8,3 |