1. DÉNOMINATION DU MÉDICAMENT
Briviact 10 mg, comprimé pelliculé
Briviact 25 mg, comprimé pelliculé
Briviact 50 mg, comprimé pelliculé
Briviact 75 mg, comprimé pelliculé
Briviact 100 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Briviact 10 mg, comprimé pelliculé
Chaque comprimé pelliculé contient 10 mg de brivaracétam.
Briviact 25 mg, comprimé pelliculé
Chaque comprimé pelliculé contient 25 mg de brivaracétam.
Briviact 50 mg, comprimé pelliculé
Chaque comprimé pelliculé contient 50 mg de brivaracétam.
Briviact 75 mg, comprimé pelliculé
Chaque comprimé pelliculé contient 75 mg de brivaracétam.
Briviact 100 mg, comprimé pelliculé
Chaque comprimé pelliculé contient 100 mg de brivaracétam.
Excipient(s) à effet notoire :
Briviact 10 mg, comprimé pelliculé
Chaque comprimé pelliculé de 10 mg contient 88 mg de lactose.
Briviact 25 mg, comprimé pelliculé
Chaque comprimé pelliculé de 25 mg contient 94 mg de lactose.
Briviact 50 mg, comprimé pelliculé
Chaque comprimé pelliculé de 50 mg contient 189 mg de lactose.
Briviact 75 mg, comprimé pelliculé
Chaque comprimé pelliculé de 75 mg contient 283 mg de lactose.
Briviact 100 mg, comprimé pelliculé
Chaque comprimé pelliculé de 100 mg contient 377 mg de lactose.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé (comprimé).
Briviact 10 mg, comprimé pelliculé
Comprimé pelliculé rond blanc à blanc cassé de 6,5 mm de diamètre portant la mention « u10 » gravée sur une face.
Briviact 25 mg, comprimé pelliculé
Comprimé pelliculé ovale gris mesurant 8,9 mm x 5,0 mm portant la mention « u25 » gravée sur une face.
Briviact 50 mg, comprimé pelliculé
Comprimé pelliculé ovale jaune mesurant 11,7 mm x 6,6 mm portant la mention « u50 » gravée sur une face.
Briviact 75 mg, comprimé pelliculé
Comprimé pelliculé ovale mauve mesurant 13,0 mm x 7,3 mm portant la mention « u75 » gravée sur une face.
Briviact 100 mg, comprimé pelliculé
Comprimé pelliculé ovale gris-vert mesurant 14,5 mm x 8,1 mm portant la mention « u100 » gravée sur une face.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Briviact est indiqué en association dans le traitement des crises partielles avec ou sans généralisation secondaire chez les adultes, les adolescents et les enfants à partir de 2 ans présentant une épilepsie.
4.2 Posologie et mode d’administration
Posologie
Le médecin doit prescrire la forme et le dosage les plus adaptés en fonction du poids et de la dose.
La posologie recommandée pour les adultes, adolescents et enfants à partir de 2 ans, est résumée dans le tableau suivant. La dose doit être administrée en deux prises égales, à environ 12 heures d’intervalle.
Dose initiale recommandée | Dose d’entretien recommandée | Intervalle thérapeutique * | |
Adolescents et enfants pesant 50 kg ou plus, et adultes | |||
50 mg/jour (ou 100 mg/jour)** | 100 mg/jour | 50 - 200 mg/jour | |
Adolescents et enfants pesant de 20 kg à moins de 50 kg | |||
1 mg/kg/jour (jusqu’à 2 mg/kg/jour)** | 2 mg/kg/jour | 1 – 4 mg/kg/jour | |
Enfants pesant de 10 kg à moins de 20 kg | |||
1 mg/kg/jour (jusqu’à 2,5 mg/kg/jour)** | 2,5 mg/kg/jour | 1 – 5 mg/kg/jour | |
* En fonction de la réponse individuelle du patient, la dose peut être ajustée dans les limites de cet intervalle thérapeutique efficace.
** En fonction de l’évaluation du médecin concernant la nécessité de contrôler les crises
Adultes
La dose initiale recommandée est soit de 50 mg par jour soit de 100 mg par jour, en fonction de l’avis du médecin selon la nécessité de réduire les crises versus les effets indésirables potentiels. En fonction de la réponse et de la tolérance du patient, la dose peut être ajustée au sein de l’intervalle thérapeutique efficace de 50 mg par jour à 200 mg par jour.
Adolescents et enfants pesant 50 kg ou plus
La dose initiale recommandée est de 50 mg/jour. Le brivaracétam peut également être instauré à 100 mg/jour en fonction de l’évaluation par le médecin de la nécessité de contrôler les crises. La dose d’entretien recommandée est de 100 mg/jour. En fonction de la réponse individuelle de chaque patient, la dose peut être ajustée au sein de l’intervalle thérapeutique efficace de 50 mg/jour à 200 mg/jour.
Adolescents et enfants pesant de 20 kg à moins de 50 kg
La dose initiale recommandée est de 1 mg/kg/jour. Le brivaracétam peut également être instauré à des doses pouvant s’élever jusqu’à 2 mg/kg/jour en fonction de l’évaluation par le médecin de la nécessité de contrôler les crises. La dose d’entretien recommandée est de 2 mg/kg/jour. En fonction de la réponse individuelle de chaque patient, la dose peut être ajustée au sein de l’intervalle thérapeutique efficace de 1 mg/kg/jour à 4 mg/kg/jour.
Enfants pesant de 10 kg à moins de 20 kg
La dose initiale recommandée est de 1 mg/kg/jour. Le brivaracétam peut également être instauré à des doses pouvant s’élever jusqu’à 2,5 mg/kg/jour en fonction de l’évaluation par le médecin de la nécessité de contrôler les crises. La dose d’entretien recommandée est de 2,5 mg/kg/jour. En fonction de la réponse individuelle de chaque patient, la dose peut être ajustée au sein de l’intervalle thérapeutique efficace de 1 mg/kg/jour à 5 mg/kg/jour.
Oubli de doses
En cas d’oubli d’une ou plusieurs doses, le patient doit prendre une seule dose dès que possible et prendre la dose suivante à l’heure habituelle le matin ou le soir. Cela peut empêcher la concentration plasmatique de brivaracétam de diminuer en dessous de la concentration efficace et prévenir la réapparition de crises convulsives.
Arrêt du traitement
Pour les patients âgés de 16 ans et plus, si le traitement par brivaracétam doit être arrêté, il est recommandé de diminuer progressivement la dose par paliers de 50 mg par jour chaque semaine.
Pour les patients de moins de 16 ans, si le traitement par brivaracétam doit être arrêté, il est recommandé de diminuer la dose de moitié au maximum chaque semaine, jusqu’à ce que la dose de 1 mg/kg/jour (pour les patients dont le poids corporel est inférieur à 50 kg) ou 50 mg/jour (pour les patients dont le poids corporel est de 50 kg ou plus) soit atteinte.
Après une semaine de traitement à la dose de 50 mg par jour, une dernière semaine de traitement à la dose de 20 mg par jour est recommandée.
Populations particulières
Sujets âgés (à partir de 65 ans)
Aucun ajustement de la posologie n’est nécessaire chez les patients âgés (voir rubrique 5.2).
L’expérience clinique chez les patients âgés de 65 ans et plus est limitée.
Atteinte rénale
Aucun ajustement de la posologie n'est nécessaire chez les patients présentant une atteinte rénale (voir rubrique 5.2). En raison du manque de données, le brivaracétam n’est pas recommandé chez les patients atteints d’insuffisance rénale terminale sous dialyse.
D’après les données disponibles chez les adultes, aucun ajustement posologique n’est nécessaire chez les patients pédiatriques présentant une atteinte rénale. Il n’existe aucune donnée clinique chez les patients pédiatriques présentant une insuffisance rénale.
Insuffisance hépatique
L’exposition au brivaracétam est augmentée chez les adultes présentant une maladie hépatique chronique. Chez les patients atteints d’insuffisance hépatique, les doses ajustées suivantes, administrées en 2 prises égales à environ 12 heures d’intervalle, sont recommandées quel que soit le stade de l’insuffisance hépatique (voir rubriques 4.4 et 5.2). Il n’existe aucune donnée clinique chez les patients pédiatriques présentant une insuffisance hépatique.
Âge et poids corporel | Dose initiale recommandée | Dose quotidienne maximale recommandée |
Adolescents et enfants pesant 50 kg ou plus, et adultes | 50 mg/jour | 150 mg/jour |
Adolescents et enfants pesant de 20 kg à moins de 50 kg | 1 mg/kg/jour | 3 mg/kg/jour |
Enfants pesant de 10 kg à moins de 20 kg | 1 mg/kg/jour | 4 mg/kg/jour |
Patients pédiatriques de moins de 2 ans
L’efficacité du brivaracétam chez les patients pédiatriques âgés de moins de 2 ans n’a pas encore été établie.
Les données actuellement disponibles sont décrites aux rubriques 4.8, 5.1 et 5.2, mais aucune recommandation sur la posologie ne peut être donnée.
Mode d'administration
Les comprimés pelliculés de brivaracétam doivent être avalés entiers avec une boisson, et peuvent être pris avec ou sans nourriture (voir rubrique 5.2). Les patients ne pouvant pas avaler de comprimés entiers ou les patients pour lesquels la dose ne peut être atteinte avec des comprimés entiers doivent utiliser Briviact 10 mg/mL en solution orale.
4.3 Contre-indications
Hypersensibilité à la substance active ou à un autre dérivé de la pyrrolidone ou à l'un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité
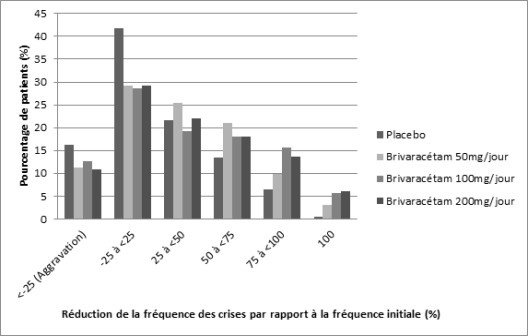
Les effets indésirables les plus fréquemment rapportés (> 10 %) avec brivaracétam ont été : somnolence (14,3 %) et sensations vertigineuses (11,0 %). Les effets indésirables ont été généralement d’intensité légère à modérée. Une incidence plus élevée des cas de somnolence et de fatigue a été rapportée avec l’augmentation de la dose.
Les taux d’arrêt de traitement en raison d’effets indésirables ont été respectivement de 3,5 %, 3,4 % et 4,0 % chez les patients randomisés aux doses de 50 mg/jour, 100 mg/jour et 200 mg/jour de brivaracétam et de 1,7 % chez les patients randomisés sous placebo. Les effets indésirables ayant entraîné le plus fréquemment l’arrêt du traitement par brivaracétam ont été des sensations vertigineuses (0,8 %) et des convulsions (0,8 %).
Liste tabulée des effets indésirables
Les effets indésirables identifiés dans la base de données de sécurité des 3 études cliniques contrôlées versus placebo, à dose fixe, chez des sujets ≥ 16 ans, et à partir de l'expérience acquise après la mise sur le marché, sont présentés dans le tableau ci-dessous par classe de systèmes d’organes et fréquence.
Les fréquences sont définies de la manière suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Classe de système d’organes | Fréquence | Effets indésirables rapportés |
Infections et infestations | Fréquent | Grippe |
Affections hématologiques et du système lymphatique | Peu fréquent | Neutropénie |
Affections du système immunitaire | Peu fréquent | Hypersensibilité de type I |
Troubles du métabolisme et de la nutrition | Fréquent | Diminution de l’appétit |
Affections psychiatriques | Fréquent | Dépression, anxiété, insomnie, irritabilité |
Peu fréquent | Idées suicidaires, trouble psychotique, agressivité, agitation | |
Affections du système nerveux | Très fréquent | Sensations vertigineuses, somnolence |
Fréquent | Convulsion, vertiges | |
Affections respiratoires, thoraciques et médiastinales | Fréquent | Infections des voies respiratoires supérieures, toux |
Affections gastro-intestinales | Fréquent | Nausées, vomissements, constipation |
Affections de la peau et du tissu sous-cutané | Fréquence indéterminée | Syndrome de Stevens-Johnson (1) |
Troubles généraux et anomalies au site d’administration | Fréquent | Fatigue |
(1) Effets indésirables rapportés dans le contexte de post-commercialisation.
Description d’effets indésirables sélectionnés
Une neutropénie a été rapportée chez 0,5 % (6/1 099) des patients traités par brivaracétam et 0 % (0/459) des patients sous placebo. Quatre de ces sujets présentaient une diminution du nombre de neutrophiles à l’inclusion, et ont présenté une diminution supplémentaire du nombre de neutrophiles après l’introduction de brivaracétam. Aucun des 6 cas de neutropénie n’était sévère, n’a requis de traitement spécifique ou n’a conduit à l’arrêt du brivaracétam et aucun n’a présenté d’infections associées.
Des cas d’idées suicidaires ont été rapportés chez 0,3 % (3/1 099) des patients traités par brivaracétam et 0,7 % (3/459) des patients sous placebo. Dans les études cliniques à court terme du brivaracétam menées chez des patients atteints d’épilepsie, il n’a pas été observé de cas de suicide ni de tentative de suicide. Ces événements ont toutefois été rapportés dans les études d’extension en ouvert (voir rubrique 4.4).
Des réactions évoquant une hypersensibilité immédiate (type I) ont été rapportées chez un faible nombre de patients traités par brivaracétam (9/3 022) au cours du développement clinique.
Population pédiatrique
Le profil de sécurité du brivaracétam observé chez les enfants à partir d’1 mois est comparable au profil de sécurité observé chez les adultes. Dans les études à long terme, en ouvert, non contrôlées, des idées suicidaires ont été rapportées chez 4,7 % des patients pédiatriques évalués à partir de l’âge de 6 ans (plus fréquent chez les adolescents) comparé à 2,4 % chez les adultes, et des troubles du comportement ont été rapportés chez 24,8 % des patients pédiatriques comparé à 15,1 % chez les adultes. La majorité des événements étaient d’intensité légère à modérée, non grave et n’ont pas entraîné l’arrêt du médicament étudié. Un effet indésirable additionnel a été observé chez les enfants : l’hyperactivité psychomotrice (4,7 %).
Aucun profil spécifique d’événements indésirables (EI) n’a été identifié chez les enfants à partir d’1 mois et jusqu’à < 4 ans, comparativement à des tranches d’âge pédiatrique plus élevées. Aucune information de sécurité considérée comme significative n’a été identifiée indiquant une incidence accrue d’un EI particulier dans cette tranche d’âge. Les données disponibles chez les enfants de moins de 2 ans étant limitées, le brivaracétam n’est pas indiqué pour cette tranche d’âge. Les données cliniques disponibles chez les nouveau-nés sont limitées.
Sujets âgés
Sur les 130 sujets âgés inclus dans le programme de développement de phases II/III du brivaracétam (44 patients atteints d’épilepsie), 100 étaient âgés de 65 à 74 ans et 30 étaient âgés de 75 à 84 ans. Le profil de sécurité chez les patients âgés semble être comparable à celui observé chez les patients adultes plus jeunes.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via:
Belgique:
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg:
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
UCB Pharma S.A.
Allée de la Recherche 60
B-1070 Bruxelles
Belgique
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/15/1073/001
EU/1/15/1073/002
EU/1/15/1073/003
EU/1/15/1073/004
EU/1/15/1073/005
EU/1/15/1073/006
EU/1/15/1073/007
EU/1/15/1073/008
EU/1/15/1073/009
EU/1/15/1073/010
EU/1/15/1073/011
EU/1/15/1073/012
EU/1/15/1073/013
EU/1/15/1073/014
EU/1/15/1073/015
EU/1/15/1073/016
EU/1/15/1073/017
EU/1/15/1073/018
EU/1/15/1073/019
EU/1/15/1073/020
EU/1/15/1073/023
EU/1/15/1073/024
EU/1/15/1073/025
EU/1/15/1073/026
EU/1/15/1073/027
10. DATE DE MISE À JOUR DU TEXTE
11/2024
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3534237 | BRIVIACT 10MG COMP PELL 14 X 10MG | N03AX23 | € 31,1 | - | Oui | - | - |
| 3534245 | BRIVIACT 25MG COMP PELL 56 X 25MG | N03AX23 | € 100,21 | - | Oui | - | - |
| 3534252 | BRIVIACT 50MG COMP PELL 56 X 50MG | N03AX23 | € 100,21 | - | Oui | - | - |
| 3534260 | BRIVIACT 75MG COMP PELL 56 X 75MG | N03AX23 | € 100,21 | - | Oui | - | - |
| 3534278 | BRIVIACT 100MG COMP PELL 56 X 100MG | N03AX23 | € 100,21 | - | Oui | - | - |