RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
RISPERDAL CONSTA 25 mg poudre et solvant pour suspension injectable à libération prolongée
RISPERDAL CONSTA 37,5 mg poudre et solvant pour suspension injectable à libération prolongée
RISPERDAL CONSTA 50 mg poudre et solvant pour suspension injectable à libération prolongée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon contient 25 mg de rispéridone.
Un flacon contient 37,5 mg de rispéridone.
Un flacon contient 50 mg de rispéridone.
1 ml de suspension reconstituée contient 12,5 mg de rispéridone.
1 ml de suspension reconstituée contient 18,75 mg de rispéridone.
1 ml de suspension reconstituée contient 25 mg de rispéridone
Excipients à effet notoire
1 ml de suspension reconstituée contient 3 mg de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour suspension injectable à libération prolongée.
Flacon de poudre
Poudre fluide blanche à blanc cassé.
Seringue pré-remplie de solvant pour reconstitution
Solution aqueuse, limpide, incolore.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
RISPERDAL CONSTA est indiqué dans le traitement d’entretien de la schizophrénie chez les patients actuellement stabilisés par des antipsychotiques oraux.
4.2 Posologie et mode d'administration
Posologie
Adultes
Dose initiale :
Pour la majorité des patients la dose recommandée est de 25 mg par voie intramusculaire toutes les deux semaines.
Chez les patients traités par une dose fixe de rispéridone orale depuis deux semaines ou plus, le schéma de conversion suivant doit être pris en compte. Les patients traités par une dose inférieure ou égale à 4 mg de rispéridone orale doivent recevoir RISPERDAL CONSTA 25 mg, chez les patients traités par des doses orales plus élevées la dose plus élevée de RISPERDAL CONSTA 37,5 mg doit être envisagée.
Lorsque les patients ne sont pas actuellement sous traitement par la rispéridone orale, la posologie du pré-traitement oral doit être prise en compte dans le choix de la dose initiale I.M. La dose initiale recommandée est de 25 mg de RISPERDAL CONSTA toutes les deux semaines. Pour les patients recevant des doses plus élevées de l’antipsychotique oral en cours, la dose plus élevée de RISPERDAL CONSTA 37,5 mg doit être envisagée.
Une couverture antipsychotique suffisante par la rispéridone orale ou le traitement antipsychotique antérieur doit être assurée du fait d’un délai de latence de 3 semaines après la première injection de RISPERDAL CONSTA (voir rubrique 5.2).
RISPERDAL CONSTA ne doit pas être utilisé dans les exacerbations aiguës de la schizophrénie sans assurer une couverture antipsychotique suffisante par la rispéridone orale ou l’antipsychotique antérieur pendant la période de latence de 3 semaines suivant la première injection de RISPERDAL CONSTA.
Dose d’entretien
Pour la majorité des patients la dose recommandée est de 25 mg par voie intramusculaire toutes les deux semaines. Certains patients peuvent bénéficier des doses plus élevées de 37,5 mg ou 50 mg. Un ajustement posologique à une dose supérieure ne doit pas être réalisé plus fréquemment que toutes les 4 semaines. L’effet de cette augmentation de dose ne doit pas être attendu avant un délai de 3 semaines après la première injection à la dose plus élevée. Aucun bénéfice supplémentaire n’a été observé à la dose de 75 mg dans les essais cliniques. Des doses supérieures à 50 mg toutes les deux semaines ne sont pas recommandées.
Sujets âgés
Aucun ajustement posologique n’est nécessaire. La dose recommandée est de 25 mg par voie intramusculaire toutes les deux semaines. Lorsque les patients ne sont pas actuellement traités par la rispéridone orale, la dose recommandée est de 25 mg de RISPERDAL CONSTA toutes les deux semaines. Pour les patients recevant une dose fixe de rispéridone orale depuis deux semaines ou plus, le schéma de conversion suivant doit être pris en compte. Les patients traités par une dose inférieure ou égale à 4 mg de rispéridone orale doivent recevoir RISPERDAL CONSTA 25 mg, pour les patients traités par des doses orales plus élevées, la dose plus élevée de RISPERDAL CONSTA 37,5 mg doit être envisagée.
Une couverture antipsychotique suffisante doit être assurée pendant la période de latence de 3 semaines après la première injection de RISPERDAL CONSTA (voir rubrique 5.2). Les données cliniques avec RISPERDAL CONSTA sont limitées chez les sujets âgés. RISPERDAL CONSTA sera utilisé avec prudence chez les sujets âgés.
Insuffisance hépatique et insuffisance rénale
RISPERDAL CONSTA n’a pas été étudié chez les patients présentant une insuffisance hépatique ou rénale.
En cas de nécessité de traitement par RISPERDAL CONSTA chez des patients insuffisants hépatiques ou rénaux, une dose initiale de 0,5 mg deux fois par jour de rispéridone orale est recommandée pendant la première semaine. La deuxième semaine 1 mg deux fois par jour ou 2 mg une fois par jour peuvent être administrés. Lorsqu’une dose orale journalière totale d’au moins 2 mg est bien tolérée, une injection de 25 mg de RISPERDAL CONSTA peut être administrée toutes les 2 semaines.
Une couverture antipsychotique suffisante doit être assurée pendant la période de latence de 3 semaines après la première injection de RISPERDAL CONSTA (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité de RISPERDAL CONSTA chez les enfants de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
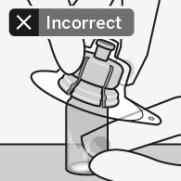
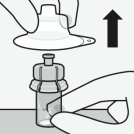
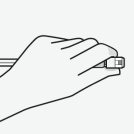
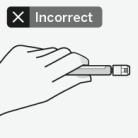
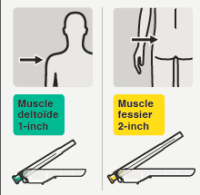
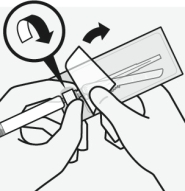
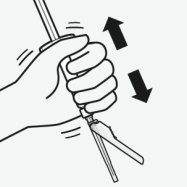
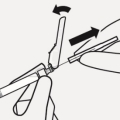
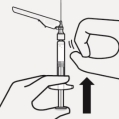
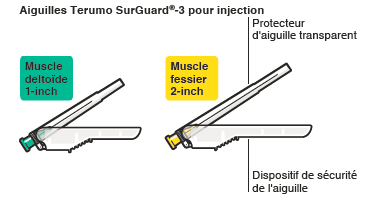
RISPERDAL CONSTA doit être administré toutes les 2 semaines par injection intramusculaire profonde dans le muscle deltoïde ou fessier à l’aide de l’aiguille sécurisée appropriée. Pour une administration dans le muscle deltoïde, utiliser l’aiguille de 1 inch (25 mm) en alternant les injections entre les deux bras. Pour une administration dans le muscle fessier, utiliser l’aiguille de 2 inch (51 mm) en alternant les injections entre les deux muscles fessiers. Ne pas administrer par voie intraveineuse (voir rubriques 4.4 et 6.6).
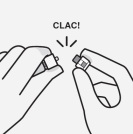
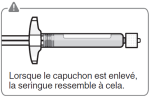
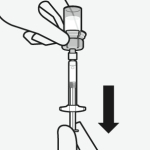
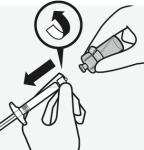
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Les effets indésirables (EIs) les plus fréquemment rapportés (fréquence 1/10) sont : Insomnie, anxiété, céphalées, infections des voies respiratoires hautes, parkinsonisme et dépression.
Parmi les effets indésirables, le parkinsonisme et l’akathisie sont apparus dose-dépendantes.
Des réactions graves au site d’injection telles que : nécrose au site d’injection, abcès, cellulite, ulcère cutané, hématome, kyste et nodule ont été rapportées après commercialisation. La fréquence est considérée comme inconnue (ne pouvant être estimée à partir des données disponibles). Des cas isolés ont nécessité une intervention chirurgicale.
Les effets indésirables suivants sont tous les effets indésirables rapportés au cours des essais cliniques et de de l’expérience après commercialisation avec la rispéridone par catégorie de fréquence estimée à partir des essais cliniques avec RISPERDAL CONSTA. Les termes et fréquences suivants sont utilisés : très fréquent ( 1/10), fréquent ( 1/100 à < 1/10), peu fréquent ( 1/1.000 à < 1/100), rare ( 1/10.000 à < 1/1.000), très rare (< 1/10.000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Classes de systèmes d’organes | Effet indésirable | |||||
Fréquence | ||||||
| Très fréquent | Fréquent | Peu fréquent | Rare | Très rare | Fréquence indéterminée |
Infections et infestations | infection des voies respiratoires supérieures | pneumonie, bronchite, sinusite, infections des voies urinaires, grippe | infection des voies respiratoires, cystite, infection auriculaire, infection oculaire, amygdalite, onychomycose, cellulite, infection, infection localisée, infection virale, acarodermatite, abcès sous-cutané |
|
|
|
Affections hématologiques et du système lymphatique |
| anémie | diminution de la numération de globules blancs, thrombocytopénie, diminution de l’hématocrite | agranulocytosec, neutropénie, augmentation de la numération des éosinophiles |
|
|
Affections du système immunitaire |
|
| hypersensibilité | réaction anaphylactiquec |
|
|
Affections endocriniennes |
| hyperprolactinémiea | présence de glucose dans les urines | sécrétion inappropriée d’hormone antidiurétique |
|
|
Troubles du métabolisme et de la nutrition |
| hyperglycémie, prise de poids, augmentation de l’appétit, perte de poids, diminution de l’appétit | diabèteb, anorexie, augmentation des triglycérides sanguins, augmentation du cholesterol sanguin | intoxication à l’eauc, hypoglycémie, hyperinsulinémiec, polydipsie | acidocétose diabétique |
|
Affections psychiatriques | insomnied, dépression, anxiété | trouble du sommeil, agitation, diminution de la libido | manie, état de confusion, anorgasmie, nervosité, cauchemar | catatonie, |
|
|
Affections du système nerveux | parkinsonismed, céphalée | sédation/ somnolence, akathisied, dystonied, sensation vertigineuse, dyskinésied, tremblement | dyskinésie tardive, ischémie au niveau cérébral, perte de conscience, convulsiond, syncope, hyperactivité psychomotrice, trouble de l’équilibre, coordination anormale, vertige orthostatique, perturbation de l’attention, dysarthrie, dysgueusie, hypoesthésie, paresthésie | syndrome malin des neuroleptiques, trouble cérébrovasculaire, non réponse aux stimuli, diminution du niveau de la conscience, coma diabétique, titubation céphalique |
|
|
Affections oculaires |
| vision trouble | conjonctivite, sécheresse oculaire, augmentation du larmoiement, hyperémie oculaire | occlusion de l’artère rétinienne, glaucome, trouble du mouvement oculaire, révulsion oculaire, photophobie, bord de la paupière croûteux, syndrome de l'iris hypotonique (peropératoire)c |
|
|
Affections de l’oreille et du labyrinthe |
|
| vertiges, acouphènes, douleur auriculaire |
|
|
|
Affections cardiaques |
| tachycardie | fibrillation auriculaire, bloc auriculo-ventriculaire , trouble de la conduction, allongement de l’intervalle QT, bradycardie, électrocardiogramme anormal, palpitations | arythmie sinusale |
|
|
Affections vasculaires |
| hypotension, hypertension | hypotension orthostatique | embolie pulmonaire, thrombose veineuse, bouffées de chaleur |
|
|
Affections respiratoires, thoraciques et médiastinales |
| dyspnée, douleur pharyngolaryngée, toux, congestion nasale | hyperventilation, congestion des voies respiratoires, sifflements, épistaxis | syndrome d’apnée du sommeil, pneumonie d’aspiration, congestion pulmonaire, râles, dysphonie, trouble respiratoire |
|
|
Affections gastro-intestinales |
| douleur abdominale, gêne abdominale, vomissement, nausée, constipation, gastro-entérite, diarrhée, dyspepsie, sécheresse buccale, douleur dentaire | incontinence fécale, dysphagie, flatulence | pancréatite, obstruction intestinale, gonflement de la langue, fécalome, chéilite | iléus |
|
Affections de la peau et du tissu sous-cutané |
| rash | prurit, alopécie, eczéma, sécheresse cutanée, érythème, décoloration de la peau, acné, dermatite séborrhéique | toxidermie, urticaire, hyperkératose, pellicules, affection cutanée, lésion cutanée | angioedème | Syndrome de Stevens-Johnson/nécrolyse épidermique toxiquec |
Affections musculo-squelettiques et systémiques |
| spasmes musculaires, douleur musculo-squelettique, douleur dorsale, arthralgie | augmentation de la créatine phosphokinase sanguine, raideur articulaire, enflure des articulations, faiblesse musculaire, douleur cervicale | rhabdomyolyse, posture anormale |
|
|
Affections du rein et des voies urinaires |
| incontinence urinaire | pollakiurie, rétention urinaire, dysurie |
|
|
|
Affections gravidiques, puerpérales et périnatales |
|
|
| syndrome de sevrage médicamenteux néonatalc |
|
|
Affections des organes de reproduction et du sein |
| dysfonctionnement érectile, aménorrhée, galactorrhée | trouble de l’éjaculation, menstruation retardée, trouble menstrueld, gynécomastie, dysfonctionnement sexuel, douleur mammaire, gêne mammaire, écoulement vaginal | priapismec, engorgement mammaire, accroissement mammaire, écoulement mammaire |
|
|
Troubles généraux et anomalies au site d’administration |
| œdèmed, pyrexie, douleur thoracique, asthénie, fatigue, douleur, réaction au site d’injection | œdème de la face, frissons, augmentation de la température corporelle, démarche anormale, soif, gêne thoracique, malaise, sensation anormal, indurationc | hypothermie, diminution de la température corporelle, froideur des extrémités, syndrome de sevrage médicamenteux, gêne |
|
|
Affections hépatobiliaires |
| augmentation de transaminases, augmentation des gamma-glutamyltransférases | augmentation des enzymes hépatiques | jaunisse |
|
|
Lésions, intoxications et complications liées aux procédures |
| chute | douleur liée aux procédures |
|
|
|
a L’hyperprolactinémie peut dans certains cas induire une gynécomastie, des troubles menstruels, une aménorrhée, une anovulation, une galactorrhée, un trouble de la fertilité, une diminution de la libido et un dysfonctionnement érectile. |
Effets indésirables observés avec les formulations à base de palipéridone
La palipéridone est le métabolite actif de la rispéridone, par conséquent, les profils des effets indésirables de ces composés (incluant les deux formulations orale et injectable) s’appliquent l’un à l’autre. En plus des effets indésirables ci-dessus, l’effet indésirable suivant a été observé lors de l’utilisation de produits à base de palipéridone et peut être attendu avec RISPERDAL CONSTA.
Affections cardiaques
Syndrome de la tachycardie orthostatique posturale
Réaction anaphylactique
Rarement, des cas de réaction anaphylactique après l'injection de RISPERDAL CONSTA ont été rapportés depuis le début de la commercialisation chez les patients ayant précédemment toléré la rispéridone orale (voir rubrique 4.4).
Effets de classe
Comme pour d’autres antipsychotiques, de très rares cas d’allongement du QT ont été rapportés après commercialisation avec la rispéridone. Les autres effets cardiaques de classe rapportés avec les antipsychotiques qui prolongent l’intervalle QT incluent arythmie ventriculaire, fibrillation ventriculaire, tachycardie ventriculaire, mort subite, arrêt cardiaque et Torsades de Pointes.
Thromboembolie veineuse
Des cas de thromboembolies veineuses, y compris des cas d’embolies pulmonaires ainsi que de thromboses veineuses profondes, ont été rapportés avec les antipsychotiques (fréquence inconnue).
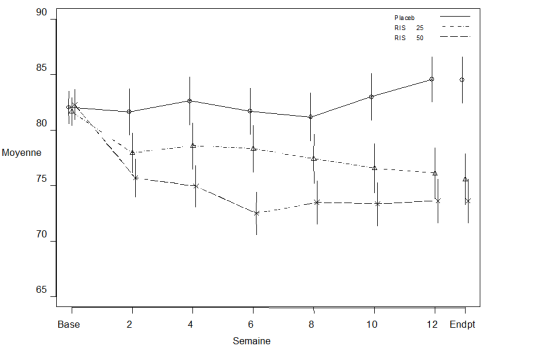
Prise de poids
Dans une étude de 12 semaines, en double aveugle, contrôlée versus placebo, 9 % des patients traités par RISPERDAL CONSTA, comparé à 6 % de patients traités par le placebo, ont présenté une prise de poids 7 % en fin d’étude. Dans une étude d’un an en ouvert avec RISPERDAL CONSTA, les modifications de poids chez des patients individuels ont été généralement de 7 % par rapport à l’état initial, 25 % ont présenté une prise de poids 7 %.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Janssen-Cilag NV
Antwerpseweg 15-17
B-2340 Beerse
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
RISPERDAL CONSTA 25 mg : BE254597; LU: 2004010026 - 0360425
RISPERDAL CONSTA 37,5 mg : BE254606; LU: 2004010027 - 0360439
RISPERDAL CONSTA 50 mg : BE254615; LU: 2004010028 - 0360442
10. DATE DE MISE A JOUR/DE L’APPROBATION DU TEXTE
07/2024
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2093797 | RISPERDAL CONSTA 50,0 MG FL IM 1X50,0MG/2ML+SOLV | N05AX08 | € 88,89 | - | Oui | € 12,5 | € 8,3 |
| 2093805 | RISPERDAL CONSTA 37,5 MG FL IM 1X37,5MG/2ML+SOLV | N05AX08 | € 76,68 | - | Oui | € 12,5 | € 8,3 |
| 2093813 | RISPERDAL CONSTA 25,0 MG FL IM 1X25,0MG/2ML+SOLV | N05AX08 | € 58,81 | - | Oui | € 12,5 | € 8,3 |
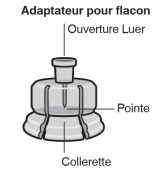
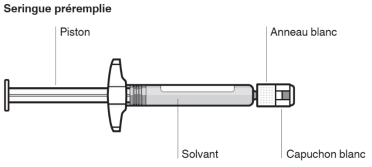
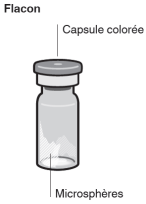
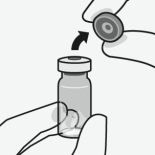
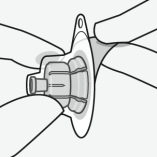
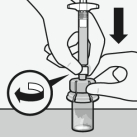
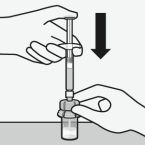
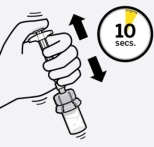
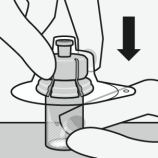 Assembler l’adaptateur au flacon
Assembler l’adaptateur au flacon