1. DENOMINATION DU MEDICAMENT
Spiriva 18 microgrammes poudre pour inhalation en gélule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque gélule contient 22,5 microgrammes de bromure de tiotropium monohydraté équivalant à 18 microgrammes de tiotropium.
La dose délivrée (c'est-à-dire la quantité de produit sortant de l'embout buccal du dispositif HandiHaler) est de 10 microgrammes de tiotropium.
Excipient à effet notoire :
Chaque capsule contient 5,5 milligrammes de lactose (sous forme monohydratée). Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour inhalation en gélule.
Gélules vert clair contenant la poudre pour inhalation, avec impression du code du produit TI 01 et du logo de la firme à l'extérieur des gélules.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Spiriva est un bronchodilatateur indiqué comme traitement d'entretien pour soulager les symptômes des patients souffrant de bronchopneumopathie chronique obstructive (BPCO).
4.2 Posologie et mode d’administration
Posologie
Ce médicament est destiné uniquement à la voie inhalée.
La posologie recommandée de bromure de tiotropium est l'inhalation du contenu d'une gélule une fois par jour, à la même heure, à l'aide du dispositif HandiHaler.
La dose recommandée ne doit pas être dépassée.
Les gélules de Spiriva sont uniquement destinées à l’inhalation et non à la prise orale.
Les gélules de Spirivane doivent pas être avalées.
Spirivadoit uniquement être inhalé à l'aide du dispositif HandiHaler.
Populations particulières
Le bromure de tiotropium peut être utilisé chez les sujets âgés à la dose recommandée.
Chez les patients atteints d'insuffisance rénale, le bromure de tiotropium peut être utilisé à la dose recommandée. En cas d'insuffisance rénale modérée à sévère (clairance de la créatinine < 50 ml/ min) voir rubriques 4.4. et 5.2.
Le bromure de tiotropium peut être utilisé à la dose recommandée chez les patients atteints d'insuffisance hépatique (voir rubrique 5.2).
Population pédiatrique:
BPCO
L’utilisation dans la population pédiatrique (moins de 18 ans) n’est pas justifiée dans l’indication mentionnée dans la rubrique 4.1.
Mucoviscidose
La sécurité et l’efficacité de Spiriva 18 microgrammes chez les enfants et les adolescents n’ont pas été évaluées. Aucune donnée n’est disponible.
Mode d’administration
Le dispositif HandiHaler est un dispositif d'inhalation spécialement conçu pour permettre aux patients d'inhaler le médicament contenu dans les gélules de Spiriva.
Le dispositif HandiHaler ne doit pas être utilisé pour prendre un autre médicament. Ce dispositif est destiné à un seul patient pour un usage multiple. Pour une administration correcte du médicament, le médecin ou un autre professionnel de santé devra éduquer le patient au bon usage du dispositif.
Instructions pour la manipulation et l’utilisation:
Les patients doivent suivre les étapes ci-dessous pour utiliser le dispositif HandiHaler.
| Suivez toujours scrupuleusement les instructions de votre médecin pour utiliser Spiriva. Après la première utilisation vous pouvez utiliser ce dispositif pendant un an pour prendre Spiriva. |
| Le dispositif HandiHaler |
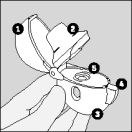
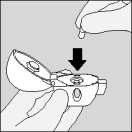
| 1. Pour libérer le capuchon protecteur, enfoncez le bouton vert complètement, puis relâchez-le. |
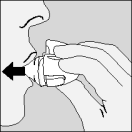
| 2. Relevez complètement le capuchon protecteur en le tirant vers le haut, ensuite ouvrez l'embout buccal en le tirant vers le haut. |
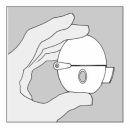
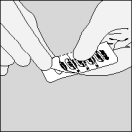
| 3. Prenez une gélule de Spiriva de la plaquette (uniquement juste avant l'utilisation, voir l’instruction « Manipulation de la plaquette») et placez-la dans la chambre centrale (), conformément à l'illustration. La façon dont la gélule est placée dans la chambre centrale importe peu. |
| 4. Refermez l'embout buccal, jusqu'à ce que vous entendiez un clic, et laissez le capuchon protecteur ouvert. |
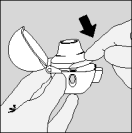
| 5. Tenez le dispositif HandiHaler verticalement, l'embout buccal dirigé vers le haut et enfoncez complètement le bouton vert d'une seule pression, puis relâchez. Ceci perfore la gélule et libère le médicament que vous inhalerez lorsque vous inspirerez. |
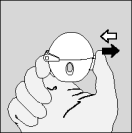
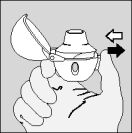
| 6. Expirez à fond. |
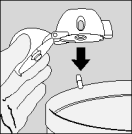
| 7. Portez le HandiHaler à votre bouche et refermez fermement les lèvres autour de l'embout buccal. Maintenez la tête droite et inspirez lentement et profondément, à un rythme toutefois suffisant pour que vous entendiez ou sentiez la gélule vibrer. Inspirez jusqu'à remplir complètement vos poumons, puis retenez votre respiration aussi longtemps que vous le pouvez et ôtez le dispositif HandiHaler de votre bouche. Reprenez une respiration normale et répétez une fois les étapes 6 et 7, ce qui videra totalement la gélule de son contenu. |
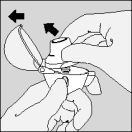
| 8. Ouvrez à nouveau l'embout buccal. Faites tomber la gélule et jetez-la. Refermez l'embout buccal et le capuchon protecteur pour conserver votre dispositif HandiHaler. |
Nettoyage du HandiHaler
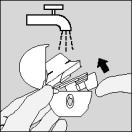
| Nettoyez votre HandiHaler une fois par mois. Ouvrez le capuchon protecteur et l'embout buccal, puis ouvrez la base en soulevant le bouton perforateur. Rincez complètement l'inhalateur à l'eau chaude pour enlever toute poudre restante. Séchez soigneusement le HandiHaler en absorbant l'excès d'eau sur une serviette en papier puis laissez sécher à l'air, en laissant l'embout buccal, le capuchon protecteur et la base ouverts. |
Manipulation de la plaquette
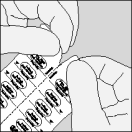
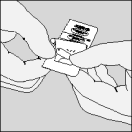
| A. Séparez le blister prédécoupé de Spiriva en détachant selon la perforation. |
| B. Relevez la feuille d'aluminium (uniquement juste avant l'utilisation) jusqu'à ce qu'une seule gélule devienne complètement visible. |
| C. Sortez la gélule. |
Les gélules de Spiriva ne contiennent qu’une petite quantité de poudre et sont donc seulement partiellement remplies.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ou à l'atropine ou ses dérivés, tels qu’ipratropium ou oxitropium.
4.8 Effets indésirables
Résumé du profil de sécurité
Un grand nombre des événements indésirables mentionnés peuvent être attribués à l'action anticholinergique de Spiriva.
Tableau résumé des effets indésirables
Les fréquences attribuées aux effets indésirables dont la liste figure ci-dessous sont basées sur les taux d'incidence bruts des réactions médicamenteuses indésirables (c'est-à-dire des événements attribués au tiotropium) observées dans le groupe du tiotropium (9.647 patients) et survenues au cours de 28 études cliniques groupées, contrôlées versus placebo, pendant des périodes de traitement comprises entre quatre semaines et 4 ans.
La fréquence est définie selon la convention en matière de fréquence comme suit : Très fréquent ( 1/10) ; fréquent ( 1/100 à < 1/10) ; peu fréquent ( 1/1.000 à < 1/100) ; rare ( 1/10.000 à < 1/1.000) ; très rare (< 1/10.000) ; non déterminée (ne peut être estimée sur la base des données cliniques disponibles).
Système classe organe / Terme MedDRA recommandé | Fréquence |
Troubles du métabolisme et de la nutrition |
|
Déshydratation | Non déterminée |
Affections du système nerveux |
|
Etourdissements | Peu fréquents |
Céphalées | Peu fréquentes |
Troubles du goût | Peu fréquents |
Insomnie | Rare |
Affections oculaires |
|
Vision trouble | Peu fréquente |
Glaucome | Rare |
Augmentation de la pression intraoculaire | Rare |
Affections cardiaques |
|
Fibrillation auriculaire | Peu fréquente |
Tachycardie supraventriculaire | Rare |
Tachycardie | Rare |
Palpitations | Rare |
Affections respiratoires, thoraciques et médiastinales |
|
Pharyngite | Peu fréquente |
Dysphonie | Peu fréquente |
Toux | Peu fréquente |
Bronchospasme | Rare |
Epistaxis | Rare |
Laryngite | Rare |
Sinusite | Rare |
Affections gastro-intestinales |
|
Sécheresse buccale | Fréquente |
Reflux gastro-oesophagien | Peu fréquent |
Constipation | Peu fréquente |
Candidose oropharyngée | Peu fréquente |
Obstruction intestinale, y compris iléus paralytique | Rare |
Gingivite | Rare |
Glossite | Rare |
Dysphagie | Rare |
Stomatite | Rare |
Nausée | Rare |
Caries dentaires | Non déterminée |
Affections de la peau et du tissu sous-cutané, affections du système immunitaire |
|
Eruption cutanée | Peu fréquente |
Urticaire | Rare |
Prurit | Rare |
Hypersensibilité (y compris réactions d'hypersensibilité immédiate) | Rare |
Oedème de Quincke | Rare |
Infection de la peau, ulcère de la peau | Non déterminée |
Sécheresse de la peau | Non déterminée |
Affections musculo-squelettiques et systémiques |
|
Gonflement articulaire | Non déterminée |
Affections du rein et des voies urinaires |
|
Dysurie | Peu fréquente |
Rétention urinaire | Peu fréquente |
Infection du tractus urinaire | Rare |
Description d’effets indésirables sélectionnés
Dans les essais cliniques contrôlés, les effets indésirables fréquemment observés ont été des effets indésirables de type anticholinergique comme la sécheresse buccale qui est survenue chez approximativement 4% des patients. Dans 28 essais cliniques, la sécheresse buccale a été à l'origine de 18 arrêts de traitement parmi les 9.647 patients traités par le tiotropium (soit 0,2 % des patients traités).
Les effets indésirables graves généralement attribués aux effets anticholinergiques comprennent le glaucome, la constipation et l'obstruction intestinale, y compris l’iléus paralytique, ainsi que la rétention urinaire.
Autres populations particulières
L'incidence des effets anticholinergiques peut augmenter avec l'âge.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration:
Belgique
Agence Fédérale des Médicaments et des Produits de Santé - Division Vigilance
Avenue Galilée 5/03 - 1210 Bruxelles
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Boehringer Ingelheim International GmbH
Binger Straße 173
55216 Ingelheim am Rhein
Allemagne
8. NUMERO D’AUTORISATION DE MISE SUR LE MARCHE
BE236047
10. DATE DE MISE A JOUR DU TEXTE
03/2023
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1713023 | SPIRIVA CAPS. 30 X 18 MCG + HANDIHALER | R03BB04 | € 35,98 | - | Oui | - | - |