1. DÉNOMINATION DU MÉDICAMENT
Miflonide Breezhaler 200 microgrammes poudre pour inhalation en gélule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque gélule à 200 microgrammes contient 230 microgrammes de budésonide et libère 200 microgrammes de budésonide à partir de l’embout buccal de l’appareil lorsqu’il est administré à l’aide de l’inhalateur appelé « Miflonide Breezhaler ».
Excipient à effet notoire :
Les gélules à 200 microgrammes contiennent 24,77 mg de lactose monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour inhalation en gélule.
La gélule à 200 microgrammes a une coiffe opaque rose pâle et un corps transparent incolore et porte le logo « BUDE 200 ».
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Miflonide Breezhaler est indiqué chez les patients asthmatiques âgés de 6 ans et plus pour le contrôle anti-inflammatoire à long terme de l’asthme persistant, incluant la prophylaxie des exacerbations aiguës de l’asthme.
4.2 Posologie et mode d’administration
Posologie
Adapter soigneusement la posologie de manière individuelle, afin de déterminer la dose efficace minimale pour contrôler les symptômes de l'asthme. La posologie la plus faible contenue dans une seule gélule est de 200 microgrammes. S’il est nécessaire d’administrer une dose inférieure à 200 microgrammes, ce produit ne peut pas être utilisé.
Miflonide est contre-indiqué chez les enfants de moins de 6 ans (voir rubrique 4.3).
Adultes :
Chez les adultes atteints d’asthme léger, le traitement peut être instauré avec la dose efficace minimale de 200 microgrammes une fois par jour.
La dose quotidienne habituelle recommandée est de 200 à 1600 microgrammes, fractionnée en 2 prises. Déterminer la dose d’entretien pour obtenir la dose efficace la plus faible nécessaire au maintien du contrôle de l’asthme.
Populations particulières
Patients pédiatriques (6 ans et plus) :
Vu l’absence d’expérience clinique chez les enfants âgés de moins de 6 ans, Miflonide Breezhaler ne doit pas être utilisé dans ce groupe d’âge.
Chez les enfants âgés de 6 ans et plus atteints d’asthme léger, le traitement peut être instauré avec une dose de 200 microgrammes une fois par jour. La dose quotidienne habituelle recommandée est de 200 à 400 microgrammes, fractionnée en 2 prises. Dans les cas d’asthme sévère, il peut s’avérer nécessaire d’administrer des doses allant jusqu’à 800 microgrammes par jour, à diviser en plusieurs prises.
Déterminer la dose d’entretien pour obtenir la dose efficace la plus faible nécessaire au maintien du contrôle de l’asthme.
Patients maintenus sous glucocorticoïdes oraux
Miflonide Breezhaler peut permettre de remplacer ou de réduire significativement la dose des glucocorticoïdes oraux tout en maintenant le contrôle de l’asthme. Au cours du passage d’une corticothérapie orale à un traitement par Miflonide Breezhaler, l’état du patient doit être relativement stable. Administrer une dose élevée de budésonide en association à la corticothérapie orale précédemment utilisée, pendant environ 10 jours. Diminuer ensuite progressivement la dose du corticostéroïde oral (par exemple, de 2,5 mg de prednisolone ou l’équivalent, chaque mois) jusqu’au niveau le plus faible possible. Dans de nombreux cas, il est possible de remplacer complètement le corticostéroïde oral par Miflonide Breezhaler. Pour obtenir des informations complémentaires sur l’arrêt des corticostéroïdes, voir rubrique 4.4.
Patients atteints d’insuffisance rénale
Aucune donnée ne suggère qu’il soit nécessaire d’ajuster la posologie chez les patients atteints d’insuffisance rénale. Sur la base des données pharmacocinétiques observées avec le budésonide par voie orale, il est peu probable que l’exposition systémique du médicament se modifie de manière cliniquement significative chez ces patients (voir rubrique 5.2).
Patients atteints d’insuffisance hépatique
Aucune donnée ne suggère qu’il soit nécessaire d’ajuster la posologie chez les patients atteints d’insuffisance hépatique. Néanmoins, étant donné que le budésonide s’élimine principalement par métabolisme hépatique, la prudence est de rigueur en cas d'utilisation de Miflonide Breezhaler chez des patients atteints d’insuffisance hépatique sévère. Sur la base des données pharmacocinétiques observées avec le budésonide par voie orale, il est peu probable que l’exposition systémique du médicament se modifie de manière cliniquement significative chez les patients ayant une insuffisance hépatique légère à modérée (voir rubrique 5.2).
Patients âgés (plus de 65 ans)
Aucune donnée ne suggère que les patients âgés de plus de 65 ans nécessitent une posologie différente de celle utilisée chez les patients plus jeunes.
Administration
Au cours du passage d’un inhalateur à un autre, la dose doit être de nouveau adaptée de manière individuelle. Afin de prévenir un enrouement, une irritation de la gorge et une candidose de la bouche et de la gorge et afin de réduire éventuellement le risque d’effets systémiques, il est recommandé de bien rincer la bouche à l'eau puis de recracher l'eau de rinçage après chaque administration. Il convient d’indiquer aux patients que les gélules sont destinées exclusivement à une utilisation par inhalation et qu’elles ne doivent pas être ingérées (voir rubrique 4.4). Le contenu des gélules est inhalé à l’aide d'un inhalateur appelé « Miflonide Breezhaler ».
Afin de s’assurer que le médicament atteint les zones cibles dans les poumons, apprendre aux patients à utiliser correctement l’inhalateur Miflonide Breezhaler, conformément aux instructions d'utilisation.
Pour les instructions concernant la reconstitution du médicament avant administration, voir rubrique 6.6.
4.3 Contre-indications
Ne pas utiliser chez les enfants de moins de 6 ans.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
Tuberculose pulmonaire active.
4.8 Effets indésirables
Les effets indésirables sont classés en fonction de leur fréquence. Les fréquences sont définies de la manière suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1000, < 1/100), rare (≥ 1/10000, < 1/1000), très rare (< 1/10000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Le tableau 1 ci-dessous présente les effets indésirables rapportés chez des patients traités par budésonide, par classe de systèmes d'organes selon la terminologie standard MedDRA.
Infections et infestations | |
Fréquent | Candidose oropharyngée |
Affections du système immunitaire | |
Rare | Réactions d’hypersensibilité immédiate et retardée, incluant : éruption cutanée, dermatite de contact, urticaire, angioœdème, prurit et réaction anaphylactique |
Affections endocriniennes | |
Rare | Signes et symptômes d’effets systémiques des corticostéroïdes, incluant : inhibition surrénalienne, réduction de la vitesse de croissance *, hypocorticisme, hypercorticisme, syndrome de Cushing |
Affections psychiatriques | |
Rare | Agitation, nervosité, modifications du comportement (principalement chez les enfants) |
Peu fréquent | Anxiété, dépression** |
Fréquence indéterminée | Troubles du sommeil, hyperactivité psychomotrice, agressivité |
Affections oculaires | |
Peu fréquent | Cataracte***, vision floue**** |
Rare | Glaucome |
Affections respiratoires, thoraciques et médiastinales | |
Fréquent | Dysphonie, toux, enrouement, irritation de la gorge |
Rare | Bronchospasme, incluant un bronchospasme paradoxal |
Affections de la peau et du tissu sous-cutané | |
Rare | Ecchymoses |
Affections musculo-squelettiques et systémiques | |
Peu fréquent | Spasmes musculaires, tremblements |
Rare | Diminution de la densité minérale osseuse |
* voir « Population pédiatrique » ci-dessous
** Les données d’essais cliniques portant sur 13119 patients sous budésonide par inhalation et 7278 patients sous placebo ont été regroupées. La fréquence de l’anxiété était de 0,52 % dans le groupe sous budésonide par inhalation et de 0,63 % dans le groupe sous placebo ; celle de la dépression était de 0,67 % dans le groupe sous budésonide par inhalation et de 1,15 % dans le groupe sous placebo.
*** Dans des études contrôlées contre placebo, on a également pu observer une cataracte peu fréquente dans le groupe sous placebo.
**** voir rubrique 4.4
Il existe un risque accru de pneumonie chez les patients présentant un diagnostic récent de BPCO et débutant le traitement par des corticostéroïdes inhalés. Cependant, une évaluation pondérée de la mise en commun de 8 études cliniques incluant 4643 patients atteints de BPCO traités par budésonide et 3643 patients randomisés pour ne recevoir aucun traitement par CSI, n’a démontré aucun risque accru de pneumonie. Les résultats issus des 7 premières de ces 8 études ont été publiés sous la forme d’une méta-analyse.
Des signes ou symptômes d’effets secondaires systémiques liés aux glucocorticoïdes peuvent survenir avec les glucocorticoïdes par inhalation, probablement en fonction de la dose, de la durée d’exposition, de la prise concomitante et antérieure de corticoïdes et de la sensibilité des individus.
Population pédiatrique
En raison du risque de retard de croissance au sein de la population pédiatrique, surveiller la croissance de la manière décrite à la rubrique 4.4.
L’enrouement et l’irritation de la gorge sont réversibles et disparaissent après l’arrêt du traitement, en cas de réduction de la dose et/ou de mise au repos de la voix.
En cas de candidose oropharyngée, il est conseillé aux patients de se rincer la bouche à l’eau ou de se brosser les dents après chaque administration. Dans la plupart des cas, cette affection répondra à un traitement antifongique local sans nécessiter l'interruption du traitement par budésonide.
Comme c’est le cas avec d’autres thérapies par inhalation, un bronchospasme paradoxal peut survenir. En cas de bronchospasme, il est indispensable d’interrompre immédiatement le traitement par budésonide et si nécessaire, instaurer un autre traitement et instaurer immédiatement un traitement par un bronchodilatateur inhalé à courte durée d’action.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Agence fédérale des médicaments et des produits de santé
Division Vigilance
Boîte Postale 97
B-1000 Bruxelles Madou
Site internet : www.notifieruneffetindesirable.be
e-mail : adr@afmps.be
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Novartis Pharma SA, Medialaan 40, B- 1800 Vilvoorde
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
BE218531
10. DATE DE MISE A JOUR DU TEXTE
04/2018
Approbation : 05/2021
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1625912 | MIFLONIDE CAPS. INHAL. 30 X 200 MCG | R03BA02 | € 7,49 | - | Oui | - | - |
| 1625938 | MIFLONIDE BREEZHALER CAPS INHAL. 120 X 200MCG | R03BA02 | € 12,72 | - | Oui | € 2,42 | € 1,45 |
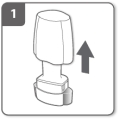 Retirez le capuchon
Retirez le capuchon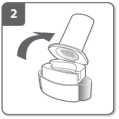 Ouvrez l’inhalateur
Ouvrez l’inhalateur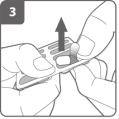 Préparez la gélule
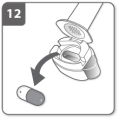
Préparez la gélule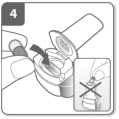 Insérez la gélule
Insérez la gélule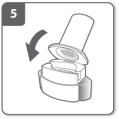
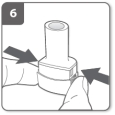
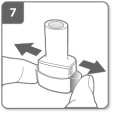 Relâchez complètement les boutons latéraux
Relâchez complètement les boutons latéraux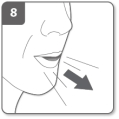 Expirez
Expirez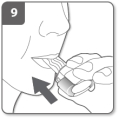 Inhalez le médicament
Inhalez le médicament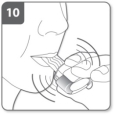 Remarque :
Remarque : Retenez votre respiration
Retenez votre respiration