RéSUMé DES CARACTéRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
VISTABEL, 4 unités Allergan/0,1ml, poudre pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Toxine botulinique de type A1……………4 unités Allergan par 0,1 ml de solution reconstituée.
1 de Clostridium botulinum
Les unités Allergan ne sont pas interchangeables avec d’autres préparations de toxine botulinique.
Flacon de 50 Unités.
Flacon de 100 Unités.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour solution injectable.
Poudre blanche.
VISTABEL apparaît comme un fine dépôt blanc qui peut être difficile à voir à la base du flacon.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
VISTABEL est indiqué pour l’amélioration temporaire de l’apparence:
- des rides verticales intersourcilières modérées à sévères, observées lors du froncement maximal (rides glabellaires) et/ou ;
- des rides canthales latérales (pattes d’oie) modérées à sévères observées au maximum du sourire et/ou ;
- des rides du front modérées à sévères observées lors de l’élévation maximale des sourcils,
lorsque la sévérité des rides du visage entraîne un retentissement psychologique important chez les patients adultes.
4.2 Posologie et mode d’administration
Posologie
Consultez les recommandations spécifiques pour chaque indication décrite ci-dessous.
Les unités de toxine botulique ne sont pas interchangeables d’un produit à l’autre. Les doses recommandées en unités Allergan sont différentes d’autres préparations de toxine botulique.
Patients âgés
Les données cliniques de phase 3 avec VISTABEL sont limitées chez les patients âgés de plus de 65 ans (voir rubrique 5.1).
Aucun ajustement posologique spécifique n'est requise pour l'utilisation chez les personnes âgées.
Patients pédiatriques
Chez les sujets de moins de 18 ans, l’innocuité et l’efficacité de VISTABEL dans le traitement des rides glabellaires, observées lors du froncement maximal, des pattes d’oie observées au maximum du sourire ou des rides du front observées lors de l’élévation maximale des sourcils n’ont pas été démontrées. L’utilisation de VISTABEL n’est pas recommandée chez les personnes de moins de 18 ans (voir rubrique 4.4).
Mode d’administration
Le traitement par VISTABEL doit être administré par des médecins ayant les qualifications adéquates, ayant une bonne expérience du traitement et disposant de matériel approprié.
VISTABEL, après reconstitution, ne doit être utilisé que pour une seule séance d’injection(s) par patient. L'excès du produit non utilisé doit être éliminé comme décrit dans la rubrique 6.6. Des précautions particulières doivent être prises pour la préparation et l'administration du produit ainsi que pour l'inactivation et l'élimination de la solution restante non utilisée (voir rubriques 4.4 et 6.6).
Le volume d’injection recommandé par site musculaire est de 0,1 ml. Voir également la table de dilutions rubrique 6.6.
Pour les instructions pour l’utilisation, la manipulation et l’élimination des flacons, voir rubrique 6.6.
Il y a lieu de veiller à ne pas injecter VISTABEL dans un vaisseau sanguin lorsque le produit est injecté dans les rides verticales inter-sourcilières observées lors du froncement maximal (appelées aussi rides glabellaires), dans les lignes canthales latérales observées au maximum du sourire (appelées aussi pattes d’oie) ou dans des rides du front observées lors de l’élévation maximale des sourcils (voir rubrique 4.4).
L’intervalle entre deux traitements ne doit pas être inférieur à trois mois.
Instructions d’administration pour les rides glabellaires observées lors du froncement maximal :
VISTABEL, après reconstitution (50 Unités/1,25 ml ou 100 Unités/2,5 ml), est injecté à l’aide d’une aiguille stérile de 30 gauges. On injecte 0,1 ml (4 Unités) dans chacun des 5 sites d’injection (voir Illustration 1) : 2 injections dans chaque muscle corrugator et 1 injection dans le muscle procerus, soit une dose totale de 20 Unités.
Avant injection, le pouce ou l’index doit être placé fermement sous le rebord orbitaire afin d’éviter l’extravasation sous le rebord orbitaire. L’aiguille devra être orientée vers le haut et vers la ligne médiane lors de l’injection. Afin de réduire les risques de ptose de la paupière, la dose maximum de 4 Unités par site d’injection ainsi que le nombre de sites d’injection ne doivent pas être dépassés. En plus, les injections à proximité du muscle releveur de la paupière supérieure doivent être évitées, en particulier chez les patients dotés d'importants complexes abaisseurs des sourcils (depressor supercilii). Les injections dans le muscle corrugator doivent être faites dans la partie centrale de ce muscle, au moins à 1 centimètre au-dessus de l’arcade sourcilière.
Illustration 1 :
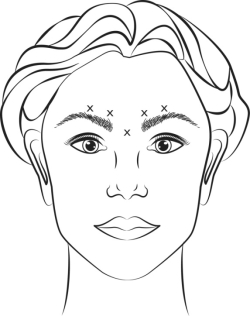
Une amélioration de la sévérité des rides glabellaires observées lors du froncement maximal s’observe, en général, en une semaine après le traitement. L’effet du traitement a été démontré jusqu'à 4 mois après injection.
Méthode et voie d’administration pour les pattes d’oie observées au maximum du sourire :
Le VISTABEL reconstitué (50 Unités/1,25 ml ou 100 Unités/2,5 ml) est injecté à l’aide d’une aiguille de 30 gauges. 0,1 ml (4 Unités) est injecté dans le muscle orbiculaire dans chacun des 3 sites de chaque côté (pour un total de 6 sites d’injection), représentant une dose totale de 24 Unités dans un volume total de 0,6 ml (12 Unités par côté).
Afin de réduire les risques de ptose de la paupière, la dose maximum de 4 Unités par site d’injection ainsi que le nombre de sites d’injection ne doivent pas être dépassés. De plus, les injections devront être faites de façon temporale par rapport à l’orbite, en s’assurant de respecter une distance de sécurité par rapport au muscle contrôlant l’élévation de la paupière.
Les injections doivent se faire en orientant la pointe biseautée de l’aiguille vers le haut et en l’éloignant de l’œil. La première injection (A) doit se faire à environ 1,5 à 2,0 cm à l’extrémité du canthus latéral et juste à l’extrémité du rebord orbitaire. Si les rides de la région des pattes d’oie sont au-dessus et sous le canthus latéral, injectez comme le montre l’illustration 2. Autrement, si les rides de la région des pattes d’oie sont principalement sous le canthus latéral, injectez comme le montre l’illustration 3.
Illustration 2 : Illustration 3 :
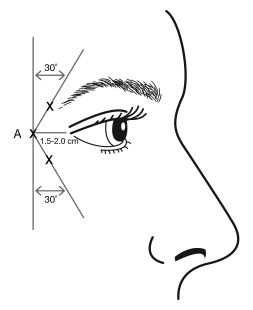
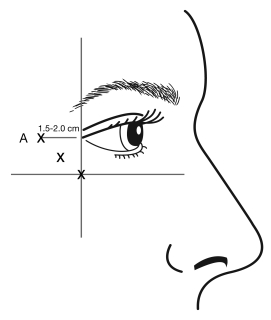
Pour le traitement simultané des rides glabellaires observées lors du froncement maximal, la dose est de 24 Unités pour les pattes d’oie observées au maximum du sourire et de 20 Unités pour les rides glabellaires (voir Méthode et voie d’administration pour les rides glabellaires et l’illustration 1), pour une dose totale de 44 Unités dans un volume total de 1,1 ml.
L’investigateur a estimé que la sévérité des pattes d’oie observées au maximum du sourire s’est améliorée en une semaine de traitement. Les effets ont été démontrés pendant une période médiane de 4 mois après l’injection.
Instructions d’administration pour les rides du front observées lors de l’élévation maximale des sourcils
VISTABEL, après reconstitution (50 Unités/1,25 ml ou 100 Unités/2,5 ml) est injecté à l’aide d’une aiguille stérile de 30 gauges. On injecte 0,1 ml (4 Unités) dans chacun des 5 sites d’injection dans le muscle frontal, soit une dose totale de 20 Unités dans un volume total de 0,5 ml (voir figure 4).
La dose totale pour le traitement simultané des rides du front (20 Unités) et des rides glabellaires (20 Unités) est de 40 Unités/1,0 ml.
Pour déterminer l’emplacement des sites d'injection appropriés dans le muscle frontal, le rapport entre la taille du front du patient et la répartition de l’activité du muscle frontal doit être évalué.
Les lignes horizontales de traitement, listées ci-dessous, doivent être localisées en palpant légèrement le front au repos et lors de l’élévation maximale des sourcils :
- Bord supérieur de l’activité du muscle frontal : environ 1 cm au-dessus du pli supérieur du front
- Ligne inférieure de traitement : à mi-distance entre le bord supérieur de l’activité du muscle frontal et le sourcil, au moins 2 cm au-dessus du sourcil
- Ligne supérieure de traitement : à mi-distance entre le bord supérieur de l’activité du muscle frontal et la ligne inférieure de traitement
Les 5 injections doivent être pratiquées à l’intersection des lignes de traitement horizontales et des repères verticaux suivants :
- Sur la ligne inférieure de traitement, au niveau de la ligne médiane du visage et à 0,5 - 1,5 cm du milieu de la ligne de fusion temporale (crête temporale) repérée par palpation; recommencez pour l’autre côté.
- Sur la ligne supérieure de traitement, à mi-distance entre les sites latéral et médian de la ligne inférieure de traitement ; recommencez pour l’autre côté.
Figure 4 : ![]()
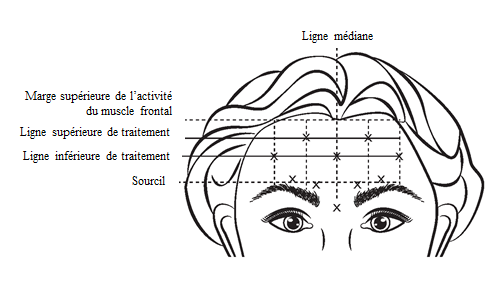
L’amélioration de la sévérité des rides du front observées lors de l’élévation maximale des sourcils est survenue en une semaine après le traitement. L’effet a été démontré pendant environ 4 mois après l’injection.
Pour un traitement simultané des rides glabellaires et des rides de la patte d’oie, la dose totale est de 64 Unités, réparties en 20 Unités pour les rides du front, 20 Unités pour les rides glabellaires (voir Instructions d’administration pour les rides glabellaires, et figure 1), et 24 Unités pour les rides de la patte d’oie (voir Instructions d’administration pour les rides de la patte d’oie, et figures 2 et 3).
Informations générales
En cas d’échec au traitement après une première séance, c’est-à-dire en l’absence, un mois après injection, d’amélioration significative par rapport au bilan initial, il y a lieu :
- d’analyser les causes de l’échec, qui peuvent être diverses : erreur dans les muscles injectés, technique d’injection, formation d’anticorps neutralisant la toxine, dose insuffisante ;
- de réévaluer la pertinence du traitement par la toxine botulinique de type A.
En l’absence d’effets indésirables suite à la première séance de traitement, commencez une deuxième séance de traitement en espaçant les deux séances de traitement d’au moins trois mois.
Pour les rides glabellaires observées lors du froncement maximal, en cas de dose insuffisante, commencez une deuxième séance de traitement en ajustant la dose totale jusqu’à 40 ou 50 Unités, en tenant compte de l’analyse de l’échec précédent.
L’efficacité et la sécurité d’injections répétées de VISTABEL au-delà de 12 mois n’ont pas été évaluées.
4.3 Contre-indications
VISTABEL est contre-indiqué :
- Chez les individus présentant une hypersensibilité connue à la toxine botulinique de type A ou à l’un des excipients du produit,
- En cas de myasthénie grave ou de syndrome de Eaton-Lambert,
- En cas d’infection aux sites d’injection proposés.
4.8 Effets indésirables
a) Général
D’après les essais cliniques contrôlés pour les rides glabellaires observées lors du froncement maximal, des effets indésirables considérés comme étant reliés à VISTABEL par l’investigateur ont été rapportés chez 23,5 % (placebo : 19,2%) des patients. Lors du cycle 1 du traitement dans les essais cliniques clés pour pattes d’oie observées au maximum du sourire, 7,6 % des patients (24 Unités uniquement pour les pattes d’oie) et 6,2 % des patients (administration de 44 Unités : 24 Unités pour les pattes d’oie en même temps que 20 Unités pour les rides glabellaires) ont présenté de tels effets indésirables par rapport à 4,5 % des patients traités avec placebo.
Lors du premier cycle de traitement des essais cliniques conduits sur les rides du front observées lors de l’élévation maximale des sourcils, des effets indésirables considérés comme étant reliés à VISTABEL par l’investigateur ont été rapportés chez 20,6 % des patients traités par 40 Unités (20 Unités dans le muscle frontal et 20 Unités dans le complexe glabellaire), et 14,3 % des patients traités par 64 Unités (20 Unités dans le muscle frontal, 20 Unités dans le complexe glabellaire et 24 Unités dans la zone des rides canthales latérales), par comparaison avec 8,9 % des patients du groupe placebo.
Les effets secondaires peuvent être associés au traitement, à la technique d’injection ou aux deux. En général, les effets indésirables s’observent dans les premiers jours qui suivent l’injection et sont transitoires. La plupart des effets secondaires rapportés étaient de gravité légère à modérée.
L’action pharmacologique attendue de la toxine botulinique est une faiblesse musculaire locale. Cependant, la faiblesse des muscles adjacents et / ou des muscles à distance du site d'injection a été rapportée.
L'apparition d'un ptosis qui peut être due à la technique d'injection correspondrait à l'action pharmacologique de VISTABEL. Comme pour toute injection, on peut observer une douleur/brûlure/piqûre, un œdème et/ou un hématome lié à l'injection. On a également signalé de la fièvre et un syndrome grippal après des injections de toxine botulique.
b) Effets indésirables - fréquence
Les effets indésirables classés par classe-organe et fréquence sont définies ainsi : Très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1000, < 1/100) ; rare (≥ 1/10000, < 1/1000) ; très rare (< 1/10000).
Rides glabellaires :
Les effets indésirables suivants ont été rapportés dans des études cliniques en double aveugle, contrôlées versus placebo, après injection de VISTABEL 20 Unités dans le traitement des rides glabellaires uniquement :
Système Organe Classe | Terme préféré | Frequence |
Infections et infestations | Infections | Peu fréquent |
Affections psychiatriques | Anxiété | Peu fréquent |
Affections du système nerveux | Céphalées, paresthésies | Fréquent |
Vertiges | Peu fréquent | |
Affections oculaires | Ptosis de la paupière | Fréquent |
Blépharite, douleur oculaire, trouble visuel (y compris vision trouble) | Peu fréquent | |
Affections gastro-intestinales | Nausées | Fréquent |
Sécheresse buccale | Peu fréquent | |
Affections de la peau et du tissu sous-cutané | Erythème, sensation de tension cutanée | Fréquent |
Œdème (visage, paupière, périorbital), réaction de photosensibilité, prurit, sécheresse cutanée | Peu fréquent | |
Affections musculo-squelettiques et systémiques | Faiblesse musculaire localisée | Fréquent |
Contractions musculaires | Peu fréquent | |
Effet Méphisto (élévation latérale des sourcils) | Peu fréquent | |
Troubles généraux et anomalies au site d’administration | Douleur faciale, œdème au site d’injection, ecchymose, douleur au site d’injection, irritation au site d’injection | Fréquent |
Syndrome grippal, asthénie, fièvre | Peu fréquent |
Pattes d’oie avec ou sans rides glabellaires :
Les effets indésirables suivants ont été rapportés dans des études cliniques en double aveugle, contrôlées versus placebo, après injection de VISTABEL dans le traitement des rides de la patte d’oie, avec ou sans traitement des rides glabellaires :
Système Organe Classe | Terme préféré | Frequence |
Affections oculaires | Œdème de la paupière | Peu fréquent |
Troubles généraux et anomalies au site d’administration | Hématome au site d’injection* | Fréquent |
Hémorragie au site d’injection* | Peu fréquent | |
Douleur au site d’injection* | Peu fréquent | |
Paresthésie au site d’injection | Peu fréquent |
*effets indésirables associés à la procédure
Rides du front et rides glabellaires avec ou sans ride de la patte d’oie
Les effets indésirables suivants ont été rapportés dans des études cliniques en double aveugle, contrôlées versus placebo, après injection de VISTABEL dans le traitement simultané des rides du front et des rides glabellaires, avec ou sans traitement des rides de la patte d’oie :
Système Organe Classe | Terme préféré | Fréquence |
Affections du système nerveux | Céphalées | Fréquent |
Affections oculaires | Ptôse de la paupière1 | Fréquent |
Affections de la peau et du tissu sous-cutané | Constriction de la peau | Fréquent |
Ptôse du sourcil2 | Fréquent | |
Affections musculo-squelettiques et systémiques | Effet Méphisto (élévation latérale des sourcils) | Fréquent |
Troubles généraux et anomalies au site d’administration | Contusion au site d’injection* | Fréquent |
Hématome au site d'injection* | Fréquent | |
Douleur au site d'injection* | Peu fréquent |
1 Le délai médian d’apparition de la ptôse de la paupière était de 9 jours après le traitement.
2 Le délai médian d’apparition de la ptôse du sourcil était de 5 jours après le traitement.
* effets indésirables liés à la procédure
Aucun changement n’a été observé dans le profil d’innocuité général suite à des doses répétées.
c) Données consécutives à la mise sur le marché (fréquence indéterminée)
Les effets indésirables ou effets indésirables cliniquement pertinentes suivants ont été rapportés depuis la mise sur le marché du produit pour le traitement de rides glabellaires et des pattes d’oie, et d'autres indications thérapeutiques :
Système Organe Classe | Terme préféré |
Affections du système immunitaire | Réaction anaphylactique, angio-œdème, maladie sérique, urticaire |
Troubles du métabolisme et de la nutrition | Anorexie |
Affections du système nerveux | Atteinte du plexus brachial, dysphonie, dysarthrie, parésie faciale, hypoesthésie, faiblesse musculaire, myasthénie grave, neuropathie périphérique, paresthésies, radiculopathie, syncope, paralysie faciale |
Affections oculaires | Glaucome à angle fermé (lors du traitement du blépharospasme), ptôse de la paupière, lagophtalmie, strabisme, vision trouble, trouble visuel, yeux secs, œdème palpébral |
Affections de l’oreille et du labyrinthe | Hypoacousie, acouphènes, vertiges |
Affections respiratoires, thoraciques et médiastinales | Pneumopathie d’inhalation, dyspnée, bronchospasme, dépression, insuffisance respiratoire |
Affections gastro-intestinales | Douleurs abdominales, diarrhée, sécheresse buccale, dysphagie, nausées, vomissements |
Affections de la peau et du tissu sous-cutané | Alopécie, ptôse du sourcil, dermatite psoriasiforme, érythème polymorphe, hyperhidrose, madarose, prurit, rash |
Affections musculo-squelettiques et systémiques | Atrophie musculaire, myalgie, contractions musculaires localisées / contractions musculaires involontaires |
Troubles généraux et anomalies au site d’administration | Dénervation, atrophie, malaise, fièvre |
Des effets indésirables, pouvant être liés à la diffusion de la toxine à distance du site d’administration, ont été très rarement rapportés après traitement par la toxine botulinique (p. ex. faiblesse musculaire, dysphagie, constipation ou pneumopathie d’inhalation pouvant être fatale) (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration (voir coordonnées ci-dessous) :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance :
Site internet : www.notifieruneffetindesirable.be
e-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
AbbVie S.A.
Av. Einstein 14
1300 Wavre
Belgique
8. NUMERO D’AUTORISATION DE MISE SUR LE MARCHE
Flacon de 50 Unités :
BE : BE281477
LU : 2008100021
- 0436084 (1x1 flacon 50U)
Flacon de 100 Unités :
BE : BE545333
LU : 2008100021
- 0883184 (1x1 flacon 100U)
10. DATE DE MISE A JOUR DU TEXTE
07/2025
Approbation : 07/2025
SPC FR-Vistabel-04 1/18
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2321677 | VISTABEL ALLERGAN 50 EENHEDEN/UNITES | M03AX01 | € 133,08 | - | Oui | - | - |
| 4566188 | VISTABEL ALLERGAN 100UI PDR SOL INJ FL 1 | € 174,73 | - | Oui | - | - |