RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
Rhinospray Eucalyptus Nez bouché 1,18 mg/ml solution pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 ml de Rhinospray Eucalyptus Nez bouché 1,18 mg/ml solution pour pulvérisation nasale contient 1,18 mg chlorhydrate de tramazoline (= 1,25 mg chlorhydrate de tramazoline monohydraté).
Excipient à effet notoire:
Chlorure de benzalkonium: 0,02 mg par nébulisation, équivalent à 0,02 mg/ml solution (voir rubrique 4.4)
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution pour pulvérisation nasale.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Traitement symptomatique de la congestion nasale, par exemple en cas de rhinite et rhino-pharyngite.
Rhinospray Eucalyptus Nez bouché est indiqué chez les adultes et les adolescents à partir de 16 ans.
En premier lieu, il est recommandé de rincer le nez avec une solution saline. Lorsque la congestion nasale persiste après rinçage du nez, Rhinospray Eucalyptus Nez bouché peut être utilisé en traitement de deuxième ligne.
4.2 Posologie et mode d’administration
Posologie
Adulte et adolescent à partir de 16 ans: après s'être mouché, pratiquer 1 nébulisation dans chaque narine, 3 à 4 fois par jour, suivant les besoins. La dose maximale est de 200 mcg (= 2 nébulisations) jusqu'à 4 fois par 24 heures.
Rhinospray Eucalyptus Nez bouché peut être utilisé pendant maximum 5 jours consécutifs.
Mode d’administration
Lors de la première utilisation, après avoir enlevé le capuchon, le pouce sur le fond du flacon, l'index et le majeur sur l'anneau entourant l'embout, POMPER QUELQUES FOIS. Lorsqu’un léger brouillard est projeté, le microdoseur est amorcé (Fig.1). Une fois le microdoseur amorcé, garder la tête en position normale et introduire l'embout dans la narine (Fig.2), vaporiser en inspirant doucement par le nez. Répéter l’opération dans l’autre narine. Nettoyer l'embout et remettre le capuchon.
Schémas
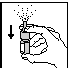
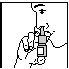
Fig. 1 Fig.2
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Rhinospray Eucalyptus Nez bouché est contre-indiqué en cas de rhinite sèche ou de glaucome à angle fermé, et après chirurgie crânienne par le nez.
Ne pas utiliser chez les enfants de moins de 7 ans.
4.8 Effets indésirables
a) Résumé du profil de sécurité :
Les effets indésirables les plus fréquemment rapportés sont les gênes nasales, la sécheresse nasale et l’œdème nasal. Des réactions d’hypersensibilité, incluant œdèmes cutanés et des muqueuses (angio-œdèmes), éruptions cutanées, prurit et urticaire sont rapportées moins fréquemment. Les effets indésirables du système cardiovasculaire (palpitations, tachycardie, arythmie, augmentation de la pression artérielle) et les effets indésirables du système nerveux central (par exemple, les hallucinations, l’insomnie, la nervosité, les céphalées, les vertiges et la sédation) se produisent de façon sporadique.
b) Tableau des réactions indésirables
Les fréquences des effets indésirables ci-dessous sont basées sur des cas de réactions indésirables signalés au cours de 4 essais cliniques impliquant 5089 patients.
Les effets indésirables associés au Rhinospray Eucalyptus Nez bouché obtenus à partir d’études cliniques et de surveillance post-marketing sont reprises ci-dessous. Les effets indésirables ont été classés selon la convention suivante :
Très fréquent (> 1/10); fréquent (> 1/100 à < 1/10); peu fréquent (> 1/1.000 à < 1/100);
rare (> 1/10.000 à < 1/1.000); très rare (< 1/10.000); fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Classe de systèmes d’organes (MEDRA) | Effets indésirables |
Affections du système immunitaire |
|
fréquence indéterminée | hypersensibilité |
|
|
Affections psychiatriques |
|
peu fréquent | nervosité |
fréquence indéterminée | hallucination, insomnie |
|
|
Affections du système nerveux |
|
peu fréquent | céphalées |
rare | vertiges, dysgueusie |
fréquence indéterminée | sédation , somnolence |
|
|
Affections cardiaques |
|
peu fréquent | palpitations |
fréquence indéterminée | arythmie, tachycardie |
|
|
Affections respiratoires, thoraciques et médiastinales |
|
fréquent | gêne nasale |
peu fréquent | oedème nasal, sécheresse nasale, rhinorrhée, éternuements |
rare | epistaxis |
|
|
Affections gastro-intestinales |
|
peu fréquent | nausées |
|
|
|
|
Affections de la peau et des tissus sous-cutanés |
|
fréquence indéterminée | oedème cutané*, oedème de la muqueuse*, rash, prurit |
|
|
Troubles généraux et anomalies au site d’administration |
|
fréquence indéterminée | fatigue |
|
|
Investigations |
|
fréquence indéterminée | Augmentation de la pression artérielle |
* symptôme de l’hypersensibilité
c) Description d’effets indésirables sélectionnés
Des cas d’angio-œdème (oedèmes cutanés/oedèmes de la muqueuse) ont été rapportés chez des patients traités par Rhinospray Eucalyptus Nez bouché.
Les patients qui sont enclins à avoir de l’hypertension artérielle sont plus susceptibles de développer
une augmentation de la pression artérielle après utilisation de Rhinospray Eucalyptus Nez bouché.
Chez les patients atteints d’hypertrophie de la prostate, les signes/symptômes de cette hypertrophie peuvent être intensifiés.
d) Population pédiatrique
Rhinospray Eucalyptus Nez bouché est contre-indiqué chez les enfants de moins de 7 ans. Le profil de sécurité chez les enfants de 7 ans ou plus est comparable au profil de sécurité général de Rhinospray Eucalyptus Nez bouché.
e) Autres populations particulières
Après administration comme indiqué dans le mode d’administration (par voie nasale), il a été démontré que 50 à 80% de la dose est absorbée. Le chlorhydrate de tramazoline et ses métabolites sont principalement éliminés par voie rénale.
Aucun essai clinique n’a été effectué sur les personnes âgées ou sur les patients présentant une insuffisance rénale ou hépatique.
En ce qui concerne les expériences post-commercialisation, il n’existe aucune preuve que des patients d’autres populations particulières pourraient rencontrer d’autres/plus d’effets secondaires que ceux spécifiés dans les informations actuellement disponibles.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via:
Belgique : Agence Fédérale des Médicaments et des Produits de Santé – Division Vigilance – Boîte Postale 97 – 1000 Bruxelles Madou – Site internet: www.notifieruneffetindesirable.be – E-mail : adr@afmps.be
Luxembourg : Centre Régional de Pharmacovigilance de Nancy –crpv@chru-nancy.fr – Tél. : (+33) 383 656085/87 OU Division de la Pharmacie et des Médicaments – Direction de la santé, Luxembourg – pharmacovigilance@ms.etat.lu – Tél. : (+352) 24785592 – Lien pour le formulaire : https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Sanofi Belgium
Leonardo Da Vincilaan 19
1831 Diegem
Tél.: 02/710.54.00
E-mail: info.belgium@sanofi.com
8. NUMERO D’AUTORISATION DE MISE SUR LE MARCHE
BE195404 / LU : 2004098382 - 0311421
10. DATE DE MISE A JOUR DU TEXTE
Date de l’approbation: 02/2025
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 4522843 | RHINOSPRAY+EUCAL.NEZ BOUCHE 1,18MG/ML SPR NAS.10ML | € 8,33 | - | Non | - | - |