1. DÉNOMINATION DU MÉDICAMENT
SIMBRINZA 10 mg/ml + 2 mg/ml, collyre en suspension
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 ml de suspension contient 10 mg de brinzolamide et 2 mg de tartrate de brimonidine équivalent à 1,3 mg de brimonidine.
Excipient(s) à effet notoire
Chaque ml de suspension contient 0,03 mg de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Collyre en suspension (collyre).
Suspension uniforme blanche à blanchâtre, pH 6,5 (environ).
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
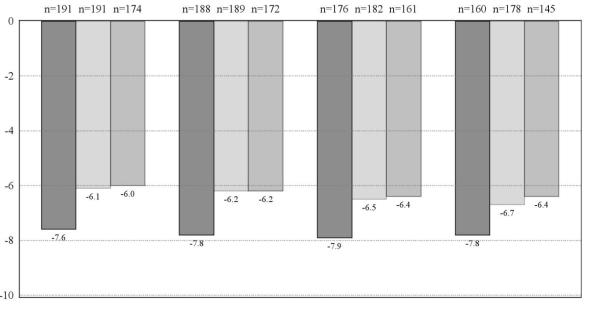
Réduction de la pression intraoculaire (PIO) élevée chez les patients adultes atteints de glaucome à angle ouvert ou d’hypertonie intraoculaire, pour lesquels la réduction de PIO sous monothérapie est insuffisante (voir rubrique 5.1).
4.2 Posologie et mode d’administration
Posologie
Utilisation chez les adultes et les sujets âgés
La dose recommandée est d'une goutte de SIMBRINZA dans l'œil ou les yeux atteint(s) deux fois par jour.
Instillation oubliée
Si une instillation est oubliée, le traitement doit être poursuivi avec l'instillation suivante, comme prévu.
Insuffisance hépatique et/ou rénale
SIMBRINZA n'a pas été étudié chez les patients ayant une insuffisance hépatique ; il doit donc être utilisé avec précaution dans cette population (voir rubrique 4.4).
SIMBRINZA n’a pas été étudié chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine < 30 ml/min) ni chez les patients présentant une acidose hyperchlorémique. Étant donné que le brinzolamide contenu dans SIMBRINZA et son métabolite sont excrétés majoritairement par le rein, SIMBRINZA est contre-indiqué chez les insuffisants rénaux sévères (voir rubrique 4.3).
Population pédiatrique
La sécurité et l’efficacité de SIMBRINZA chez les enfants et les adolescents âgés de 2 à 17 ans n’ont pas été établies. Aucune donnée n’est disponible.
SIMBRINZA est contre-indiqué dans la réduction de la pression intraoculaire (PIO) élevée chez les nouveau-nés et les nourrissons de moins de 2 ans atteints de glaucome à angle ouvert ou d’hypertonie intraoculaire, pour lesquels la réduction de PIO sous monothérapie est insuffisante en raison de problèmes de tolérance (voir rubrique 4.3).
Mode d’administration
Voie ophtalmique.
Les patients doivent être informés de la nécessité de bien agiter le flacon avant utilisation.
Le passage systémique est réduit par une occlusion nasolacrymale et la fermeture des paupières pendant 2 minutes. Cette méthode peut contribuer à diminuer les effets indésirables systémiques et à augmenter l'efficacité locale (voir rubrique 4.4).
Pour éviter la contamination de l’embout compte-gouttes et de la solution, il faut faire attention de ne pas toucher les paupières, les surfaces voisines ou d’autres surfaces avec l’embout compte-gouttes du flacon. Les patients doivent être informés de la nécessité de conserver le flacon bien fermé quand il n’est pas utilisé.
SIMBRINZA peut être utilisé avec d'autres médicaments topiques ophtalmiques pour réduire la pression intraoculaire. En cas d’utilisation de plusieurs médicaments topiques ophtalmiques, les administrations de médicaments doivent être espacées d’au moins 5 minutes.
4.3 Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
Hypersensibilité aux sulfonamides (voir rubrique 4.4).
Patients traités par inhibiteur de la monoamine oxydase (IMAO) (voir rubrique 4.5).
Patients sous antidépresseurs affectant la transmission noradrénergique (par ex., antidépresseurs tricycliques et miansérine) (voir rubrique 4.5).
Patients ayant une insuffisance rénale sévère (voir rubrique 4.4)
Patients ayant une acidose hyperchlorémique
Nouveau-nés et nourrissons de moins de 2 ans (voir rubrique 4.4)
4.8 Effets indésirables
Résumé du profil de tolérance
Lors des essais cliniques dans lesquels SIMBRINZA a été administré deux fois par jour, les effets indésirables les plus fréquents ont été une hyperémie oculaire, des réactions oculaires de type allergique survenant chez environ 6 à 7 % des patients, et une dysgueusie (goût amer ou inhabituel dans la bouche après instillation) chez environ 3 % des patients.
Résumé tabulé des effets indésirables
Les effets indésirables suivants ont été rapportés au cours des essais cliniques avec SIMBRINZA administré deux fois par jour et au cours des essais cliniques et de la surveillance post-commercialisation de ses composants, brinzolamide et brimonidine, pris individuellement. Ils ont été classés de la façon suivante : très fréquents (≥1/10), fréquents (≥1/100 à <1/10), peu fréquents (≥1/1 000 à <1/100), rares (≥1/10 000 à <1/1 000), très rares (<1/10 000) ou fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Dans chaque groupe de fréquence, les effets indésirables sont présentés dans l’ordre décroissant de gravité.
Classe de systèmes d’organes | Effets indésirables |
Infections et infestations | Peu fréquent : rhinopharyngite2, pharyngite2, sinusite2 |
Affections hématologiques et du système lymphatique | Peu fréquent : diminution du nombre de globules rouges2, augmentation du taux de chlorure dans le sang2 |
Affections du système immunitaire | Peu fréquent : hypersensibilité3 |
Affections psychiatriques | Peu fréquent : apathie2, dépression2,3, humeur dépressive2, insomnie1, diminution de la libido2, cauchemars2, nervosité2 |
Affections du système nerveux | Fréquent : somnolence1, vertiges3, dysgueusie1 |
Affections oculaires | Fréquent : allergie oculaire1, kératite1, douleur oculaire1, gêne oculaire1, vision floue1, vision anormale3, hyperhémie oculaire1, blanchiment de la conjonctive3 |
Affections de l’oreille et du labyrinthe | Peu fréquent : vertiges1, acouphène2 |
Troubles cardiaques | Peu fréquent : détresse cardio-respiratoire2, angine de poitrine2, arythmie3, palpitations2,3, fréquence cardiaque irrégulière2, bradycardie2,3, tachycardie3 |
Affections vasculaires | Peu fréquent : hypotension1 |
Affections respiratoires, thoraciques et médiastinales | Peu fréquent : dyspnée2, hyperactivité bronchique2, douleur pharyngolaryngée2, gorge sèche1, toux2, épistaxis2, congestion des voies respiratoires supérieures2, congestion nasale1, rhinorrhée2, irritation de la gorge2, sécheresse nasale1, rhinorrhée postérieure1, éternuements2 |
Troubles gastro-intestinaux | Fréquent : bouche sèche1 |
Affections hépatobiliaires | Fréquence indéterminée : bilan hépatique anormal2 |
Affections de la peau et du tissu sous-cutané | Peu fréquent : dermatite de contact1, urticaire2, rash2, rash maculo-papuleux2, prurit généralisé2, alopécie2, tiraillements cutanés2 |
Affections musculosquelettiques et systémiques | Peu fréquent : mal de dos2, spasmes musculaires2, myalgie2 |
Affections du rein et des voies urinaires | Peu fréquent : douleurs rénales2 |
Affections des organes de reproduction et troubles mammaires | Peu fréquent : dysfonction érectile2 |
Troubles généraux et anomalies au site d'administration | Peu fréquent : douleur2, gêne thoracique2, sensation de mal être2, sensation de nervosité2, irritabilité2, résidu de médicament1 |
1 réaction indésirable observée avec SIMBRINZA | |
Description de certains effets indésirables
La dysgueusie a été l'effet indésirable systémique le plus fréquemment associé à l'utilisation de SIMBRINZA (3,4 %). Il est probablement dû au passage du collyre dans le nasopharynx par le canal nasolacrymal et il est principalement imputable au brinzolamide contenu dans SIMBRINZA. L’occlusion nasolacrymale ou la légère fermeture des paupières après l’instillation peut contribuer à réduire la fréquence de cet effet (voir rubrique 4.2).
SIMBRINZA contient du brinzolamide, qui est un sulfonamide inhibiteur de l'anhydrase carbonique absorbé par voie systémique. Les effets gastrointestinaux, affectant le système nerveux, hématologiques, rénaux et métaboliques sont généralement associés aux inhibiteurs de l’anhydrase carbonique systémiques. Les mêmes types d’effets indésirables attribuables aux inhibiteurs de l’anhydrase carbonique par voie orale peuvent être observés avec la voie locale.
Les effets indésirables fréquemment associés à la brimonidine présente dans SIMBRINZA sont : développement de réactions oculaires de type allergique, fatigue et/ou somnolence et bouche sèche. L'utilisation de la brimonidine a été associée à des diminutions minimes de la pression artérielle. Certains patients recevant SIMBRINZA ont présenté des baisses de la pression artérielle similaires à celles observées avec l'administration de la brimonidine en monothérapie.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via:
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet: www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlande
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/14/933/001-002
10. DATE DE MISE À JOUR DU TEXTE
01.09.2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3194370 | SIMBRINZA 10MG/ML + 2 MG/ML COLLYRE SUSPENS 3X5ML | S01EC54 | € 37,1 | - | Oui | € 9,43 | € 5,61 |