RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
Simponi 100 mg, solution injectable en stylo prérempli.
Simponi 100 mg, solution injectable en seringue préremplie.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Simponi 100 mg, solution injectable en stylo prérempli
Chaque stylo prérempli de 1 mL contient 100 mg de golimumab*.
Simponi 100 mg, solution injectable en seringue préremplie
Chaque seringue préremplie de 1 mL contient 100 mg de golimumab*.
* Anticorps monoclonal humain de type IgG1κ produit sur une lignée cellulaire d’hybridome de souris par la technique de l’ADN recombinant.
Excipient à effet notoire
Chaque stylo prérempli contient 41 mg de sorbitol par dose de 100 mg.
Chaque seringue préremplie contient 41 mg de sorbitol par dose de 100 mg.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution injectable en stylo prérempli (injection), SmartJect.
Solution injectable en seringue préremplie (injection).
La solution est limpide à légèrement opalescente, incolore à légèrement jaune.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Polyarthrite rhumatoïde (PR)
Simponi, en association avec le méthotrexate (MTX), est indiqué dans :
- le traitement de la polyarthrite rhumatoïde active, modérée à sévère chez les adultes, lorsque la réponse aux traitements de fond antirhumatismaux (DMARD), y compris le MTX, a été inadéquate.
- le traitement de la polyarthrite rhumatoïde active, sévère et évolutive chez les adultes non traités auparavant par le MTX.
Il a été démontré que Simponi, en association avec le MTX, ralentit la vitesse de progression de la destruction articulaire, mesurée par radiographie et améliore la fonction physique.
Pour toute information concernant l’indication dans l’arthrite juvénile idiopathique polyarticulaire, veuillez voir le RCP de Simponi 50 mg.
Rhumatisme psoriasique (RP)
Simponi, seul ou en association avec le MTX, est indiqué dans le traitement du rhumatisme psoriasique actif et évolutif chez les adultes, lorsque la réponse à un précédent traitement par DMARD a été inadéquate. Il a été démontré que Simponi ralentit la vitesse de progression de la destruction articulaire périphérique, mesurée par radiographie chez les patients présentant des formes polyarticulaires symétriques de la maladie (voir rubrique 5.1) et améliore la fonction physique.
Spondyloarthrite axiale
Spondylarthrite ankylosante (SA)
Simponi est indiqué dans le traitement de la spondylarthrite ankylosante active sévère chez les adultes qui n’ont pas répondu de manière adéquate à un traitement conventionnel.
Spondyloarthrite axiale non radiographique (SpA axiale NR)
Simponi est indiqué dans le traitement de la spondyloarthrite axiale active non radiographique sévère de l’adulte avec des signes objectifs d’inflammation, se traduisant par un taux élevé de protéine C réactive (CRP) et/ou de signes visibles à l’imagerie par résonance magnétique (IRM), en cas de réponse inadéquate ou d’intolérance aux anti-inflammatoires non stéroïdiens (AINS).
Rectocolite hémorragique (RCH)
Simponi est indiqué dans le traitement de la rectocolite hémorragique active, modérée à sévère, chez les patients adultes qui n'ont pas répondu de manière adéquate à un traitement conventionnel comprenant les corticoïdes et la 6‑mercaptopurine (6‑MP) ou l'azathioprine (AZA), ou chez lesquels ce traitement est mal toléré ou contre‑indiqué.
4.2 Posologie et mode d’administration
Le traitement doit être initié et supervisé par des médecins qualifiés expérimentés dans le diagnostic et le traitement de la polyarthrite rhumatoïde, du rhumatisme psoriasique, de la spondylarthrite ankylosante, de la spondyloarthrite axiale non radiographique ou de la rectocolite hémorragique. Les patients traités par Simponi devront recevoir la carte de rappel patient.
Posologie
Polyarthrite rhumatoïde
Simponi 50 mg administré une fois par mois, à la même date chaque mois.
Simponi doit être administré de manière concomitante avec le MTX.
Rhumatisme psoriasique, spondylarthrite ankylosante ou spondyloarthrite axiale non radiographique
Simponi 50 mg administré une fois par mois, à la même date chaque mois.
Pour toutes les indications ci‑dessus, les données disponibles suggèrent que la réponse clinique est habituellement obtenue dans les 12 à 14 semaines de traitement (après 3 à 4 doses). La poursuite du traitement doit être reconsidérée chez les patients pour lesquels aucun bénéfice thérapeutique n’a été démontré au cours de cette période.
Patients dont le poids corporel est supérieur à 100 kg
Pour toutes les indications ci‑dessus, chez les patients ayant une PR, un RP, une SA ou une SpA axiale NR avec un poids corporel de plus de 100 kg qui n’obtiennent pas de réponse clinique satisfaisante après 3 ou 4 doses, une augmentation de la dose de golimumab à 100 mg une fois par mois peut être envisagée, en tenant compte du risque accru de certains effets indésirables graves survenant avec une dose de 100 mg par rapport à 50 mg (voir rubrique 4.8). La poursuite du traitement doit être reconsidérée chez les patients pour lesquels aucun bénéfice thérapeutique n’a été démontré après 3 à 4 doses supplémentaires de 100 mg.
Rectocolite hémorragique
Patients pesant moins de 80 kg
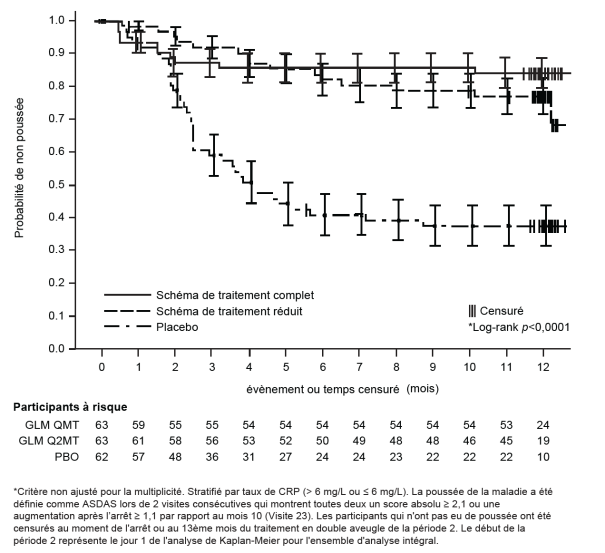
Simponi est administré à la dose initiale de 200 mg, suivie de 100 mg à la semaine 2. Les patients qui ont répondu de manière adéquate doivent recevoir 50 mg à la semaine 6 et toutes les 4 semaines par la suite. Les patients qui n’ont pas répondu de manière adéquate peuvent continuer de recevoir 100 mg à la semaine 6 et toutes les 4 semaines par la suite (voir rubrique 5.1).
Patients pesant 80 kg ou plus
Simponi est administré à la dose initiale de 200 mg, suivie de 100 mg à la semaine 2, puis par la suite 100 mg toutes les 4 semaines (voir rubrique 5.1).
Pendant le traitement d'entretien, les corticoïdes pourront être progressivement diminués conformément aux recommandations de pratique clinique.
Les données disponibles suggèrent que la réponse clinique est habituellement obtenue dans les 12 à 14 semaines de traitement (après 4 doses). La poursuite du traitement doit être reconsidérée chez les patients pour lesquels aucun bénéfice thérapeutique n'a été démontré au cours de cette période.
En cas d’oubli d’une prise de Simponi
Si un patient oublie une injection de Simponi le jour prévu, elle doit être effectuée dès que le patient s’en souvient. Les patients doivent recevoir comme instruction de ne pas injecter une double dose pour compenser la dose oubliée.
La dose suivante devra être administrée d’après le principe suivant :
- si la dose est administrée avec moins de 2 semaines de retard, le patient devra s’injecter la dose oubliée et poursuivre le traitement selon le calendrier initial.
- si la dose est administrée avec plus de 2 semaines de retard, le patient devra s’injecter la dose oubliée et un nouveau calendrier devra être établi à partir de la date de cette injection.
Populations particulières
Sujets âgés (≥ 65 ans)
Aucun ajustement de dose n’est nécessaire chez les sujets âgés.
Insuffisance rénale et hépatique
Simponi n’a pas été étudié chez ces populations de patients. Aucune recommandation de doses ne peut être faite.
Population pédiatrique
Simponi 100 mg n’est pas recommandé chez les enfants âgés de moins de 18 ans.
Mode d’administration
Simponi est destiné à un usage sous‑cutané. Après avoir été formés de manière appropriée à la technique d’injection sous‑cutanée, les patients peuvent s’injecter eux‑mêmes si leur médecin considère que cela est approprié, avec un suivi médical si nécessaire. Les patients doivent recevoir comme instruction d’injecter la quantité totale de Simponi selon les instructions complètes d’utilisation fournies dans la notice. Si plusieurs injections sont nécessaires, les injections doivent être administrées à différents endroits du corps.
Pour les instructions d’administration, voir la rubrique 6.6.
4.3 Contre‑indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Tuberculose (TB) active ou autres infections sévères, telles que sepsis, et infections opportunistes (voir rubrique 4.4).
Insuffisance cardiaque modérée ou sévère (de classe III/IV dans la classification NYHA) (voir rubrique 4.4).
4.8 Effets indésirables
Résumé du profil de tolérance
Au cours de la période contrôlée des études pivots dans le traitement de la PR, du RP, de la SA, de la SpA axiale NR et de la RCH, l’effet indésirable (EI) le plus fréquemment rapporté était l’infection des voies respiratoires hautes, observée chez 12,6 % des patients traités par golimumab comparé à 11,0 % des patients témoins. Les EI les plus graves, rapportés sous golimumab étaient des infections graves (y compris sepsis, pneumonie, TB, infections fongiques invasives et infections opportunistes), troubles démyélinisants, réactivation du VHB, ICC, processus auto‑immuns (syndrome lupique « type lupus »), réactions hématologiques, hypersensibilité systémique grave (y compris réaction anaphylactique), vascularite, lymphome et leucémie (voir rubrique 4.4).
Liste sous forme de tableau des effets indésirables
Les EI observés lors d’études cliniques et rapportés depuis la commercialisation dans le monde sont listés dans le tableau 1. Au sein des systèmes classe‑organe, les EI sont listés par fréquence en utilisant la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 1
Liste sous forme de tableau des EI
Infections et infestations |
|
Très fréquent : | Infection des voies respiratoires hautes (nasopharyngite, pharyngite, laryngite et rhinite) |
Fréquent : | Infections bactériennes (telles que cellulite), infection des voies respiratoires basses (telle que pneumonie), infections virales (telles que grippe et herpès), bronchite, sinusite, infections fongiques superficielles, abcès |
Peu fréquent : | Sepsis y compris choc septique, pyélonéphrite |
Rare : | Tuberculose, infections opportunistes (telles qu’infections fongiques invasives [histoplasmose, coccidioïdomycoses, pneumocystose], infection bactérienne, mycobactérienne atypique et protozoaire), réactivation de l’hépatite B, arthrite bactérienne, bursite infectieuse |
Tumeurs bénignes, malignes et non précisées |
|
Peu fréquent : | Tumeurs (telles que cancer de la peau, carcinome à cellules squameuses et naevus malin) |
Rare : | Lymphome, leucémie, mélanome, carcinome à cellules de Merkel |
Indéterminé : | Lymphome T hépatosplénique*, sarcome de Kaposi |
Affections hématologiques et du système lymphatique |
|
Fréquent : | Leucopénie (y compris neutropénie), anémie |
Peu fréquent : | Thrombocytopénie, pancytopénie |
Rare : | Anémie aplasique, agranulocytose |
Affections du système immunitaire |
|
Fréquent : | Réactions allergiques (bronchospasme, hypersensibilité, urticaire), auto‑anticorps positif |
Rare : | Réactions graves d’hypersensibilité systémique (y compris réaction anaphylactique), vascularite (systémique), sarcoïdose |
Affections endocriniennes |
|
Peu fréquent : | Trouble thyroïdien (tel que hypothyroïdie, hyperthyroïdie et goitre) |
Affections du métabolisme et de la nutrition |
|
Peu fréquent : | Augmentation du taux de glucose dans le sang, augmentation des lipides |
Affections psychiatriques |
|
Fréquent : | Dépression, insomnie |
Affections du système nerveux |
|
Fréquent : | Vertiges, céphalées, paresthésies |
Peu fréquent : | Troubles de l’équilibre |
Rare : | Troubles démyélinisants (central et périphérique), dysgueusie |
Affections oculaires |
|
Peu fréquent : | Troubles visuels (tels que vision floue et diminution de l’acuité visuelle), conjonctivite, allergie oculaire (telles que prurit et irritation) |
Affections cardiaques |
|
Peu fréquent : | Arythmie, troubles ischémiques des artères coronaires |
Rare : | Insuffisance cardiaque congestive (apparition ou aggravation) |
Affections vasculaires |
|
Fréquent : | Hypertension |
Peu fréquent : | Thrombose (telle que thrombose veineuse profonde et aortique), rougeur |
Rare : | Phénomène de Raynaud |
Affections respiratoires, thoraciques et médiastinales |
|
Fréquent : | Asthme et symptômes associés (tels que sifflements et hyperactivité bronchique) |
Peu fréquent : | Maladie pulmonaire interstitielle |
Affections gastro‑intestinales |
|
Fréquent : | Dyspepsie, douleur gastro‑intestinale et abdominale, nausées, troubles inflammatoires gastro‑intestinaux (tels que gastrite et colite), stomatite |
Peu fréquent : | Constipation, reflux gastro‑oesophagien |
Affections hépatobiliaires |
|
Fréquent : | Augmentation de l’alanine aminotransférase, augmentation de l’aspartate aminotransférase |
Peu fréquent : | Cholélithiase, troubles hépatiques |
Affections de la peau et du tissu sous‑cutané |
|
Fréquent : | Prurit, rash, alopécie, dermatite |
Peu fréquent : | Réactions cutanées bulleuses, psoriasis (apparition de novo ou aggravation d’un psoriasis pré‑existant palmaire/plantaire et pustuleux), urticaire |
Rare : | Réactions lichénoïdes, exfoliation de la peau, vascularite (cutanée) |
Indéterminé : | Aggravation des symptômes de dermatomyosite |
Affections musculo‑squelettiques et du tissu conjonctif |
|
Rare : | Syndrome lupique |
Affections rénales et urinaires |
|
Rare : | Troubles de la vessie, troubles rénaux |
Affections des organes de reproduction et des seins |
|
Peu fréquent : | Troubles mammaires, troubles du cycle menstruel |
Troubles généraux et anomalies au site d’administration |
|
Fréquent : | Pyrexie, asthénie, réaction au site d’injection (telle qu’érythème au site d’injection, urticaire, induration, douleur, hématome, prurit, irritation et paresthésie), gêne thoracique |
Rare : | Retard de cicatrisation |
Blessure, empoisonnement et opérations compliquées |
|
Fréquent : | Fractures osseuses |
* Observés avec d’autres anti‑TNF | |
Dans toute cette rubrique, la durée médiane de suivi (approximativement 4 ans) est généralement présentée quelques soient l’indication et le dosage de golimumab utilisé. Lorsque l’utilisation de golimumab est décrite par dose, la durée médiane de suivi varie (approximativement 2 ans pour la dose de 50 mg, approximativement 3 ans pour la dose de 100 mg) car les patients ont pu passer d’une dose à une autre.
Description des effets indésirables sélectionnés
Infections
Au cours de la période contrôlée des études pivots, l’infection des voies respiratoires hautes a été l’effet indésirable le plus fréquemment rapporté ; chez 12,6 % des patients traités par golimumab (incidence pour 100 sujets‑année : 60,8 ; IC de 95 % : 55,0, 67,1) comparé à 11,0 % chez les patients du groupe contrôle (incidence pour 100 sujets‑année : 54,5 ; IC de 95 % : 46,1, 64,0). Dans les parties contrôlées et non contrôlées des études cliniques avec un suivi médian d’approximativement 4 ans, l’incidence pour 100 sujets‑année des infections des voies respiratoires hautes était de 34,9 évènements ; IC de 95 % : 33,8, 36,0 chez les patients traités par golimumab.
Au cours de la période contrôlée des études pivots, des infections ont été observées chez 23,0 % des patients traités par golimumab (incidence pour 100 sujets‑année : 132,0 ; IC de 95 % : 123,3, 141,1) comparé à 20,2 % chez les patients du groupe contrôle (incidence pour 100 sujets‑année : 122,3 ; IC de 95 % : 109,5, 136,2). Dans les parties contrôlées et non contrôlées des études cliniques avec un suivi médian d’approximativement 4 ans, l’incidence pour 100 sujets‑année des infections était de 81,1 évènements ; IC de 95 % : 79,5, 82,8 chez les patients traités par golimumab.
Au cours de la période contrôlée des études dans la PR, le RP, la SA et la SpA axiale NR, des infections graves ont été observées chez 1,2 % des patients traités par golimumab et 1,2 % des patients du groupe contrôle. L’incidence des infections graves pour 100 sujets‑année au cours de la période contrôlée des études dans la PR, le RP, la SA et la SpA axiale NR était de 7,3 ; IC de 95 % : 4,6, 11,1 pour le groupe golimumab 100 mg ; 2,9 ; IC de 95 % : 1,2, 6,0 pour le groupe golimumab 50 mg et 3,6 ; IC de 95 % : 1,5, 7,0 pour le groupe placebo. Dans la RCH, au cours de la période contrôlée des études sur l’induction par le golimumab, des infections graves ont été observées chez 0,8 % des patients traités par golimumab, comparé à 1,5 % des patients du groupe contrôle. Les infections graves observées chez les patients traités par golimumab comprenaient tuberculose, infections bactériennes y compris sepsis et pneumonie, infections fongiques invasives et autres infections opportunistes. Certaines de ces infections ont été mortelles. Dans les parties contrôlées et non contrôlées des études pivots avec un suivi médian jusqu’à 3 ans, il y avait une plus grande incidence d’infections graves, incluant les infections opportunistes et la TB chez les patients recevant golimumab 100 mg comparé aux patients recevant golimumab 50 mg. L’incidence pour 100 sujets‑année de toutes les infections graves était de 4,1 ; IC de 95 % : 3,6, 4,5, chez les patients recevant golimumab 100 mg et de 2,5 ; IC de 95 % : 2,0, 3,1 chez les patients recevant golimumab 50 mg.
Tumeurs malignes
Lymphome
Au cours des études pivots, l’incidence des lymphomes chez les patients traités par golimumab a été supérieure à celle attendue dans la population générale. Dans les parties contrôlées et non contrôlées de ces études avec un suivi médian jusqu’à 3 ans, une plus grande incidence de lymphome a été observée chez les patients recevant golimumab 100 mg comparé aux patients recevant golimumab 50 mg. Un lymphome a été diagnostiqué chez 11 sujets (1 dans le groupe traité par golimumab 50 mg et 10 dans les groupes traités par golimumab 100 mg) avec une incidence (IC de 95 %) pour 100 sujets‑année de suivi de 0,03 (0,00, 0,15) et 0,13 (0,06, 0,24) évènement pour golimumab 50 mg et 100 mg respectivement et 0,00 (0,00, 0,57) évènement pour le groupe placebo. La majorité des lymphomes est survenue au cours de l’étude GO‑AFTER, qui incluait des patients exposés auparavant à des anti‑TNF, atteints d’une maladie de durée plus longue et réfractaire à plus de traitements (voir rubrique 4.4).
Tumeurs malignes autres que le lymphome
Au cours des périodes contrôlées des études pivots, et pendant approximativement 4 années de suivi, l’incidence des tumeurs malignes autres que le lymphome (excepté les cancers de la peau autres que le mélanome) était comparable dans les groupes golimumab et dans le groupe contrôle. Après approximativement 4 années de suivi, l’incidence des tumeurs non lymphomateuses (excepté les cancers de la peau autres que le mélanome) était comparable à celle observée dans la population générale.
Au cours des périodes contrôlées et non contrôlées des études pivots avec un suivi médian jusqu’à 3 ans, un cancer de la peau autre que le mélanome a été diagnostiqué chez 5 sujets dans le groupe placebo, 10 dans le groupe golimumab 50 mg et 31 dans le groupe golimumab 100 mg avec une incidence (IC de 95 %) pour 100 sujets‑année de suivi de 0,36 (0,26, 0,49) pour les groupes golimumab combinés et 0,87 (0,28, 2,04) pour le groupe placebo.
Au cours des périodes contrôlées et non contrôlées des études pivots avec un suivi médian jusqu’à 3 ans, des tumeurs malignes en plus de mélanome, de cancer de la peau autre que le mélanome et de lymphome ont été diagnostiquées chez 5 sujets dans le groupe placebo, 21 dans le groupe golimumab 50 mg et 34 dans le groupe golimumab 100 mg avec une incidence (IC de 95 %) pour 100 sujets‑année de suivi de 0,48 (0,36, 0,62) pour les groupes golimumab combinés et 0,87 (0,28, 2,04) pour le groupe placebo (voir rubrique 4.4).
Cas rapportés lors d’études cliniques dans l’asthme
Lors d’une étude clinique exploratoire, les patients atteints d’asthme persistant sévère ont reçu une dose de charge de golimumab (150 % de la dose de traitement attribuée) par voie sous‑cutanée à la semaine 0 suivie d’une dose de golimumab 200 mg, de golimumab 100 mg ou de golimumab 50 mg toutes les 4 semaines par voie sous‑cutanée jusqu’à la semaine 52. Huit tumeurs malignes dans le groupe de traitement golimumab combiné (n = 230) ont été rapportées et aucune dans le groupe placebo (n = 79). Un lymphome a été rapporté chez 1 patient, un cancer de la peau autre que le mélanome chez 2 patients et d’autres tumeurs malignes chez 5 patients. Aucun groupement spécifique selon un type quelconque de tumeur maligne n’a été défini.
Au cours de la phase contrôle versus placebo de l’essai clinique, l’incidence (IC de 95 %) de toutes les tumeurs malignes pour 100 sujets‑année de suivi était de 3,19 (1,38, 6,28) dans le groupe golimumab. Dans cette étude, l’incidence (IC de 95 %) pour 100 sujets‑année de suivi chez les sujets traités par golimumab était de 0,40 (0,01, 2,20) pour le lymphome, 0,79 (0,10, 2,86) pour les cancers de la peau autres que le mélanome et 1,99 (0,64, 4,63) pour les autres tumeurs malignes. Pour les sujets sous placebo, l’incidence (IC de 95 %) pour 100 sujets‑année de suivi de ces tumeurs malignes était de 0,00 (0,00, 2,94). La signification de ce résultat est inconnue.
Atteintes neurologiques
Au cours des périodes contrôlées et non contrôlées des études pivots avec un suivi médian jusqu’à 3 ans, une plus grande incidence des troubles démyélinisants a été observée chez les patients recevant golimumab 100 mg comparée aux patients recevant golimumab 50 mg (voir rubrique 4.4).
Augmentation du taux des enzymes hépatiques
Au cours des périodes contrôlées des études pivots dans la PR et RP, une légère augmentation du taux d’ALAT (> 1 et < 3 x la limite normale supérieure (LNS)) a été observée en proportions comparables chez les patients traités par golimumab et les patients du groupe contrôle lors des études dans la PR et le RP (22,1 % à 27,4 % des patients) ; dans les études sur la SA et la SpA axiale NR, une légère augmentation du taux d’ALAT a été observée chez un nombre plus important de patients traités par golimumab (26,9 %) que chez les patients du groupe contrôle (10,6 %). Au cours des périodes contrôlées et non contrôlées des études pivots dans la PR et le RP avec un suivi médian d’approximativement 5 années, l’incidence de la légère augmentation du taux d’ALAT était comparable chez les patients traités par golimumab et chez les patients du groupe contrôle lors des études dans la PR et le RP. Dans la RCH, au cours de la période contrôlée des études sur l’induction par le golimumab, une légère augmentation du taux d'ALAT (> 1 et < 3 x LNS) a été observée en proportions comparables chez les patients traités par golimumab et chez les patients du groupe contrôle (respectivement 8,0 % et 6,9 %). Dans la RCH, au cours des périodes contrôlées et non contrôlées des études pivots avec un suivi médian d’approximativement 2 ans, la proportion de patients avec une augmentation légère du taux d'ALAT a été de 24,7 % chez les patients traités par golimumab au cours de la phase d’entretien de l'étude dans la RCH.
Au cours des périodes contrôlées des études pivots dans la PR et la SA, l’augmentation du taux d’ALAT ≥ 5 x LNS était peu fréquente et observée chez un nombre plus important de patients traités par golimumab (0,4 % à 0,9 %) que de patients du groupe contrôle (0,0 %). Cette tendance n’a pas été observée dans la population atteinte de RP. Au cours des périodes contrôlées et non contrôlées des études pivots dans la PR, le RP et la SA avec un suivi médian de 5 années, l’incidence de l’augmentation du taux d’ALAT ≥ 5 x LNS était comparable chez les patients traités par golimumab et chez les patients du groupe contrôle. En général, ces augmentations ont été asymptomatiques et les anomalies ont diminué ou se sont résolues soit en maintenant, soit en interrompant le traitement par golimumab, soit en modifiant la prise de médicaments concomitants. Aucun cas n'a été rapporté au cours des périodes contrôlées et non contrôlées de l'étude dans la SpA axiale NR (jusqu'à 1 an). Dans la RCH, au cours des périodes contrôlées des études pivots du traitement d'induction par golimumab, une augmentation du taux d'ALAT ≥ 5 x LNS a été observée en proportions comparables chez les patients traités par golimumab et chez les patients du groupe placebo (respectivement 0,3 % et 1,0 %). Dans la RCH, au cours des périodes contrôlées et non contrôlées des études pivots avec un suivi médian d’approximativement 2 ans, pendant la période d’entretien, la proportion de patients avec une augmentation du taux d'ALAT ≥ 5 x LNS a été de 0,8 % chez les patients recevant du golimumab.
Au cours des études pivots dans la PR, le RP, la SA et la SpA axiale NR, un patient d’une étude dans la PR présentant des anomalies hépatiques pré‑existantes et recevant des médicaments pouvant y être associés, a reçu golimumab et a développé une hépatite fatale non infectieuse accompagnée d’une jaunisse. Le rôle du golimumab comme facteur associé ou aggravant ne peut pas être exclu.
Réactions au site d’injection
Des réactions au site d’injection ont été observées lors des périodes contrôlées des études pivots chez 5,4 % des patients traités par golimumab par rapport à 2,0 % chez les patients du groupe contrôle. La présence d’anticorps anti‑golimumab peut augmenter le risque de réactions au site d’injection. La majorité des réactions au site d’injection étaient légères ou modérées, et la manifestation la plus fréquente a été un érythème au site d’injection. Les réactions au site d’injection n’ont généralement pas nécessité l’arrêt du traitement.
Au cours des périodes contrôlées des études de phase IIb et/ou III dans la PR, le RP, la SA, la SpA axiale NR, l’asthme persistant sévère, et au cours des études de phase II/III dans la RCH, aucun patient traité par golimumab n’a développé de réaction anaphylactique.
Auto‑anticorps
Au cours des périodes contrôlées et non contrôlées des études pivots durant 1 année de suivi, 3,5 % des patients traités par golimumab et 2,3 % des patients du groupe contrôle ont développé des anticorps anti‑nucléaires (à des titres de 1/160 ou supérieurs). La fréquence des anticorps anti‑ADN double brin au bout d’un an de suivi chez les patients anti‑ADN double brin négatif au début de l’étude était de 1,1 %.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance
Site internet : www.notifieruneffetindesirable.be
E-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Janssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Belgique
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
EU/1/09/546/005 1 stylo prérempli
EU/1/09/546/006 3 stylos préremplis
EU/1/09/546/007 1 seringue préremplie
EU/1/09/546/008 3 seringues préremplies
10. DATE DE MISE A JOUR DU TEXTE
09/10/2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments https://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3091550 | SIMPONI 100 MG SOL INJ SER PREREMPLIE 1 | L04AB06 | € 801,29 | - | Oui | € 12,5 | € 8,3 |
| 3091568 | SIMPONI 100 MG STYLO PREREMPLI SMARTJECT | L04AB06 | € 801,29 | - | Oui | € 12,5 | € 8,3 |