1. DÉNOMINATION DU MÉDICAMENT
Otezla 10 mg comprimés pelliculés
Otezla 20 mg comprimés pelliculés
Otezla 30 mg comprimés pelliculés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Otezla 10 mg comprimés pelliculés
Chaque comprimé pelliculé contient 10 mg d’aprémilast.
Excipient(s) à effet notoire:
Chaque comprimé pelliculé contient 57 mg de lactose (sous forme de lactose monohydraté).
Otezla 20 mg comprimés pelliculés
Chaque comprimé pelliculé contient 20 mg d’aprémilast.
Excipient(s) à effet notoire:
Chaque comprimé pelliculé contient 114 mg de lactose (sous forme de lactose monohydraté).
Otezla 30 mg comprimés pelliculés
Chaque comprimé pelliculé contient 30 mg d’aprémilast.
Excipient(s) à effet notoire:
Chaque comprimé pelliculé contient 171 mg de lactose (sous forme de lactose monohydraté).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé (comprimé).
Otezla 10 mg comprimés pelliculés
Comprimé pelliculé de 10 mg rose en forme de losange d’une longueur de 8 mm portant la mention « APR » gravée sur une face et « 10 » sur l’autre face.
Otezla 20 mg comprimés pelliculés
Comprimé pelliculé de 20 mg marron en forme de losange d’une longueur de 10 mm portant la mention « APR » gravée sur une face et « 20 » sur l’autre face.
Otezla 30 mg comprimés pelliculés
Comprimé pelliculé de 30 mg beige en forme de losange d’une longueur de 12 mm portant la mention « APR » gravée sur une face et « 30 » sur l’autre face.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Rhumatisme psoriasique
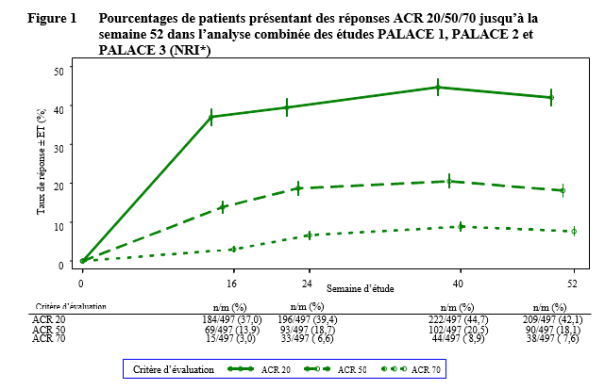
Otezla, seul ou en association avec un traitement de fond antirhumatismal (DMARD), est indiqué dans le traitement du rhumatisme psoriasique (RP) actif chez les patients adultes ayant présenté une réponse insuffisante ou une intolérance à un traitement de fond antérieur (voir rubrique 5.1).
Psoriasis
Otezla est indiqué dans le traitement du psoriasis en plaques chronique modéré à sévère chez les patients adultes en cas d’échec, ou de contre-indication, ou d’intolérance aux autres traitements systémiques dont la ciclosporine, le méthotrexate ou la photothérapie UVA + psoralène (PUVA thérapie).
Maladie de Behçet
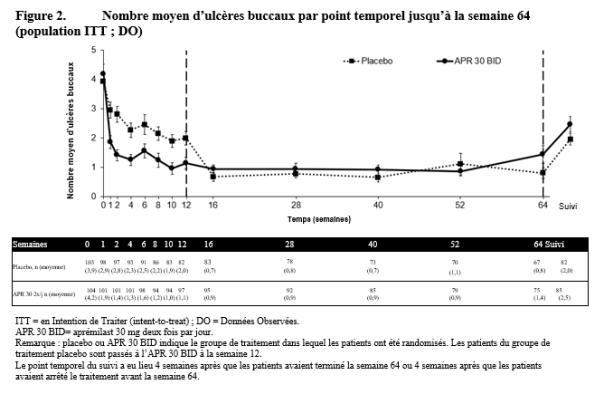
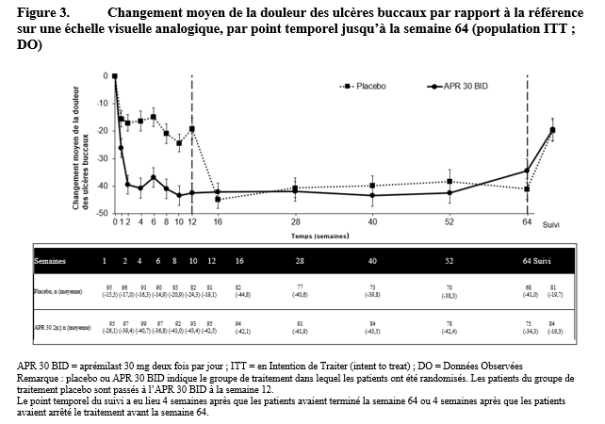
Otezla est indiqué pour le traitement de patients adultes atteints d’ulcères buccaux associés à la maladie de Behçet (MB) qui sont éligibles à un traitement systémique.
4.2 Posologie et mode d’administration
Le traitement par Otezla doit être initié par des spécialistes expérimentés dans le diagnostic et le traitement du psoriasis, du rhumatisme psoriasique ou de la maladie de Behçet.
Posologie
La dose recommandée d’aprémilast est de 30 mg prise par voie orale deux fois par jour à environ 12 heures d’intervalle (matin et soir), sans conditions de prise alimentaire. Un schéma d’initiation du traitement doit être appliqué comme indiqué dans le tableau 1. Aucun nouveau schéma d’initiation n’est nécessaire après ce schéma initial.
Tableau 1. Schéma d’initiation du traitement
Jour 1 | Jour 2 | Jour 3 | Jour 4 | Jour 5 | À partir du jour 6 | |||||
Matin | Matin | Soir | Matin | Soir | Matin | Soir | Matin | Soir | Matin | Soir |
10 mg | 10 mg | 10 mg | 10 mg | 20 mg | 20 mg | 20 mg | 20 mg | 30 mg | 30 mg | 30 mg |
Si un patient oublie de prendre une dose, celle-ci doit être prise le plus rapidement possible. S’il est presque l’heure de la prochaine dose, la dose oubliée ne doit pas être prise et la prochaine dose doit être prise au moment habituel.
Au cours des études pivots, l’amélioration la plus importante a été observée au cours des 24 premières semaines de traitement pour le RP et le PSOR, et au cours des 12 premières semaines de traitement pour la MB. En l’absence de signes de bénéfice thérapeutique après cette période, la poursuite du traitement doit être reconsidérée. La réponse du patient au traitement doit être évaluée régulièrement.
Populations particulières
Sujets âgés
Aucune adaptation posologique n’est nécessaire pour cette population de patients (voir rubriques 4.8 et 5.2).
Patients atteints d’insuffisance rénale
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée. La dose d’aprémilast doit être diminuée à 30 mg une fois par jour chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine < 30 mL/min estimée par l’équation de Cockroft‑Gault). Pour le schéma d’initiation du traitement dans ce groupe, il est recommandé de prendre la dose d’aprémilast en utilisant le schéma posologique du matin seulement présenté dans le tableau 1 et d’omettre les doses du soir (voir rubrique 5.2).
Patients atteints d’insuffisance hépatique
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance hépatique (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité de l’aprémilast chez les enfants âgés de 0 à 17 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Otezla est administré par voir orale. Les comprimés pelliculés doivent être avalés entiers et peuvent être pris au cours ou en dehors des repas.
4.3 Contre‑indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Grossesse (voir rubrique 4.6).
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés avec l’aprémilast dans le RP et le PSOR sont des affections gastro‑intestinales (GI), incluant diarrhée (15,7 %) et nausées (13,9 %). Les autres effets indésirables les plus fréquemment rapportés sont des infections des voies respiratoires supérieures (8,4 %), des céphalées (7,9 %) et des céphalées de tension (7,2 %) et sont dans la majorité des cas d’intensité légère à modérée.
Les effets indésirables les plus fréquemment signalés avec l’aprémilast dans la MB sont la diarrhée (41,3 %), les nausées (19,2 %), les céphalées (14,4 %), l’infection des voies respiratoires supérieures (11,5 %), les douleurs abdominales supérieures (8,7 %), les vomissements (8,7 %) et les douleurs dorsales (7,7 %) et sont pour la plupart d’intensité légère à modérée.
Les effets indésirables gastro-intestinaux sont généralement survenus au cours des 2 premières semaines de traitement et se sont généralement résorbés en 4 semaines.
Des réactions d’hypersensibilité sont observées peu fréquemment (voir rubrique 4.3).
Liste tabulée des effets indésirables
Les effets indésirables observés chez les patients traités par l’aprémilast sont présentés ci‑dessous par classe de systèmes d’organes (SOC) et fréquence. Au sein de chaque SOC et groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Les effets indésirables ont été déterminés à partir des données du programme de développement clinique de l’aprémilast et des données acquises depuis la commercialisation. Les fréquences des effets indésirables sont celles rapportées dans les groupes traités par l’aprémilast dans les quatre études de phase III menées dans le rhumatisme psoriasique (n = 1 945) ou dans les deux études de phase III menées dans le psoriasis (n = 1 184), et dans l’étude de phase III menée dans la maladie de Behçet (n = 207) (le tableau 2 présente la fréquence la plus élevée observée dans chaque regroupement de données).
Les fréquences sont définies comme : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 2. Synthèse des effets indésirables rapportés lors du traitement du rhumatisme psoriasique (RP), du psoriasis (PSOR) et de la maladie de Behçet (MB)
Classe de Systèmes d’Organes | Fréquence | Effet indésirable |
Infections et infestations | Très fréquent | Infection des voies respiratoires supérieuresa |
Fréquent | Bronchite | |
Rhinopharyngite* | ||
Affections du système immunitaire | Peu fréquent | Hypersensibilité |
Troubles du métabolisme et de la nutrition | Fréquent | Appétit diminué* |
Affections psychiatriques | Fréquent | Insomnie |
Dépression | ||
Peu fréquent | Idées et comportements suicidaires | |
Affections du système nerveux | Très fréquent | Céphalées*, a |
Fréquent | Migraine* | |
Céphalées de tension* | ||
Affections respiratoires, thoraciques et médiastinales | Fréquent | Toux |
Affections gastro‑intestinales | Très fréquent | Diarrhée* |
Nausées* | ||
Fréquent | Vomissements* | |
Dyspepsie | ||
Selles fréquentes | ||
Douleur abdominale haute* | ||
Reflux gastro‑œsophagien | ||
Peu fréquent | Hémorragie gastro-intestinale | |
Affections de la peau et du tissu sous‑cutané | Peu fréquent | Rash |
Urticaire | ||
Fréquence indéterminée | Angiœdème | |
Affections musculo‑squelettiques et systémiques | Fréquent | Dorsalgie* |
Troubles généraux et anomalies au site d’administration | Fréquent | Fatigue |
Investigations | Peu fréquent | Perte de poids |
* Au moins un de ces effets indésirables a été rapporté comme grave.
a Fréquence signalée comme étant fréquente dans le RP et le PSOR.
Description de certains effets indésirables
Affections psychiatriques
Dans les études cliniques et depuis la commercialisation, des cas peu fréquents d’idées et de comportements suicidaires ont été rapportés ; des cas de suicide ont été signalés après la commercialisation. Les patients et soignants doivent être avertis qu'ils doivent informer le médecin en cas d’idées suicidaires (voir rubrique 4.4).
Perte de poids
Le poids des patients a été mesuré de façon systématique dans les études cliniques. La perte de poids moyenne observée chez les patients atteints de RP et de PSOR traités par l’aprémilast pendant une durée allant jusqu’à 52 semaines a été de 1,99 kg. Au total, 14,3 % des patients traités par l’aprémilast ont présenté une perte de poids de 5 à 10 %, tandis qu’une perte de poids de plus de 10 % a été rapportée chez 5,7 % des patients. La perte de poids n’a eu de répercussions cliniques significatives chez aucun de ces patients. Au total chez 0,1 % des patients, le traitement par l’aprémilast a été arrêté en raison de l’effet indésirable de perte de poids. La perte de poids moyenne observée chez les patients atteints de MB traités par l’aprémilast pendant 52 semaines était de 0,52 kg. Au total, 11,8 % des patients recevant l’aprémilast ont observé une perte de poids de 5 à 10 %, tandis que 3,8 % des patients recevant l’aprémilast ont observé une perte de poids supérieure à 10 %. Aucun de ces patients n’a eu de conséquences cliniques manifestes à la suite d’une perte de poids. Aucun des patients n’a abandonné l’étude en raison d’un effet indésirable de la diminution du poids.
Se reporter à la mise en garde supplémentaire à la rubrique 4.4 concernant les patients présentant une insuffisance pondérale au début du traitement.
Populations particulières
Patients âgés
D’après les données acquises depuis la commercialisation, les sujets âgés de 65 ans et plus pourraient avoir un risque plus élevé de complications de type diarrhée, nausées et vomissements sévères (voir rubrique 4.4).
Patients insuffisants hépatiques
La sécurité de l’aprémilast n’a pas été évaluée chez les patients atteints de rhumatisme psoriasique, de psoriasis ou de la maladie de Behçet présentant une insuffisance hépatique.
Patients insuffisants rénaux
Dans les études cliniques menées dans le RP, le PSOR ou la MB, le profil de sécurité observé chez les patients présentant une insuffisance rénale légère était comparable à celui observé chez les patients ayant une fonction rénale normale. La sécurité de l’aprémilast n’a pas été évaluée dans les études cliniques chez les patients atteints de rhumatisme psoriasique, de psoriasis ou de la maladie de Behçet présentant une insuffisance rénale modérée ou sévère.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration :
Belgique
Agence fédérale des médicaments et des produits de santé
Division Vigilance
EUROSTATION II
Place Victor Horta, 40/40
B-1060 Bruxelles
Site internet : www.afmps.be
E-mail : adversedrugreactions@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
Bâtiment de Biologie Moléculaire et de Biopathologie (BBB)
CHRU de Nancy - Hôpitaux de Brabois
Rue du Morvan
54 511 VANDOEUVRE-LES-NANCY CEDEX
E-mail : crpv@chru-nancy.fr
Tél : +33 3 83 65 60 85 / 87
Fax : +33 3 83 65 61 33
ou
Direction de la Santé
Division de la Pharmacie et des Médicaments
Allée Marconi - Villa Louvigny
L-2120 Luxembourg
E-mail : pharmacovigilance@ms.etat.lu
Tél : +352 247 85592
Fax : +352 247 95615
Lien pour le formulaire : http://www.sante.public.lu/fr/politique-sante/ministere-sante/direction-sante/div-pharmacie-medicaments/index.html
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Amgen Europe B.V.
Minervum 7061
4817 ZK Breda
Pays-Bas
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
Otezla 10 mg, 20 mg, 30 mg comprimés pelliculés (étui d’initiation)
EU/1/14/981/001
Otezla 30 mg comprimés pelliculés
EU/1/14/981/002 – boîte de 56 comprimés
EU/1/14/981/003 – boîte de 168 comprimés
10. DATE DE MISE À JOUR DU TEXTE
avril 2020
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3314267 | OTEZLA 10-20-30MG COMP PELL 27 ETUI INITIATION | L04AA32 | € 337,99 | - | Oui | € 12,5 | € 8,3 |
| 3314275 | OTEZLA 30MG COMP PELL 56 X 30MG | L04AA32 | € 689,63 | - | Oui | € 12,5 | € 8,3 |