RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
Onglyza 2,5 mg, comprimés pelliculés
Onglyza 5 mg, comprimés pelliculés
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Onglyza 2,5 mg, comprimés pelliculés
Chaque comprimé contient 2,5 mg de saxagliptine (sous forme de chlorhydrate).
Onglyza 5 mg, comprimés pelliculés
Chaque comprimé contient 5 mg de saxagliptine (sous forme de chlorhydrate).
Excipient à effet notoire
Chaque comprimé contient 99 mg de lactose (sous forme monohydraté).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé (comprimé).
Onglyza 2,5 mg, comprimés pelliculés
Les comprimés d’Onglyza 2,5 mg sont jaune pâle à jaune léger, biconvexes, ronds, pelliculés, portant l'impression à l’encre bleue « 2.5 » d’un côté et « 4214 » de l’autre côté.
Onglyza 5 mg, comprimés pelliculés
Les comprimés d’Onglyza 5 mg sont roses, biconvexes, ronds, pelliculés, portant l'impression à l’encre bleue « 5 » d’un côté et « 4215 » de l’autre côté.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Onglyza est indiqué chez les patients adultes atteints de diabète de type 2 pour améliorer le contrôle de la glycémie en complément d’un régime alimentaire et d’une activité physique :
- en monothérapie, quand l’utilisation de la metformine est considérée comme inappropriée en raison d’une intolérance ou d’une contre‑indication.
- en association avec d’autres médicaments destinés au traitement du diabète, y compris l’insuline, lorsque ces médicaments ne permettent pas d’assurer un contrôle adéquat de la glycémie (voir rubriques 4.4, 4.5 et 5.1 pour les données disponibles concernant les différentes associations).
4.2 Posologie et mode d’administration
Posologie
La dose recommandée d’Onglyza est de 5 mg une fois par jour. Lorsqu’Onglyza est utilisé en association à l’insuline ou à un sulfamide hypoglycémiant, une réduction de la posologie de l’insuline ou du sulfamide hypoglycémiant peut être requise pour réduire le risque d’hypoglycémie (voir rubrique 4.4).
La sécurité d’emploi et l’efficacité de la saxagliptine en trithérapie orale en association à la metformine et à une thiazolidinedione n’ont pas été établies.
Populations particulières
Patients âgés (≥ 65 ans)
Aucune adaptation de la dose n’est recommandée en fonction de l’âge uniquement (voir également rubriques 5.1 et 5.2).
Patients insuffisants rénaux
Aucune adaptation de la dose n’est recommandée chez les patients atteints d’insuffisance rénale légère ni chez les patients ayant une insuffisance rénale modérée qui ont un DFG ≥ 45ml/min.
La dose doit être réduite à 2,5 mg une fois par jour chez les patients ayant une insuffisance rénale modérée qui ont un DFG < 45ml/min. et chez les patients ayant une insuffisance rénale sévère.
Onglyza n’est pas recommandé chez les patients avec une insuffisance rénale terminale (ESDR) requérant une hémodialyse (voir rubrique 4.4).
Dans la mesure où la dose doit être limitée à 2,5 mg sur la base de la fonction rénale, une évaluation de la fonction rénale est recommandée avant l’initiation du traitement et, dans le cadre du suivi de routine, l’évaluation rénale doit être faite périodiquement par la suite (voir rubriques 4.4 et 5.2).
Patients insuffisants hépatiques
Aucune adaptation de la dose n’est nécessaire chez les patients atteints d’insuffisance hépatique légère ou modérée (voir rubrique 5.2). La saxagliptine doit être utilisée avec précaution chez les patients ayant une insuffisance hépatique modérée, et n’est pas recommandée chez les patients ayant une insuffisance hépatique sévère (voir rubrique 4.4).
Population pédiatrique
L’efficacité d’Onglyza chez les enfants âgés de 10 à moins de 18 ans n’a pas été établie. Par conséquent, le traitement des enfants et des adolescents par la saxagliptine n'est pas recommandé. Les données actuellement disponibles sont décrites dans les rubriques 5.1 et 5.2. Onglyza n'a pas été étudié chez les enfants de moins de 10 ans.
Mode d’administration
Les comprimés peuvent être pris au cours ou en dehors des repas à n’importe quel moment de la journée. Les comprimés ne doivent pas être divisés ou coupés.
Si le patient oublie de prendre une dose du médicament, il doit la prendre dès qu’il s’en rend compte. Il ne doit pas prendre une double dose le même jour.
4.3 Contre‑indications
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1, ou antécédents de réaction d’hypersensibilité grave, incluant réaction anaphylactique, choc anaphylactique et angioedème, avec tout inhibiteur de la dipeptidyl peptidase 4 (DPP4) (voir rubriques 4.4 et 4.8).
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés chez au moins 5 % des patients traités par Onglyza 5 mg dans les études versus placebo et de manière plus fréquente que chez les patients traités par placebo sont l’infection des voies respiratoires supérieures (7,7 %), l’infection du tractus urinaire (6,8 %) et les céphalées (6,5 %).
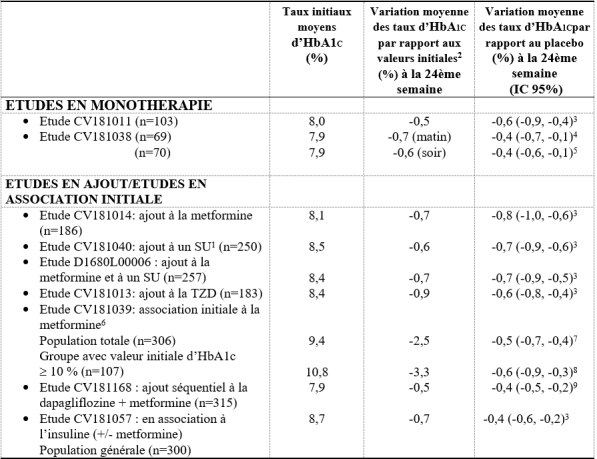
Un total de 4 148 patients atteints de diabète de type 2 incluant 3 021 patients traités par Onglyza ont été randomisés dans 6 études cliniques d’efficacité et de sécurité d’emploi, contrôlées en double aveugle, visant à évaluer les effets de la saxagliptine sur le contrôle de la glycémie. Dans les études contrôlées, randomisées et en double aveugle (incluant les études du programme de développement et la post-commercialisation), plus de 17 000 patients atteints de diabète de type 2 ont été traités par Onglyza.
Dans une analyse poolée de 1 681 patients atteints de diabète de type 2, incluant 882 patients traités par Onglyza 5 mg, randomisés dans cinq études cliniques en double aveugle contrôlées versus placebo, portant sur la sécurité d’emploi et l’efficacité et réalisées pour évaluer les effets de la saxagliptine sur le contrôle glycémique, l’incidence globale d’événements indésirables chez les patients traités par la saxagliptine 5 mg a été similaire à celle observée chez les patients sous placebo. Les arrêts de traitement en raison d’événements indésirables ont été plus fréquents chez les patients recevant la saxagliptine 5 mg que chez les patients sous placebo (3,3 % comparé à 1,8 %).
Liste tabulée des effets indésirables
Les effets indésirables rapportés chez au moins 5 % des patients traités avec la saxagliptine 5 mg et plus fréquemment rapportés que chez les patients traités par placebo ou qui ont été rapportés chez au moins 2 % des patients traités avec la saxagliptine 5 mg et avec une fréquence supérieure d’au moins 1 % comparée au placebo, issus de l’analyse poolée regroupant cinq études portant sur le contrôle glycémique et une étude supplémentaire contrôlée, avec l’association initiale d’un traitement actif antidiabétique avec la metformine sont présentés dans le tableau 1.
Les effets indésirables sont listés par classe de système d’organe et par fréquence absolue. Les fréquences sont définies comme suit : très fréquent ( 1/10), fréquent ( 1/100, < 1/10), peu fréquent ( 1/1 000, < 1/100), rare ( 1/10 000, < 1/1 000), très rare (< 1/10 000), ou indéterminée (ne pouvant être estimée selon les données disponibles).
Tableau 1 Fréquence des effets indésirables par classe de système d’organes issue des essais cliniques et de l’expérience post-commercialisation
Classe de système d’organe | Fréquence des effets indésirables par traitement | ||||
| | | | | Saxagliptine en ajout à la metformine et un sulfamide hypoglycémiant |
Infections et infestations |
|
|
|
|
|
Infections des voies respiratoires supérieures | Fréquent | Fréquent | Fréquent | Fréquent |
|
Infections des voies urinaires | Fréquent | Fréquent | Fréquent | Fréquent |
|
Gastroentérites | Fréquent | Fréquent | Fréquent | Fréquent |
|
Sinusites | Fréquent | Fréquent | Fréquent | Fréquent |
|
Rhinopharyngites |
| Fréquent2 |
|
|
|
Affections du système immunitaire |
|
|
|
|
|
Réactions d’hypersensibilit醇 | Peu fréquent | Peu fréquent | Peu fréquent | Peu fréquent |
|
Réactions anaphylactiques incluant choc anaphylactique†‡ | Rare | Rare | Rare | Rare |
|
Troubles du métabolisme et de la nutrition |
|
|
|
|
|
Hypoglycémie |
|
| Très fréquent3 |
|
|
Dyslipidémie |
|
| Peu fréquent |
|
|
Hyper-triglycéridémie |
|
| Peu fréquent |
|
|
Affections du système nerveux |
|
|
|
|
|
Etourdissement | Fréquent |
|
|
| Fréquent |
Céphalées | Fréquent | Fréquent | Fréquent | Fréquent |
|
Affections gastro-intestinale |
|
|
|
|
|
Douleurs abdominales† | Fréquent | Fréquent | Fréquent | Fréquent |
|
Diarrhées4 | Fréquent | Fréquent | Fréquent | Fréquent |
|
Dyspepsie |
| Fréquent |
|
|
|
Flatulence |
|
|
|
| Fréquent |
Gastrites |
| Fréquent |
|
|
|
Nausées† | Fréquent | Fréquent | Fréquent | Fréquent |
|
Vomissements | Fréquent | Fréquent | Fréquent | Fréquent |
|
Pancréatite† | Peu fréquent | Peu fréquent | Peu fréquent | Peu fréquent |
|
Constipation† | Indéterminée | Indéterminée | Indéterminée | Indéterminée | Indéterminée |
Affections de la peau et du tissu sous cutané |
|
|
|
|
|
Rash† | Fréquent | Fréquent | Fréquent |
|
|
Dermatite† | Peu fréquent | Peu fréquent | Peu fréquent | Peu fréquent |
|
Prurite† | Peu fréquent | Peu fréquent | Peu fréquent | Peu fréquent |
|
Urticaire† | Peu fréquent | Peu fréquent | Peu fréquent | Peu fréquent |
|
Angioedème†‡ | Rare | Rare | Rare | Rare |
|
Pemphigoïde bulleuse† | Indéterminée | Indéterminée | Indéterminée | Indéterminée | Indéterminée |
Affections musculo-squelettiques et systémiques |
|
|
|
|
|
Arthralgie* |
| Peu fréquent |
|
|
|
Myalgie5 |
| Fréquent |
|
|
|
Affections des organes de reproduction et du sein |
|
|
|
|
|
Dysfonctionnement érectile |
| Peu fréquent |
|
|
|
Troubles généraux et anomalies au site d’administration | |
|
|
|
|
Fatigue | Fréquent |
| Peu fréquent |
| Fréquent |
Oedème periphérique |
|
|
| Fréquent |
|
1 Inclut la saxagliptine en ajout à la metformine et en association initiale à la metformine.
2 Uniquement en association initiale.
3 Pas de différence statistiquement significative par rapport au placebo. L’incidence des hypoglycémies confirmées était peu fréquente pour Onglyza 5 mg (0,8 %) et placebo (0,7 %).
4 L’incidence des diarrhées était de 4,1% (36/882) dans le groupe saxagliptine 5 mg et de 6,1% (49/799) dans le groupe placebo.
5 En association initiale avec la metformine, la myalgie a été rapportée comme peu fréquente.
† Les effets indésirables ont été identifiés lors de la surveillance en post-commercialisation.
‡ Voir rubriques 4.3 et 4.4.
*Des arthralgies ont aussi été rapportées lors de la surveillance post-commercialisation (voir rubrique 4.4).
Résultats de l’étude SAVOR
L’étude SAVOR a inclus 8 240 patients traités par Onglyza 5 mg ou 2,5 mg une fois par jour et 8 173 patients recevant un placebo. L’incidence globale des événements indésirables survenus chez les patients traités par Onglyza dans cette étude a été similaire à celle observée avec le placebo (respectivement 72,5 % contre 72,2 %).
L’incidence des événements confirmés à type de pancréatite a été de 0,3 % à la fois chez les patients traités par Onglyza et chez ceux ayant reçu le placebo, dans la population des patients en intention de traiter.
L’incidence des réactions d’hypersensibilité a été de 1,1 % à la fois chez les patients traités par Onglyza et chez ceux ayant reçu le placebo.
L’incidence globale des épisodes d’hypoglycémie rapportés (enregistrés dans les carnets journaliers des patients) a été de 17,1 % chez les sujets traités par Onglyza et de 14,8 % chez les patients recevant le placebo. Le pourcentage de sujets ayant présenté en cours de traitement des événements à type d’hypoglycémie majeure (définie comme un événement nécessitant l’assistance d’une autre personne) dans le groupe de la saxagliptine a été supérieur à celui du groupe placebo (respectivement 2,1 % et 1,6 %). L’augmentation du risque d’hypoglycémie globale et d’hypoglycémie majeure observée dans le groupe traité par la saxagliptine a principalement touché les sujets traités par un sulfamide hypoglycémiant à l’inclusion, et non les sujets recevant de l’insuline ou de la metformine en monothérapie à l’inclusion. L’augmentation du risque d’hypoglycémie globale et majeure a été principalement observée chez les sujets présentant à l’inclusion une HbA1c < 7 %.
Une diminution du taux de lymphocytes a été rapportée chez 0,5 % des patients traités par Onglyza et chez 0,4 % des patients recevant le placebo.
Les hospitalisations pour insuffisance cardiaque sont survenues plus fréquemment dans le groupe de la saxagliptine (3,5 %) par rapport au groupe placebo (2,8 %), avec une signification statistique nominale en faveur du placebo (HR=1,27 ; [IC à 95 % : 1,07 ; 1,51] ; p=0,007). Voir aussi la rubrique 5.1.
Description d’effets indésirables sélectionnés
Hypoglycémie
Les effets indésirables d'hypoglycémie sont basés sur tous les cas d’hypoglycémie rapportés ; la mesure concomitante de la glycémie n’était pas requise.
Lorsqu’utilisé en association à la metformine et à un sulfamide hypoglycémiant, l’incidence globale des cas d’hypoglycémie rapportés était de 10,1 % pour Onglyza 5 mg et de 6,3 % pour le placebo.
Lorsqu’utilisé en association à l’insuline (avec ou sans metformine), l’incidence globale des cas d’hypoglycémies rapportés était de 18,4 % pour Onglyza 5 mg et de 19,9 % pour le placebo.
Investigations
Dans l'ensemble des études cliniques, l'incidence des événements indésirables biologiques a été similaire chez les patients traités par la saxagliptine 5 mg et chez les patients traités par placebo. Une légère diminution du nombre absolu de lymphocytes a été observée. Pour un nombre absolu moyen de lymphocytes avant traitement d’environ 2 200 cellules/µL, une diminution moyenne d’environ 100 cellules/µL a été observée comparativement au placebo dans une analyse poolée contrôlée versus placebo. Le nombre moyen de lymphocytes est resté stable lors d’une administration quotidienne allant jusqu’à 102 semaines. Les diminutions du nombre de lymphocytes n’ont pas été associées à des effets indésirables cliniquement significatifs. La significativité clinique de cette diminution du nombre de lymphocytes comparativement au placebo n’est pas connue.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance :
Site internet : www.notifieruneffetindesirable.be
e-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
AstraZeneca AB
SE-151 85 Södertälje
Suède
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
Onglyza 2,5 mg, comprimés pelliculés
EU/1/09/545/011 14 comprimés pelliculés (plaquette calendaire)
EU/1/09/545/012 28 comprimés pelliculés (plaquette calendaire)
EU/1/09/545/013 98 comprimés pelliculés (plaquette calendaire)
EU/1/09/545/014 30x1 (unidose) comprimés pelliculés
EU/1/09/545/015 90x1 (unidose) comprimés pelliculés
Onglyza 5 mg, comprimés pelliculés
EU/1/09/545/001 14 comprimés pelliculés
EU/1/09/545/002 28 comprimés pelliculés
EU/1/09/545/003 56 comprimés pelliculés
EU/1/09/545/004 98 comprimés pelliculés
EU/1/09/545/005 14 comprimés pelliculés (plaquette calendaire)
EU/1/09/545/006 28 comprimés pelliculés (plaquette calendaire)
EU/1/09/545/007 56 comprimés pelliculés (plaquette calendaire)
EU/1/09/545/008 98 comprimés pelliculés (plaquette calendaire)
EU/1/09/545/009 30x1 (unidose) comprimés pelliculés
EU/1/09/545/010 90x1 (unidose) comprimés pelliculés
10. DATE DE MISE À JOUR DU TEXTE
04/2024
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments: http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2677284 | ONGLYZA 5 MG COMP PELL 28 X 5 MG | A10BH03 | € 48,19 | - | Oui | - | - |
| 2677326 | ONGLYZA 5 MG COMP PELL 98 X 5 MG | A10BH03 | € 106,74 | - | Oui | - | - |
| 2806263 | ONGLYZA 2,5 MG COMP PELL 28 X 2,5 MG | A10BH03 | € 49,37 | - | Oui | - | - |