1. DÉNOMINATION DU MÉDICAMENT
FIRMAGON 80 mg poudre et solvant pour solution injectable
FIRMAGON 120 mg poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
FIRMAGON 80 mg poudre et solvant pour solution injectable
Chaque flacon contient 80 mg de dégarélix (sous forme d’acétate). Après reconstitution, chaque ml de solution contient 20 mg de dégarélix.
FIRMAGON 120 mg poudre et solvant pour solution injectable
Chaque flacon contient 120 mg de dégarélix (sous forme d’acétate). Après reconstitution, chaque ml de solution contient 40 mg de dégarélix.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable.
Poudre : poudre de couleur blanche à presque blanche.
Solvant : solution limpide, incolore.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
FIRMAGON est un antagoniste de l’hormone entraînant la libération de gonadotrophines (GnRH), indiqué :
- dans le traitement du cancer de la prostate avancé, hormono-dépendant, chez l’homme adulte;
- dans le traitement du cancer de la prostate hormono‑dépendant localisé à haut risque ou localement avancé en association avec une radiothérapie;
- en traitement néoadjuvant à une radiothérapie chez les patients présentant un cancer de la prostate hormono‑dépendant localisé à haut risque ou localement avancé.
4.2 Posologie et mode d’administration
Posologie
Initiation du traitement | Traitement d’entretien – administration mensuelle |
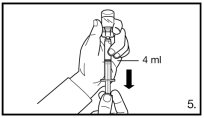
240 mg administrés en deux injections sous-cutanées consécutives de 120 mg chacune | 80 mg administrés en une injection sous-cutanée |
La première dose du traitement d’entretien doit être administrée 1 mois après la dose d’initiation du traitement.
FIRMAGON peut être administré en traitement néoadjuvant ou adjuvant à une radiothérapie dans le cancer de la prostate localisé à haut risque et localement avancé.
La réponse thérapeutique au dégarélix est évaluée par l’examen clinique et les dosages sanguins de l’antigène spécifique de la prostate (PSA). Les études cliniques ont montré que l’inhibition de la sécrétion de testostérone (T) débute immédiatement après l’administration de la dose d’initiation du traitement. Un taux sérique de testostérone correspondant à la castration médicale (T ≤ 0,5 ng/ml) est atteint trois jours après chez 96% des patients et un mois après, chez 100% des patients. Il a été montré qu’après 1 an de traitement à la dose d’entretien, la suppression de la sécrétion de testostérone (T ≤ 0,5 ng/ml) se maintenait chez 97% des patients.
En l’absence de réponse clinique optimale chez le patient, il faut s’assurer que le taux sérique de testostérone obtenu correspond bien à une suppression androgénique.
Le dégarélix n’induisant pas de pic de testostérone, il n’est pas nécessaire de prescrire un anti-androgène comme protection contre les pics lors de l’instauration du traitement.
Populations particulières
Patients âgés, insuffisants hépatiques ou insuffisants rénaux
Il n’est pas nécessaire d’ajuster la posologie chez les patients âgés ou atteints d’insuffisance hépatique ou rénale légère à modérée (voir rubrique 5.2). En l’absence de données chez des patients souffrant d’une insuffisance hépatique ou rénale sévère, la prudence s’impose (voir rubrique 4.4).
Population pédiatrique
Il n’y a pas d’utilisation justifiée de FIRMAGON chez l’enfant et l’adolescent dans le traitement du cancer de la prostate avancé hormono-dépendant.
Mode d’administration
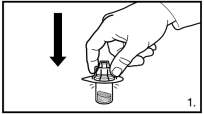
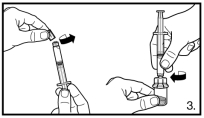
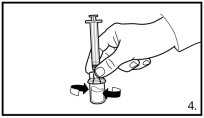
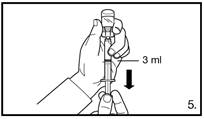
Avant l’administration, il faut procéder à la reconstitution de FIRMAGON. Pour les instructions de reconstitution et d’administration, voir rubrique 6.6.
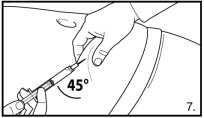
FIRMAGON doit être administré UNIQUEMENT par voie sous-cutanée. Ne pas administrer par voie intraveineuse.
En l’absence d’étude, l’administration par voie intramusculaire n’est pas recommandée.
L’administration de FIRMAGON s’effectue par injection sous-cutanée dans la région abdominale. Le site d’injection doit être modifié périodiquement. Les injections doivent être réalisées dans une partie du corps non exposée à la pression, par exemple à distance de la taille, de la ceinture ou des côtes.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profile de sécurité
Les événements indésirables les plus fréquemment observés au cours du traitement par dégarélix lors de l’étude pivot de phase III (N = 409) étaient des conséquences prévisibles des effets physiologiques de la suppression de la sécrétion de testostérone, dont les bouffées de chaleur et la prise de poids (rapportés respectivement chez 25% et 7% des patients traités pendant un an), ainsi que des réactions au site d’injection. La survenue transitoire, quelques heures après l’administration du traitement, de frissons, fièvre ou syndromes pseudo-grippaux, a été rapportée (chez respectivement 3%, 2% et 1% des patients).
Les principaux effets indésirables au site d’injection ont été une douleur et un érythème, rapportés respectivement chez 28% et 17% des patients. La survenue d’un gonflement (6%), d’une induration (4%) ou d’un nodule (3%) a été moins fréquemment rapportée. Ces événements sont survenus essentiellement à la phase d’initiation du traitement, alors que durant le traitement d’entretien (à la dose de 80 mg), l’incidence de ces événements a été, pour 100 injections, de 3 pour la douleur et < 1 pour la survenue d’un érythème, d’un gonflement, d’un nodule et d’une induration. Les événements rapportés ont été le plus souvent transitoires, d’intensité légère à modérée et n’ont conduit que très peu à l’arrêt du traitement (< 1%). De très rares cas de réactions graves au site d’injection ont été rapportés telles qu’une infection, un abcès ou une nécrose pouvant nécessiter un traitement chirurgical/un drainage.
Liste des effets indésirables
La fréquence des effets indésirables listés ci-dessous est définie selon la convention suivante :
très fréquent (≥ 1/10); fréquent (≥ 1/100, < 1/10); peu fréquent (≥ 1/1000, < 1/100), rare (≥ 1/10 000, < 1/1000) et très rare (< 1/10 000). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Tableau 1 : Fréquence des effets indésirables rapportés chez 1259 patients traités sur un total de 1781 patients-années (études de phases II et III) et issue des données après commercialisation
Classification systèmes – organes MedDRA (SOC) | Très fréquent | Fréquent | Peu fréquent | Rare |
Affections hématologiques et du système lymphatique |
| anémie* |
| neutropénie fébrile |
Affections du système immunitaire |
|
| hypersensibilité | réactions anaphylactiques |
Troubles du métabolisme et de la nutrition |
| prise de poids* | hyperglycémie/diabète sucré, augmentation du taux de cholestérol, perte de poids, perte d’appétit, modification de la calcémie |
|
Affections psychiatriques |
| insomnie | dépression, baisse de libido* |
|
Affections du système nerveux |
| vertiges, céphalées | ralentissement intellectuel, hypoesthésie |
|
Affections oculaires |
|
| vision trouble |
|
Affections cardiaques |
|
| arythmie cardiaque (y compris fibrillation auriculaire), palpitations, allongement du QT* (voir rubriques 4.4 et 4.5) | infarctus du myocarde, insuffisance cardiaque |
Affections vasculaires | bouffées de chaleur* |
| hypertension, réaction vasovagale (y compris hypotension) |
|
Affections respiratoires, thoraciques et médiastinales |
|
| dyspnée |
|
Affections gastro-intestinales |
| diarrhées, nausées | constipation, vomissements, douleur abdominale, gêne abdominale, sécheresse de la bouche |
|
Affections hépatobiliaires |
| augmentation des transaminases hépatiques | augmentation de la bilirubine, augmentation de la phosphatase alcaline |
|
Affections de la peau et du tissu sous-cutané |
| hyperhidrose (dont sueurs nocturnes)*, rash | urticaire, nodule cutané, alopécie, prurit, érythème |
|
Affections musculo-squelettiques et systémiques |
| douleur et gêne musculo-squelettiques | ostéoporose/ostéopénie, arthralgie, faiblesse musculaire, spasmes musculaires, gonflement/raideur des articulations | rhabdomyolyse |
Affections du rein et des voies urinaires |
|
| pollakiurie, mictions impérieuses, dysurie, nycturie, insuffisance rénale, incontinence |
|
Affections des organes de reproduction et du sein |
| gynécomastie*, atrophie testiculaire*, dysfonction érectile* | douleur testiculaire, douleur mammaire, douleur pelvienne, irritation génitale, trouble de l’éjaculation |
|
Troubles généraux et anomalies au site d’administration | réaction au site d’injection | frissons, fièvre, fatigue*, syndromes pseudo-grippaux | malaise, œdème périphérique |
|
* Conséquence physiologique connue de la suppression de la sécrétion de testostérone
Description de certains événements indésirables
Modifications des valeurs biologiques
Les modifications des valeurs biologiques observées au cours d’une année de traitement dans l’étude pivot de phase III (N = 409) ont été similaires avec les 2 produits : dégarélix et un agoniste à la GnRH (leuproréline) utilisé comme comparateur. Des valeurs des transaminases hépatiques (ALAT, ASAT et GGT) nettement anormales (> 3 fois la limite supérieure de la normale du laboratoire) étaient observées chez 2-6% des patients ayant des valeurs normales avant le traitement. Une diminution marquée de l’hématocrite (≤ 0,37) et du taux d’hémoglobine (≤ 115 g/l) a été observée chez respectivement 40% et 13 à 15% des patients ayant des valeurs normales avant le traitement. La part qui revient au cancer de la prostate sous‑jacent ou au traitement de suppression androgénique pour expliquer cette diminution des valeurs hématologiques n’est pas clairement définie. Chez les patients ayant des valeurs normales avant le traitement, des valeurs nettement anormales de kaliémie (≥ 5,8 mmol/l), de créatininémie (≥ 177 µmol/l) et d’urée sanguine (≥ 10,7 mmol/l) ont été observées respectivement chez 6%, 2% et 15% des patients traités par dégarélix et chez 3%, 2% et 14% des patients traités par leuproréline.
Modifications de l’électrocardiogramme
Les modifications observées à l’ECG au cours d’une année de traitement dans l’étude pivot de phase III (N = 409) ont été similaires avec les 2 produits : dégarélix et un agoniste à la GnRH (leuproréline) utilisé comme comparateur. Un QTcF ≥ 500 msec a été observé chez trois (< 1%) des 409 patients du groupe dégarélix et chez quatre (2%) des 201 patients du groupe leuproréline 7,5 mg. La médiane de modification du QTcF tout au long de l’étude a été de 12,0 msec avec le dégarélix et de 16,7 msec avec la leuproréline.
L’absence d’effets intrinsèques du dégarélix sur la repolarisation cardiaque (QTcF), le rythme cardiaque, la conduction auriculo-ventriculaire, la dépolarisation cardiaque, ou la morphologie de l’onde T ou de l’onde U a été confirmée dans une étude approfondie de l’intervalle QT chez des sujets sains (N = 80) ayant reçu une perfusion IV de dégarélix de 60 minutes, atteignant une Cmax de 222 ng/ml approximativement 3 à 4 fois la Cmax obtenue pendant le traitement du cancer de la prostate.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence Fédérale des Médicaments et des Produits de Santé, Division Vigilance
Avenue Galilée 5/03 | Boîte Postale 97 |
site internet : www.notifieruneffetindesirable.be – e-mail : adr@afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
Bâtiment de Biologie Moléculaire et de Biopathologie (BBB)
CHRU de Nancy – Hôpitaux de Brabois
Rue du Morvan
54 511 Vandœuvre-lès-Nancy Cedex
Tél. : (+33) 3 83 65 60 85 / 87
E-mail : crpv@chru-nancy.fr
ou
Direction de la Santé
Division de la Pharmacie et des Médicaments
20, rue de Bitbourg
L-1273 Luxembourg-Hamm
Tél. : (+352) 2478 5592
E-mail : pharmacovigilance@ms.etat.lu
Link pour le formulaire : https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Ferring Pharmaceuticals A/S, Amager Strandvej 405, 2770 Kastrup, Danemark
Tél : +45 88 33 88 34
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
FIRMAGON 80 mg poudre et solvant pour solution injectable
EU/1/08/504/001
EU/1/08/504/003
FIRMAGON 120 mg poudre et solvant pour solution injectable
EU/1/08/504/002
10. DATE DE MISE À JOUR DU TEXTE
03/2022.
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments (http://www.ema.europa.eu).
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2691202 | FIRMAGON 120 MG 2 FL INJ PULV + SER INJ SOL | L02BX02 | € 253,15 | - | Oui | - | - |