RESUME DES CARACTERISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
BRILIQUE 90 mg, comprimés pelliculés.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé pelliculé contient 90 mg de ticagrélor.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé (comprimé).
Comprimés ronds, biconvexes, jaunes portant la mention « 90 » au-dessus d’un « T » sur une face, l’autre face étant lisse.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Brilique, en association avec l’acide acétylsalicylique (AAS), est indiqué dans la prévention des événements athérothrombotiques chez les patients adultes ayant :
- un syndrome coronaire aigu (SCA) ou
- des antécédents d’infarctus du myocarde (IdM) et à haut risque de développer un événement athérothrombotique (voir rubriques 4.2 et 5.1).
4.2 Posologie et mode d’administration
Posologie
Les patients sous Brilique doivent également prendre une faible dose quotidienne d’AAS (75 à 150 mg) en traitement d’entretien, sauf contre-indication spécifique.
Syndromes coronaires aigus
Le traitement par Brilique doit être initié à une dose de charge unique de 180 mg (deux comprimés de 90 mg) puis poursuivi à la dose de 90 mg deux fois par jour. Le traitement par Brilique 90 mg administré deux fois par jour est recommandé pendant 12 mois chez les patients ayant présenté un SCA à moins que son arrêt soit cliniquement indiqué (voir rubrique 5.1).
L’arrêt de l’AAS peut être envisagé après 3 mois chez les patients ayant présenté un SCA, traités par une intervention coronarienne percutanée (ICP) et présentant un risque accru de saignement. Dans ce cas, le ticagrélor en monothérapie antiplaquettaire doit être poursuivi pendant 9 mois (voir rubrique 4.4).
Antécédents d’infarctus du myocarde
Brilique 60 mg administré deux fois par jour est la dose recommandée lorsque la prolongation du traitement est nécessaire chez les patients ayant des antécédents d’infarctus du myocarde datant d’au moins un an et à haut risque de développer un évènement athérothrombotique (voir rubrique 5.1). Le traitement peut être initié sans interruption en continuité du traitement initial d’un an par Brilique 90 mg ou par un autre inhibiteur du récepteur de l’adénosine diphosphate (ADP) chez les patients ayant un SCA avec un haut risque de développer un évènement athérothrombotique. Le traitement peut également être initié jusqu’à 2 ans après l’infarctus du myocarde ou dans l’année suivant l’arrêt du traitement précédent par un inhibiteur de l’ADP. Les données sur l’efficacité et la sécurité d’emploi du ticagrélor au-delà d'une prolongation du traitement de 3 ans sont limitées.
Si un changement de traitement est nécessaire, la première dose de Brilique doit être administrée dans les 24 heures suivant la dernière dose de l’autre antiagrégant plaquettaire.
Oublis de doses
Les oublis de doses doivent également être évités. En cas d’oubli d’une dose de Brilique, le patient ne doit prendre qu’un seul comprimé, à l’heure de sa prise habituelle suivante (dose prévue suivant l’oubli).
Populations particulières
Sujets âgés
Aucun ajustement posologique n’est nécessaire chez le sujet âgé (voir rubrique 5.2).
Insuffisance rénale
Aucun ajustement posologique n’est nécessaire chez l’insuffisant rénal (voir rubrique 5.2).
Insuffisance hépatique
Le ticagrélor n’a pas été étudié chez les patients présentant une insuffisance hépatique sévère, et donc son utilisation est contre-indiquée chez ces patients (voir rubrique 4.3). Seules des informations limitées sont disponibles pour les patients présentant une insuffisance hépatique modérée. Aucun ajustement posologique n’est recommandé, mais le ticagrélor doit être utilisé avec prudence (voir rubriques 4.4 et 5.2). Aucun ajustement posologique n’est nécessaire chez les patients présentant une insuffisance hépatique légère (voir rubrique 5.2).
Population pédiatrique
La sécurité d’emploi et l’efficacité du ticagrélor chez les enfants âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Il n'y a pas d'utilisation justifiée du ticagrélor chez les enfants atteints de drépanocytose (voir rubriques 5.1 et 5.2).
Mode d’administration
Voie orale.
Brilique peut être administré au cours ou en dehors des repas. Pour les patients qui ne sont pas capables d’avaler le(s) comprimé(s) en entier, les comprimés peuvent être écrasés en une poudre fine et mélangés dans un demi-verre d’eau et bus immédiatement. Le verre doit être rincé avec un peu plus d’un demi-verre d’eau et le contenu doit être bu. Le mélange peut également être administré via une sonde naso-gastrique (CH8 ou plus). Il est important de nettoyer la sonde naso-gastrique en y faisant passer de l’eau après administration du mélange.
4.3 Contre-indications
- Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 (voir rubrique 4.8)
- Saignement pathologique en cours
- Antécédent d’hémorragie intracrânienne (voir rubrique 4.8)
- Insuffisance hépatique sévère (voir rubriques 4.2, 4.4 et 5.2)
- L’administration concomitante de ticagrélor avec de puissants inhibiteurs du CYP3A4 (par exemple kétoconazole, clarithromycine, néfazodone, ritonavir et atazanavir), en raison du fait qu’elle peut entraîner une augmentation substantielle de l’exposition au ticagrélor (voir rubrique 4.5).
4.8 Effets indésirables
Résumé du profil de sécurité d’emploi
Le profil de sécurité d’emploi du ticagrélor a été évalué lors de deux essais cliniques de phase 3 à grande échelle (PLATO et PEGASUS) ayant inclus plus de 39 000 patients (voir rubrique 5.1).
Dans l’étude PLATO, l’incidence des arrêts dus à des événements indésirables a été plus élevée chez les patients sous ticagrélor que sous clopidogrel (7,4 % vs 5,4 %). Dans l’étude PEGASUS, l’incidence des arrêts dus à des événements indésirables a été plus élevée chez les patients sous ticagrélor que sous AAS en monothérapie (16,1 % pour le ticagrélor 60 mg avec AAS vs 8,5 % pour l’AAS en monothérapie). Les effets indésirables les plus fréquemment rapportés chez les patients traités par le ticagrélor ont été des cas de saignements et de dyspnées (voir rubrique 4.4).
Liste tabulée des effets indésirables
Les effets indésirables suivants ont été identifiés lors des études ou ont été rapportés lors de l’utilisation post‑commercialisation du ticagrélor (Tableau 1).
Les effets indésirables sont présentés selon la classification par système d’organes (SOC) de MedDRA. Au sein de chaque SOC, les effets indésirables sont classés par catégories de fréquence et présentés par ordre décroissant de gravité. Les catégories de fréquence sont définies selon les conventions suivantes : très fréquent (≥1/10), fréquent (≥1/100 à <1/10), peu fréquent (≥1/1 000 à <1/100), rare (≥1/10 000 à <1/1 000), très rare (<1/10 000), indéterminée (ne peut pas être estimé sur la base des données disponibles).
Tableau 1 - Effets indésirables par fréquence et classe de système d'organes (SOC)
SOC | Très fréquent | Fréquent | Peu fréquent | Fréquence indéterminée |
Tumeurs bénignes, malignes et non précisées (incl. kystes et polypes) |
|
| Saignements d’une tumeura |
|
Affections hématologiques et du système lymphatique | Saignements dus à des troubles hématologiquesb |
|
| Purpura thrombotique thrombocytopéniquec |
Affections du système immunitaire |
|
| Hypersensibilité incluant angio-œdèmec |
|
Troubles du métabolisme et de la nutrition | Hyperuricémied | Goutte/ Arthrite goutteuse |
|
|
Affections psychiatriques |
|
| Confusion |
|
Affections du système nerveux |
| Sensation vertigineuse, syncope, céphalée | Hémorragie intracrâniennem |
|
Affections oculaires |
|
| Hémorragie de l'œile |
|
Affections de l’oreille et du labyrinthe |
| Vertige | Otorragie |
|
Affections cardiaques |
|
|
| Bradyarythmie, |
Affections vasculaires |
| Hypotension |
|
|
Affections respiratoires, thoraciques et médiastinales | Dyspnée | Saignement de l’appareil respiratoiref |
|
|
Affections gastro-intestinales |
| Hémorragie gastro-intestinaleg, Diarrhée, Nausée, Dyspepsie, Constipation | Hémorragie rétropéritonéale |
|
Affections de la peau et du tissu sous-cutané |
| Saignement sous-cutané ou dermiqueh, Rash, Prurit |
|
|
Affections du tissu musculo-squelettique systémique et os |
|
| Saignement musculairei |
|
Affections du rein et des voies urinaires |
| Saignement des voies urinairesj |
|
|
Affections des organes de reproduction et du sein |
|
| Saignement des organes de la reproductionk |
|
Investigations |
| Créatinine sanguine augmentéed |
|
|
Lésions, intoxications et complications liées aux procédures |
| Hémorragie post intervention, Saignement traumatiquel |
|
|
a par exemple saignement dû à un cancer de la vessie, de l’estomac ou du côlon
b par exemple augmentation de la tendance aux ecchymoses, hématomes spontanés, diathèses hémorragiques
c identifié dans le cadre de l’expérience post-commercialisation
d fréquences provenant de résultats d’analyses (augmentation de l’acide urique > limite supérieure de la normale à partir d’une valeur initiale inférieure à l’intervalle de référence ou dans celui-ci. Augmentation de la créatinine > 50 % de la valeur initiale) et non fréquence brute des notifications de l’événement indésirable.
e par exemple saignement conjonctival, rétinien, intraoculaire
f par exemple épistaxis, hémoptysie
g par exemple gingivorragie, rectorragie, hémorragie d'un ulcère gastrique
h par exemple ecchymose, hémorragie cutanée, pétéchies
i par exemple hémarthrose, hémorragie musculaire
j par exemple hématurie, cystite hémorragique
k par exemple hémorragie vaginale, hémospermie, hémorragie post-ménopausique
l par exemple contusion, hématome traumatique, hémorragie traumatique
m c’est-à-dire une hémorragie intracrânienne spontanée, liée à une intervention ou traumatique
Description d’effets indésirables sélectionnés
Saignements
Observations relatives aux saignements lors de l’étude PLATO
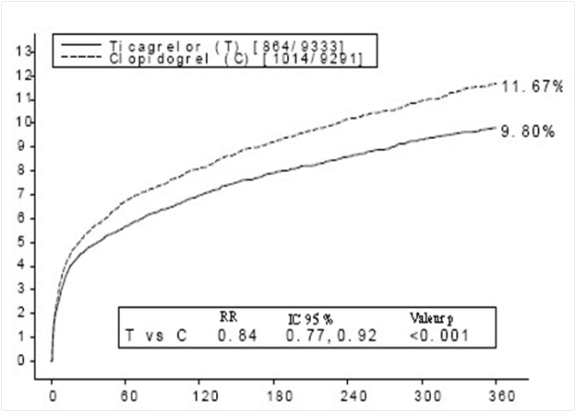
Le Tableau 2 présente l’évolution globale des taux de saignements dans l’étude PLATO.
Tableau 2 – Analyse des événements hémorragiques totaux, estimations de Kaplan-Meier à 12 mois (PLATO)
| Ticagrélor 90 mg deux fois par jour | Clopidogrel | |
Total Majeurs, définition PLATO | 11,6 | 11,2 | 0,4336 |
Majeurs Fatals/Engageant le pronostic vital, définition PLATO | 5,8 | 5,8 | 0,6988 |
Majeurs non liés à un PAC, définition PLATO | 4,5 | 3,8 | 0,0264 |
Majeurs non liés à une procédure, définition PLATO | 3,1 | 2,3 | 0,0058 |
Total Majeurs + Mineurs, définition PLATO | 16,1 | 14,6 | 0,0084 |
Majeurs + Mineurs non liés à une procédure, définition PLATO | 5,9 | 4,3 | <0,0001 |
Majeurs, définition TIMI | 7,9 | 7,7 | 0,5669 |
Majeurs + Mineurs, définition TIMI | 11,4 | 10,9 | 0,3272 |
Définitions des catégories de saignements :
Saignements Majeurs, Fatals, Engageant le pronostic vital : Cliniquement évidents avec une perte de plus de 50 g/L d’hémoglobine ou la transfusion d’au moins 4 culots globulaires ; ou fatals ; ou intracrâniens ; ou intrapéricardiques avec tamponnade cardiaque ; ou avec choc hypovolémique ou hypotension sévère nécessitant une intervention chirurgicale ou le recours à des vasopresseurs.
Autres Majeurs : Cliniquement évidents avec une perte de 30 à 50 g/L d’hémoglobine ou la transfusion de 2 à 3 culots globulaires ; ou entraînant un handicap significatif.
Saignements Mineurs : Nécessitent un acte médical pour arrêter ou traiter le saignement.
Saignements Majeurs, définition TIMI : Cliniquement évidents avec une diminution de plus de 50 g/L d’hémoglobine ou saignement intracrânien.
Saignements mineurs, définition TIMI : Cliniquement évidents avec une diminution de 30 à 50 g/L d’hémoglobine.
* Valeur de p calculée à partir d’un modèle à risques proportionnels de Cox avec le groupe de traitement à titre de seule variable explicative.
Dans l’étude PLATO, la fréquence de survenue des saignements « majeurs fatals/engageant le pronostic vital », « Total Majeurs » selon le critère PLATO, TIMI Majeurs et TIMI mineurs n’était pas différent entre le ticagrélor et le clopidogrel (Tableau 2). Cependant, il est survenu plus de saignements majeurs et mineurs suivant la définition PLATO sous ticagrélor que sous clopidogrel. Dans l’étude PLATO, il y a eu peu de saignements fatals : 20 (0,2 %) pour ticagrélor et 23 (0,3 %) sous clopidogrel (voir rubrique 4.4).
Aucun des facteurs suivants, âge, sexe, poids, origine ethnique, origine géographique, maladies associées, traitements associés, antécédents médicaux incluant les accidents vasculaires cérébraux et les accidents ischémiques transitoires, n’a permis de prédire les saignements globaux ou les saignements majeurs (définition PLATO) non liés à une procédure interventionnelle. Il n’y a donc pas de sous-groupe identifié comme à risque de quelque forme de saignement que ce soit.
Saignements liés à un pontage aorto-coronaire :
Dans l’étude PLATO, 1584 patients (12 % de la cohorte) ont eu un pontage aorto-coronaire (PAC) et 42 % d’entre eux ont eu un saignement majeur fatal ou engageant le pronostic vital selon le critère PLATO sans différence entre les groupes de traitement. Des saignements fatals liés à un pontage aorto-coronaire sont survenus chez 6 patients dans chaque groupe de traitement (voir rubrique 4.4).
Saignements non liés à un pontage aorto-coronaire ou à une procédure :
Le ticagrélor et le clopidogrel ne sont pas différents en termes de saignements définis comme majeurs fatals ou engageant le pronostic vital chez les malades non pontés, mais les saignements définis comme « total majeurs » selon le critère (PLATO), TIMI majeurs et TIMI majeurs et mineurs étaient plus fréquents avec le ticagrélor. De même, lorsqu’on exclut tous les saignements en rapport avec une procédure, davantage de saignements sont survenus sous ticagrélor que sous clopidogrel (tableau 2). Les arrêts de traitement liés à des saignements non liés à une procédure ont été plus fréquents sous ticagrélor (2,9 %) que sous clopidogrel (1,2 % ; p<0,001).
Saignements intracrâniens :
Il y a plus de saignements intracrâniens non reliés à une procédure dans le groupe ticagrélor (n=27 saignements chez 26 patients, 0,3 %) que dans le groupe clopidogrel (n=14 saignements, 0,2 %), avec onze saignements fatals sous ticagrélor contre un sous clopidogrel. Il n’y pas eu de différence sur la totalité des hémorragies fatales.
Observations relatives aux saignements lors de l’étude PEGASUS
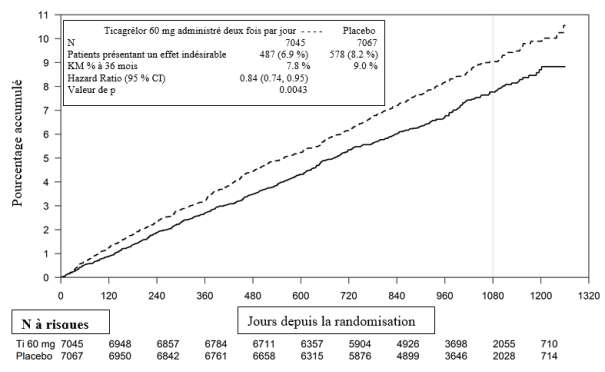
Le Tableau 3 présente l’évolution globale des taux de saignements dans l’étude PEGASUS.
Tableau 3 – Analyse des événements hémorragiques totaux, estimations de Kaplan-Meier à 36 mois (étude PEGASUS)
| Ticagrélor 60 mg deux fois par jour + AAS | AAS en monothérapie N = 6996 |
| |
| | Risque relatif | | |
Catégories de saignements, définitions TIMI | ||||
TIMI Majeurs | 2,3 | 2,32 | 1,1 | <0,0001 |
Fatals | 0,3 | 1,00 | 0,3 | 1,0000 |
HIC | 0,6 | 1,33 | 0,5 | 0,3130 |
Autres Majeurs, définition TIMI | 1,6 | 3,61 | 0,5 | <0,0001 |
Majeurs ou Mineurs, définition TIMI | 3,4 | 2,54 | 1,4 | <0,0001 |
Majeurs ou Mineurs, définition TIMI, nécessitant une action médicale | 16,6 | 2,64 | 7,0 | <0,0001 |
Catégories de saignements, définitions PLATO | ||||
Majeurs, définition PLATO | 3,5 | 2,57 | 1,4 | <0,0001 |
Fatals/Engageant le pronostic vital | 2,4 | 2,38 | 1,1 | <0,0001 |
Autres Majeurs, définition PLATO | 1,1 | 3,37 | 0,3 | <0,0001 |
Majeurs ou Mineurs, définition PLATO | 15,2 | 2,71 | 6,2 | <0,0001 |
Définitions des catégories de saignements :
Majeurs TIMI : Saignement fatal OU tout saignement intracrânien, OU signes cliniquement évidents d’hémorragie avec une diminution de l’hémoglobinémie (Hb) ≥ 50 g/L, ou, si Hb non disponible, diminution de l’hématocrite (Hct) de 15 %.
Fatal : Événement hémorragique aboutissant directement au décès dans les 7 jours.
HIC : Hémorragie intracrânienne.
Autres Majeurs, définition TIMI : Saignements Majeurs non-fatals non-HIC, définition TIMI.
Mineurs, définition TIMI : Cliniquement évidents avec une diminution de 30 à 50 g/L de l’hémoglobinémie.
Nécessitant une action médicale, définition TIMI : Nécessitant une intervention, OU entraînant une hospitalisation, OU suscitant une évaluation.
Majeurs Fatals/Engageant le pronostic vital, définition PLATO : Saignements fatals, OU tout saignement intracrânien, OU intrapéricardiques avec tamponnade cardiaque OU avec choc hypovolémique ou hypotension sévère nécessitant le recours à des vasopresseurs/inotropes ou une intervention chirurgicale OU cliniquement apparents avec diminution > 50 g/dL de l’hémoglobinémie ou transfusion de ≥ 4 culots globulaires.
Autres Majeurs, définition PLATO : Entraînant un handicap significatif, OU cliniquement évidents avec une perte de 30 à 50 g/L d’hémoglobine OU la transfusion de 2 à 3 culots globulaires.
Mineurs, définition PLATO : Nécessitent un acte médical pour arrêter ou traiter le saignement.
Dans l’étude PEGASUS, les hémorragies majeures (définition TIMI) ont été plus fréquentes sous ticagrélor 60 mg administré deux fois par jour que sous AAS en monothérapie. Aucune augmentation du risque hémorragique n’a été observée pour les saignements fatals, et seule une augmentation mineure a été observée pour les hémorragies intracrâniennes comparativement à l'AAS en monothérapie. Quelques événements hémorragiques fatals sont survenus au cours de l’étude, 11 (0,3 %) pour le ticagrélor 60 mg et 12 (0,3 %) pour l’AAS en monothérapie. L'augmentation observée du risque de saignements majeurs TIMI avec le ticagrélor 60 mg a été principalement due à une fréquence plus élevée des autres saignements majeurs TIMI, liés à des événements gastro-intestinaux.
Des augmentations des profils de saignements similaires aux saignements majeurs TIMI ont été observées pour les catégories de saignements majeurs ou mineurs TIMI, majeurs PLATO et majeurs ou mineurs PLATO (voir Tableau 3). L’arrêt du traitement en raison de saignements a été plus fréquent avec le ticagrélor 60 mg qu’avec l’AAS en monothérapie (respectivement 6,2 % et 1,5 %). La majorité de ces saignements a été de moindre sévérité (nécessitant un acte médical selon la définition TIMI), par exemple épistaxis, ecchymose et hématomes.
Le profil des saignements sous ticagrélor 60 mg a été constant sur plusieurs sous-groupes prédéfinis (par exemple par âge, sexe, poids, origine ethnique, région géographique, pathologies concomitantes, traitement concomitant et antécédents médicaux) pour les saignements majeurs TIMI, majeurs ou mineurs TIMI et majeurs PLATO.
Saignements intracrâniens :
Des HIC spontanées ont été rapportées à des taux similaires pour le ticagrélor 60 mg et l’AAS en monothérapie (n=13, 0,2 % dans les deux groupes de traitement). La fréquence des HIC d’origine traumatique ou dues à une procédure a été légèrement plus élevée avec le ticagrélor 60 mg (n=15, 0,2 %) qu'avec l'AAS en monothérapie (n=10, 0,1 %). Six HIC fatales sont survenues avec le ticagrélor 60 mg et 5 avec l’AAS en monothérapie. L’incidence des saignements intracrâniens a été faible dans les deux groupes de traitement, étant donné les comorbidités significatives et les facteurs de risque cardiovasculaire dans la population étudiée.
Dyspnée
Des dyspnées, une sensation d’essoufflement, ont été rapportées par les patients traités par le ticagrélor. Dans l’étude PLATO, des événements indésirables (EI) de type dyspnée (dyspnée, dyspnée de repos, dyspnée à l’effort, dyspnée paroxystique nocturne et dyspnée nocturne), lorsque combinés, étaient rapportés chez 13,8 % des patients traités par ticagrélor contre 7,8 % des patients traités par clopidogrel. Chez environ 2,2 % des patients traités par ticagrélor et 0,6 % des patients traités par clopidogrel, les investigateurs ont considéré que ces dyspnées étaient reliées au traitement dans l’étude PLATO et que peu étaient graves (0,14 % ticagrélor ; 0,02 % clopidogrel), (voir rubrique 4.4). La plupart des événements indésirables de type dyspnée étaient d’intensité légère à modérée, et la plupart étaient des épisodes uniques survenant peu de temps après le début du traitement.
Par rapport à clopidogrel, les patients présentant un asthme/une BPCO traités avec le ticagrélor peuvent présenter une augmentation du risque de survenue de dyspnée non grave (3,29 % sous ticagrélor versus 0,53 % sous clopidogrel) et de dyspnée grave (0,38 % sous ticagrélor versus 0,00 % sous clopidogrel). En termes absolus, ce risque était plus élevé que dans la population totale de PLATO. Le ticagrélor doit être utilisé avec précaution chez les patients ayant des antécédents d’asthme et/ou de BPCO (voir rubrique 4.4).
Environ 30 % des épisodes dyspnéiques ont disparu en moins de 7 jours. L’étude PLATO a inclus des patients ayant une insuffisance cardiaque congestive (ICC), une BPCO ou un asthme connus ; ces patients et les sujets âgés étaient les plus susceptibles de rapporter une dyspnée. Le nombre de patients arrêtant le traitement en raison de l’apparition d’une dyspnée était plus élevé sous ticagrélor (0, 9 %) que sous clopidogrel (0,1 %). La fréquence plus élevée de dyspnée sous ticagrélor n’est pas associée à l’apparition ou l’aggravation d’une pathologie cardiaque ou pulmonaire (voir rubrique 4.4). Le ticagrélor ne modifie pas les explorations fonctionnelles respiratoires.
Dans l’étude PEGASUS, des dyspnées ont été rapportées chez 14,2 % des patients traités par 60 mg de ticagrélor administré deux fois par jour et chez 5,5 % de patients traités par AAS en monothérapie. Comme dans l’étude PLATO, les cas de dyspnée rapportés ont été le plus souvent d’intensité légère à modérée (voir rubrique 4.4). Les patients ayant rapportés une dyspnée avaient tendance à être plus âgés et avaient plus fréquemment présenté une dyspnée, une ICC, une BPCO ou un asthme à l’inclusion.
Investigations
Augmentation de l’acide urique : dans l’étude PLATO, l’uricémie a dépassé la limite supérieure de la normale chez 22 % des patients recevant le ticagrélor contre 13 % des patients recevant le clopidogrel. Les proportions correspondantes dans l’étude PEGASUS ont été de 9,1 %, 8,8 % et 5,5 % respectivement pour le ticagrélor 90 mg, le ticagrélor 60 mg et le placebo. L’uricémie moyenne a augmenté d’environ 15 % sous ticagrélor, contre environ 7,5 % sous clopidogrel, et après l’arrêt du traitement une diminution d’environ 7 % a été observée sous ticagrélor mais pas de diminution observée sous clopidogrel. Dans l’étude PEGASUS, une augmentation transitoire de l’uricémie moyenne de 6,3 % et 5,6 % a été observée respectivement sous ticagrélor 90 mg et 60 mg, comparativement à une diminution de 1,5 % dans le groupe placebo. Dans l’étude PLATO, la fréquence de survenue d’une arthrite goutteuse était de 0,2 % pour le ticagrélor contre 0,1 % pour le clopidogrel. Les proportions correspondantes pour la goutte/l'arthrite goutteuse dans l’étude PEGASUS ont été de 1,6 %, 1,5 % et 1,1 % respectivement pour le ticagrélor 90 mg, le ticagrélor 60 mg et le placebo.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance :
Site internet : www.notifieruneffetindesirable.be
e-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
AstraZeneca AB
SE-151 85
Södertälje
Suède
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
EU/1/10/655/001-006
10. DATE DE MISE A JOUR DU TEXTE
09/2024
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2789691 | BRILIQUE 90MG COMP PELL 56 X 90MG | B01AC24 | € 51,75 | - | Oui | - | - |
| 2789717 | BRILIQUE 90MG COMP PELL 168 X 90MG | B01AC24 | € 140 | - | Oui | - | - |