RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
Humalog Mix25 100 unités/mL suspension injectable en flacon
Humalog Mix25 100 unités/mL suspension injectable en cartouche
Humalog Mix25 100 unités/mL KwikPen suspension injectable en stylo pré-rempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque mL contient 100 unités d’insuline lispro* (équivalent à 3,5 mg).
Humalog Mix25 contient 25 % d'insuline lispro en solution et 75 % d'insuline lispro protamine en suspension.
Flacon
Chaque flacon contient 1000 unités d’insuline lispro dans 10 mL de suspension.
Cartouche
Chaque cartouche contient 300 unités d’insuline lispro dans 3 mL de suspension.
KwikPen
Chaque stylo pré-rempli contient 300 unités d’insuline lispro dans 3 mL de suspension.
Chaque stylo KwikPen délivre de 1 à 60 unités par paliers de 1 unité.
*Produite par E. Coli par la technique de l’ADN recombinante.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Suspension injectable.
Suspension blanche.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
Humalog Mix25 est indiqué pour le traitement des patients atteints de diabète nécessitant un traitement par insuline pour maintenir un équilibre glycémique normal.
4.2 Posologie et mode d'administration
Posologie
La dose est déterminée par le médecin, selon les besoins du patient.
Humalog Mix25 peut être administré peu de temps avant les repas. Quand cela est nécessaire, Humalog Mix25 peut être administré juste après les repas. Humalog Mix25 doit être administré par injection sous-cutanée stricte. En aucun cas Humalog Mix25 ne doit être administré par voie intraveineuse.
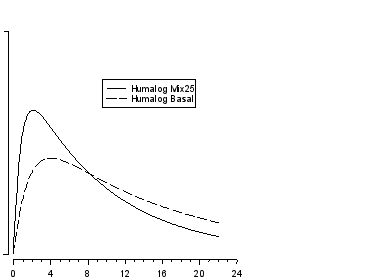
La rapidité d'action et le pic d'activité précoce propres à Humalog lui-même sont observés après l'administration sous-cutanée d'Humalog Mix25. Ceci permet d'administrer une injection d'Humalog Mix25 à un moment proche des repas. La durée d'action de la composante insuline lispro protamine en suspension dans Humalog Mix25 est proche de celle d'une insuline basale (isophane).
L’évolution dans le temps de l’action de toute insuline peut varier de façon importante d'un sujet à un autre, ou à différents moments chez le même sujet. Comme pour toutes les préparations d'insuline, la durée d'action d'Humalog Mix25 dépend de la dose, du site d'injection, de la vascularisation, de la température et de l'activité physique.
Populations particulières
Insuffisance rénale
Les besoins en insuline peuvent diminuer en présence d'une insuffisance rénale.
Insuffisance hépatique
Les besoins en insuline peuvent diminuer chez les patients présentant une insuffisance hépatique du fait d’une diminution de la capacité de la gluconéogenèse et de la diminution de l’élimination de l’insuline ; cependant, chez les patients ayant une insuffisance hépatique chronique, l’augmentation de l’insulinorésistance peut conduire à une augmentation des besoins en insuline.
Population pédiatrique
L’administration d’Humalog Mix25 aux enfants de moins de 12 ans doit être envisagée uniquement dans le cas d’un bénéfice attendu par rapport à l’insuline rapide.
Mode d’administration
L'administration sous-cutanée doit être effectuée dans les bras, les cuisses, les fesses ou l'abdomen. Il est nécessaire de varier les points d’injection afin de ne pas utiliser le même point d'injection plus d'une fois par mois environ afin de diminuer le risque de développer une lipodystrophie ou une amyloïdose cutanée (voir rubriques 4.4 et 4.8).
Lors de l'injection sous-cutanée d'Humalog Mix25, s'assurer que l'aiguille n'a pas pénétré dans un vaisseau sanguin. Après injection, ne pas masser le point d'injection. Les patients doivent être éduqués pour utiliser une technique d’injection correcte.
KwikPen
Le stylo KwikPen délivre de 1 à 60 unités en une seule injection, par paliers de 1 unité. La dose nécessaire est sélectionnée en unités. Le nombre d’unités s’affiche dans la fenêtre de lecture du stylo.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Hypoglycémie.
4.8 Effets indésirables
Résumé du profil de sécurité
L'hypoglycémie est l'effet indésirable le plus fréquent lors du traitement par insuline chez le patient diabétique. L'hypoglycémie sévère peut entraîner la perte de connaissance allant, dans des cas extrêmes, jusqu'à la mort. L’hypoglycémie pouvant résulter à la fois d’un excès d’insuline et d’autres facteurs tels que l’apport alimentaire et la dépense énergétique, aucune fréquence de survenue des hypoglycémies ne peut être présentée.
Liste tabulée des effets indésirables
Les effets indésirables rapportés lors des études cliniques sont repris ci-dessous, selon les termes de la classification MedDRA, par classes de systèmes d’organes et dans l’ordre décroissant des fréquences de survenue (très fréquent : ≥ 1/10 ; fréquent : ≥ 1/100, < 1/10 ; peu fréquent : ≥ 1/1000, < 1/100 ; rare : ≥ 1/10 000, < 1/1000 ; très rare : < 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Classes de systèmes | Très fréquent | Fréquent | Peu fréquent | Rare | Très rare | Fréquence indéterminée |
Affections du système immunitaire |
| |||||
Allergie locale |
| X |
|
|
|
|
Allergie générale |
|
|
| X |
|
|
Affections de la peau et du tissu sous-cutané |
| |||||
Lipodystrophie |
|
| X |
|
|
|
Amyloïdose cutanée |
|
|
|
|
| X |
Description d’effets indésirables sélectionnés
Allergie locale
L’allergie locale est fréquente. Une rougeur, un œdème et des démangeaisons peuvent survenir au point d'injection. Cette réaction, habituellement, disparaît en quelques jours voire quelques semaines. Dans certains cas, cette réaction peut être liée à des facteurs autres que l'insuline, tels que des produits irritants contenus dans le désinfectant cutané ou une mauvaise technique d'injection.
Allergie générale
L'allergie générale, qui est rare mais potentiellement plus grave, correspond à une généralisation de l'allergie à l'insuline. Elle peut entraîner une éruption généralisée sur tout le corps, une dyspnée, une respiration sifflante, une baisse de la pression artérielle, une accélération du pouls ou une transpiration. Les cas sévères d'allergie généralisée peuvent menacer le pronostic vital.
Affections de la peau et du tissu sous-cutané
Une lipodystrophie et une amyloïdose cutanée peuvent survenir au site d’injection, ce qui peut retarder la résorption locale de l’insuline. Une rotation continue des sites d’injection dans une zone donnée peut aider à diminuer ou à éviter ces réactions (voir rubrique 4.4).
Oedèmes
Des cas d’œdèmes ont été rapportés lors du traitement par insuline, en particulier si un mauvais contrôle métabolique précédent est amélioré par une insulinothérapie intensifiée.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique :
Agence fédérale des médicaments et des produits de santé, Division Vigilance, Boîte Postale 97, B- 1000 Bruxelles Madou, Site internet: www.notifieruneffetindesirable.be, e-mail: adr@afmps.be.
Luxembourg :
Centre Régional de Pharmacovigilance de Nancy, Bâtiment de Biologie Moléculaire et de Biopathologie (BBB), CHRU de Nancy – Hôpitaux de Brabois, Rue du Morvan, 54 511 VANDOEUVRE LES NANCY CEDEX, Tél : (+33) 3 83 65 60 85 / 87, E-mail : crpv@chru-nancy.fr ou Direction de la Santé, Division de la Pharmacie et des Médicaments, 20, rue de Bitbourg, L-1273 Luxembourg-Hamm, Tél. : (+352) 2478 5592, E-mail : pharmacovigilance@ms.etat.lu. Link pour le formulaire :
https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Pays-Bas.
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/96/007/005
EU/1/96/007/008
EU/1/96/007/024
EU/1/96/007/033
EU/1/96/007/034
10. DATE DE MISE A JOUR DU TEXTE
03 septembre 2020.
STATUT LEGAL DE DELIVRANCE Médicament soumis à prescription médicale.
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2667863 | HUMALOG MIX 25 100U/ML KWIKPEN | A10AD04 | € 41,2 | - | Oui | - | - |