RESUME DES CARACTERISTIQUES DU PRODUIT
(12/2024)
1. DÉNOMINATION DU MÉDICAMENT
Spiriva® Respimat® 2,5 microgrammes, solution à inhaler
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
La quantité de tiotropium délivrée par bouffée est de 2,5 microgrammes (deux bouffées correspondant à une dose médicamenteuse) et est équivalente à 3,124 microgrammes de bromure de tiotropium monohydraté.
La dose délivrée est celle disponible pour le patient après passage à travers l'embout buccal du dispositif.
Excipient à effet notoire : ce médicament contient 0,0011 mg de chlorure de benzalkonium par bouffée.
Pour la liste complète des excipients, voir rubrique 6.1
3. FORME PHARMACEUTIQUE
Solution à inhaler
Solution à inhaler limpide et incolore
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
BPCO
Spiriva Respimat est indiqué comme traitement bronchodilatateur continu destiné à soulager les symptômes des patients présentant une bronchopneumopathie chronique obstructive (BPCO).
Asthme
Spiriva Respimat est indiqué en traitement bronchodilatateur additionnel continu chez des patients de 6 ans et plus atteints d’asthme sévère ayant présenté au cours de l’année précédente une ou plusieurs exacerbations sévères (voir rubriques 4.2 et 5.1).
4.2 Posologie et mode d’administration
Posologie
Le médicament est destiné à la voie inhalée exclusivement. La cartouche ne peut être utilisée qu’avec le dispositif d’inhalation Respimat (voir rubrique 4.2).
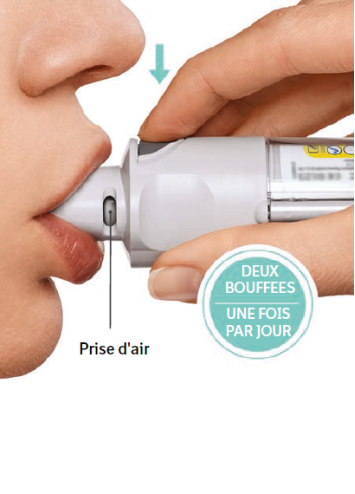
Deux bouffées délivrées par l’inhalateur Respimat constituent une dose médicamenteuse.
La posologie recommandée chez l’adulte est de 5 microgrammes de tiotropium, soit deux bouffées consécutives, administrées à l’aide de l’inhalateur Respimat une fois par jour, à heure fixe.
Ne pas dépasser la dose recommandée.
Dans le traitement de l’asthme, le bénéfice complet n’apparaîtra qu’après l’administration de plusieurs doses du médicament. Chez les patients adultes atteints d’asthme sévère, le tiotropium doit être utilisé en association à un corticostéroïde inhalé (CSI) (≥ 800 µg de budésonide/jour ou équivalent) et au moins un traitement de contrôle.
Populations particulières
Sujets âgés: le bromure de tiotropium peut être utilisé chez les sujets âgés sans adaptation de la posologie.
Insuffisance rénale: en cas d’insuffisance rénale, le bromure de tiotropium peut être utilisé sans adaptation de la posologie. En cas d’insuffisance rénale modérée à sévère (clairance de la créatinine 50 ml/min) voir rubriques 4.4 et 5.2.
Insuffisance hépatique: en cas d’insuffisance hépatique, le bromure de tiotropium peut être utilisé sans adaptation de la posologie (voir rubrique 5.2).
Population pédiatrique
Asthme
La posologie recommandée chez les patients âgés de 6 à 17 ans est de 5 microgrammes de tiotropium, soit 2 bouffées administrées à l’aide de l’inhalateur Respimat, en une prise par jour, à heure fixe dans la journée.
Chez les adolescents (12-17 ans) atteints d’asthme sévère, le tiotropium doit être utilisé en association à un CSI (> 800-1600 µg de budésonide/jour ou équivalent) et un traitement de contrôle ou en association à un CSI (400-800 µg de budésonide/jour ou équivalent) et deux traitements de contrôle.
Chez les enfants (6-11 ans) atteints d’asthme sévère, le tiotropium doit être utilisé en association à un CSI (> 400 µg de budésonide/jour ou équivalent) et un traitement de contrôle ou en association à un CSI (200‑400 µg de budésonide/jour ou équivalent) et deux traitements de contrôle.
La sécurité et l’efficacité de Spiriva Respimat chez les enfants âgés de 6 à 17 ans atteints d’asthme modéré n’ont pas encore été établies. La sécurité et l’efficacité de Spiriva Respimat chez les enfants de moins de 6 ans n’ont pas été établies. Les données actuellement disponibles sont décrites dans les rubriques 5.1 et 5.2 mais aucune recommandation sur la posologie ne peut être établie.
BPCO
Il n’y a pas d’utilisation justifiée de Spiriva Respimat chez les enfants et les adolescents de moins de 18 ans.
Mucoviscidose
La sécurité et l’efficacité de Spiriva Respimat n’ont pas été établies. (voir rubriques 4.4 et 5.1).
Mode d’administration
Ce médicament est destiné à être utilisé par inhalation uniquement. La cartouche ne peut être insérée et utilisée que dans l'inhalateur Respimat réutilisable. Respimat est un dispositif d'inhalation qui génère une pulvérisation pour inhalation. Il est destiné à être utilisé par un seul patient et à délivrer plusieurs doses à l'aide d'une seule cartouche.
L'inhalateur Respimat réutilisable permet de remplacer la cartouche et peut être utilisé avec un maximum de 6 cartouches.
Les patients doivent lire le mode d'emploi de l'inhalateur Respimat réutilisable avant de commencer à utiliser Spiriva Respimat.
Pour garantir une administration correcte du médicament, le médecin ou un autre professionnel de santé devra s’assurer du bon usage de l’appareil par le patient.
Mode d’emploi pour la manipulation et l’utilisation de l’inhalateur Respimat réutilisable
Les enfants doivent utiliser Spiriva Respimat avec l’aide d’un adulte.
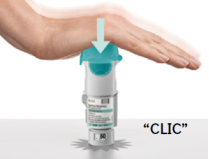
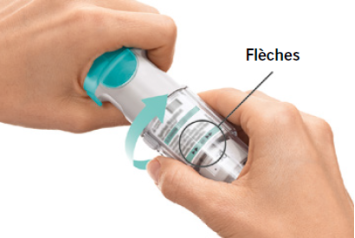
Le patient aura à utiliser cet inhalateur UNE SEULE FOIS PAR JOUR. À chaque utilisation, il prendra DEUX BOUFFEES.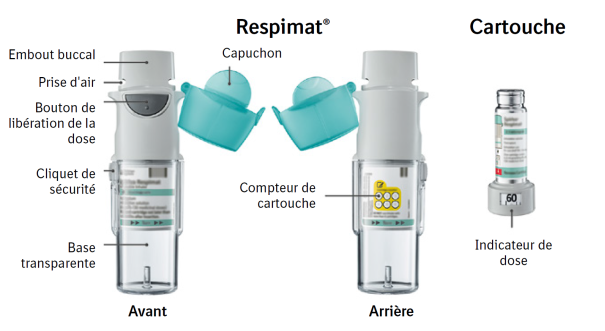
- Si vous n’avez pas utilisé le Spiriva Respimat depuis plus de 7 jours, libérez une bouffée vers le sol.
- Si vous n’avez pas utilisé le Spiriva Respimat depuis plus de 21 jours, répétez les étapes 4 à 6 « Préparation pour l’utilisation » jusqu'à ce qu'un nuage soit visible. Ensuite, répétez les étapes 4 à 6 trois autres fois.
Comment entretenir l’inhalateur Respimat réutilisable
Nettoyer l’embout buccal au moins une fois par semaine, y compris la partie métallique à l’intérieur de l’embout buccal, avec un linge ou un tissu humide uniquement.
Une décoloration mineure de l’embout buccal n’affecte pas les performances de l’inhalateur Respimat réutilisable.
Si nécessaire, essuyer l'extérieur de l’inhalateur Respimat réutilisable avec un chiffon humide.
Quand se procurer un nouvel inhalateur
Lorsque le patient a utilisé l’inhalateur avec 6 cartouches, il doit se procurer une nouvelle boîte de Spiriva Respimat contenant un inhalateur. N’utilisez pas l'inhalateur Respimat réutilisable pendant plus d'un an après avoir inséré la première cartouche.


Préparation pour l’utilisation
|
|
|
|
|
|
|
|
|
|
|
|
Utilisation quotidienne
TOURNER
|
|
OUVRIR
|
|
PRESSER
|
|
Quand remplacer la cartouche de Spiriva Respimat L’indicateur de dose montre le nombre de bouffées restantes dans la cartouche.
L’indicateur de dose montre le nombre de bouffées restantes dans la cartouche.
60 bouffées restantes

Moins de 10 bouffées restantes. Se procurer une nouvelle cartouche.
 La cartouche est vide. Tourner la base transparente afin de la retirer. L’inhalateur est maintenant en position verrouillée. Retirer la cartouche de l’inhalateur. Insérer une nouvelle cartouche jusqu’à entendre un déclic (se référer à l’étape 2). La nouvelle cartouche dépassera davantage que la toute première cartouche (continuer avec l'étape 3). Ne pas oublier de remettre la base transparente pour déverrouiller l'inhalateur.
La cartouche est vide. Tourner la base transparente afin de la retirer. L’inhalateur est maintenant en position verrouillée. Retirer la cartouche de l’inhalateur. Insérer une nouvelle cartouche jusqu’à entendre un déclic (se référer à l’étape 2). La nouvelle cartouche dépassera davantage que la toute première cartouche (continuer avec l'étape 3). Ne pas oublier de remettre la base transparente pour déverrouiller l'inhalateur.
4.3 Contre-indications
Hypersensibilité au bromure de tiotropium, à l'un des excipients mentionnés à la rubrique 6.1, ou à l’atropine ou ses dérivés, par exemple l’ipratropium ou l’oxitropium.
4.8 Effets indésirables
Résumé du profil de sécurité
Un grand nombre des effets indésirables cités peuvent être attribués aux propriétés anticholinergiques du bromure de tiotropium.
Tableau résumé des effets indésirables
Les fréquences des effets indésirables présentés ci-dessous sont basées sur les taux d’incidence brute des effets indésirables observés dans le groupe traité par le tiotropium (c’est-à-dire les événements imputables au tiotropium), regroupés à partir des données de 7 études cliniques dans la BPCO (3282 patients) et 12 études cliniques dans l’asthme chez les adultes et dans la population pédiatrique (1930 patients), contrôlées contre placebo, pendant des périodes de traitement comprises entre 4 semaines et 1 an.
La fréquence est définie selon les modalités conventionnelles:
Très fréquent (≥1/10), fréquent (≥1/100 à <1/10); peu fréquent (≥1/1.000 à <1/100); rare (≥1/10.000 à <1/1.000), très rare (<1/10.000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Classe de système d’organes / Terme MedDRA recommandé | Fréquence dans la BPCO | Fréquence dans l’asthme |
Troubles du métabolisme et de la nutrition |
|
|
Déshydratation | Fréquence indéterminée | Fréquence indéterminée |
|
|
|
Affections du système nerveux |
|
|
Etourdissements | Peu fréquent | Peu fréquent |
Céphalées | Peu fréquent | Peu fréquent |
Insomnies | Rare | Peu fréquent |
|
|
|
Affections oculaires |
|
|
Glaucome | Rare | Fréquence indéterminée |
Augmentation de la pression intraoculaire | Rare | Fréquence indéterminée |
Vision trouble | Rare | Fréquence indéterminée |
|
|
|
Affections cardiaques |
|
|
Fibrillation auriculaire | Rare | Fréquence indéterminée |
Palpitations | Rare | Peu fréquent |
Tachycardie supraventriculaire | Rare | Fréquence indéterminée |
Tachycardie | Rare | Fréquence indéterminée |
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Toux | Peu fréquent | Peu fréquent |
Pharyngite | Peu fréquent | Peu fréquent |
Dysphonie | Peu fréquent | Peu fréquent |
Epistaxis | Rare | Rare |
Bronchospasme | Rare | Peu fréquent |
Laryngite | Rare | Fréquence indéterminée |
Sinusite | Fréquence indéterminée | Fréquence indéterminée |
|
|
|
Affections gastro-intestinales |
|
|
Sécheresse buccale | Fréquent | Peu fréquent |
Constipation | Peu fréquent | Rare |
Candidose oropharyngée | Peu fréquent | Peu fréquent |
Dysphagie | Rare | Fréquence indéterminée |
Reflux gastro-œsophagien | Rare | Fréquence indéterminée |
Caries dentaires | Rare | Fréquence indéterminée |
Gingivite | Rare | Rare |
Glossite | Rare | Fréquence indéterminée |
Stomatite | Fréquence indéterminée | Rare |
Occlusion intestinale, y compris iléus paralytique | Fréquence indéterminée | Fréquence indéterminée |
Nausées | Fréquence indéterminée | Fréquence indéterminée |
|
|
|
Affections de la peau et du tissu sous-cutané, affections du système immunitaire |
|
|
Éruption cutanée | Peu fréquent | Peu fréquent |
Prurit | Peu fréquent | Rare |
Œdème de Quincke | Rare | Rare |
Urticaire | Rare | Rare |
Infection cutanée/ulcération cutanée | Rare | Fréquence indéterminée |
Peau sèche | Rare | Fréquence indéterminée |
Hypersensibilité (y compris réactions immédiates) | Fréquence indéterminée | Rare |
Réaction anaphylactique | Fréquence indéterminée | Fréquence indéterminée |
|
|
|
Troubles musculosquelettiques et du tissu conjonctif |
|
|
Gonflement articulaire | Fréquence indéterminée | Fréquence indéterminée |
|
|
|
Affections du rein et des voies urinaires |
|
|
Rétention urinaire | Peu fréquent | Fréquence indéterminée |
Dysurie | Peu fréquent | Fréquence indéterminée |
Infection du tractus urinaire | Rare | Rare |
Description d’effets indésirables sélectionnés
Dans les essais cliniques contrôlés menés dans la BPCO, les effets indésirables les plus fréquemment observés ont été les effets indésirables de type anticholinergique tels que la sécheresse buccale survenue chez environ 2,9% des patients. Dans l’asthme la fréquence de la sécheresse buccale a été de 0,83%.
Dans 7 essais cliniques menés dans la BPCO, la sécheresse buccale a été à l’origine de 3 arrêts de traitement parmi les 3282 patients traités par le tiotropium (soit 0,1% des patients traités). Aucune interruption du traitement due à une sécheresse buccale n’a été rapportée dans les 12 essais cliniques menés dans l’asthme (1930 patients).
Les effets indésirables graves liés aux effets anticholinergiques incluent: glaucome, constipation, occlusion intestinale y compris iléus paralytique et rétention urinaire.
Population pédiatrique
La base de données de sécurité inclut 560 patients pédiatriques (296 patients âgés de 1 à 11 ans et 264 patients âgés de 12 à 17 ans) de 5 études cliniques contrôlées contre placebo ayant des périodes de traitement de 12 semaines à 1 an. La fréquence, le type et la sévérité des effets indésirables dans la population pédiatrique ont été similaires à ceux observés chez les adultes.
Autres populations particulières
Le risque de survenue des effets anticholinergiques peut augmenter avec l’âge.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté:
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Boehringer Ingelheim International GmbH
Binger Strasse 173
55216 Ingelheim am Rhein
Allemagne
8. NUMÉRO D’AUTORISATION DE MISE SUR LE MARCHÉ
Belgique : BE316495
Luxembourg : 2008110041
- 0495586: 1 inhalateur Respimat réutilisable et 1 cartouche
- 0495605: 1 inhalateur Respimat réutilisable et 3 cartouches
- 0874039: 1 cartouche
- 0874042: 3 cartouches
10. DATE DE MISE A JOUR DU TEXTE 12/2024.
1
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2735959 | SPIRIVA RESPIMAT 2,5MCG 60 SOL INHAL+1 CARTOUCHE | R03BB04 | € 35,31 | - | Oui | - | - |