1. DENOMINATION DU MEDICAMENT
Duovent® 0,5 mg/1,25 mg/4 ml solution pour inhalation par nébuliseur
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
4 ml de solution contiennent 0,522 mg de bromure d'ipratropium monohydraté (= 0,500 mg de bromure d'ipratropium anhydre) et 1,250 mg de bromhydrate de fénotérol.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution pour inhalation par nébuliseur.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Le Duovent est un bronchodilatateur indiqué chez l’adulte et l’enfant à partir de 12 ans dans le traitement symptomatique d’un écoulement d’air limité réversible dans l'asthme (y compris l'asthme d'effort) et dans les bronchopneumopathies chroniques obstructives (telles que la bronchite chronique, la bronchite asthmatiforme chronique et l'emphysème pulmonaire).
On tiendra compte de la nécessité éventuelle d'un traitement anti-inflammatoire concomitant, par exemple aux corticoïdes.
4.2 Posologie et mode d'administration
Posologie
Le traitement doit être initié et administré sous contrôle médical, par exemple en milieu hospitalier. Un traitement à domicile peut être réalisé dans des cas exceptionnels (symptômes graves ou patients expérimentés nécessitant des doses plus élevées) après une consultation avec un médecin expérimenté lorsqu’une faible dose de bronchodilatateur bêta-agoniste à action rapide comme le Duovent HFA a été insuffisante pour soulager les symptômes. Le traitement avec la solution pour inhalation par nébuliseur devrait toujours être débuté par la dose la plus faible (1 ampoule). Dans les cas très graves, deux ampoules peuvent être nécessaires pour soulager les symptômes. L’administration doit être arrêtée lorsqu’un soulagement suffisant des symptômes est atteint.
Les doses recommandées sont les suivantes :
Episodes aigus de bronchospasme
Adultes (y compris personnes âgées) :
- Dans la plupart des cas, une ampoule est suffisante pour lever le spasme.
Dans les cas très graves, l’inhalation d’une 2ème ampoule peut être nécessaire pour soulager les symptômes.
Population pédiatrique :
- Adolescents de plus de 12 ans : voir adultes
- Enfants en-dessous de 12 ans : l’utilisation n’est pas recommandée.
Mode d’administration
Précautions à prendre avant l’administration du médicament
Les patients prédisposés au glaucome nécessitent une protection des yeux (voir § "Mises en garde spéciales et précautions d'emploi").
- Chaque ampoule est prête à l'emploi et ne nécessite aucune dilution.
- La solution est destinée à l'inhalation et non à l'ingestion ni à l’administration parentérale.
- Le Duovent solution pour inhalation par nébuliseur en monodoses s'administre à l’aide d’un nébuliseur ou d’un appareil à pression positive intermittente.
- L’exposition des poumons au médicament et l’exposition systémique dépendent du type d'inhalateur utilisé et peuvent être plus élevées qu’après administration du Duovent HFA, solution pour inhalation en flacon pressurisé.
- La solution peut également être pulsée par un débit d’oxygène (6 à 8 l/min.).
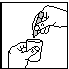
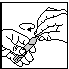
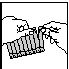
fig. 1 fig. 2 fig. 3
1. Préparer l'inhalateur suivant les instructions du fabricant ou du médecin.
2. Détacher une monodose de l'ensemble (fig. 1).
3. Ouvrir la monodose par torsion de la partie supérieure (fig. 2).
4. Vider le contenu dans le réservoir de l'inhalateur (fig. 3).
5. Utiliser l'inhalateur suivant les instructions.
6. Après emploi, jeter les restes éventuels de solution et nettoyer l'appareil.
Comme le vial monodose ne contient pas de conservateur, afin d'éviter toute contamination microbienne, on l'utilisera dès qu'il est ouvert et pour chaque nouvelle aérosolisation, on ouvrira un nouveau vial. On éliminera les vials partiellement utilisés.
4.3 Contre-indications
- Hypersensibilité au bromhydrate de fénotérol, à d’autres amines sympathicomimétiques, à un autre dérivé atropinique ou à l’un des excipients mentionnés à la rubrique 6.1.
- Patients souffrants de thyréotoxicose, de cardiomyopathie hypertrophique obstructive ou de tachyarrythmie.
- Enfants de moins de 12 ans.
4.8 Effets indésirables
La plupart des effets indésirables peuvent être attribués aux propriétés anticholinergiques et β-adrénergiques de Duovent. Comme tout traitement topique, Duovent peut entraîner des irritations locales. Les effets indésirables ont été identifiés sur base des données issues d’études cliniques et de la pharmacovigilance durant la période d’utilisation suivant l’approbation du médicament.
Les effets indésirables les plus fréquents rapportés lors des études cliniques sont : céphalées, toux, bouche sèche, vomissements, nausées et étourdissements, tremblements, pharyngite, dysphonie, tachycardie, palpitations, augmentation de la pression systolique, nervosité.
Les effets indésirables ont été classés en fonction de leur incidence en utilisant la classification suivante :
Très fréquent ( 1/10) ; fréquent ( 1/100, <1/10) ; peu fréquent ( 1/1000, <1/100) ; rare ( 1/10.000, < 1/1.000) ; très rare (<1/10.000), fréquence indéterminée (ne peut être estimée sur la base des données cliniques disponibles).
Classes de systemes d’organes | Effet indésirables | Fréquence |
Affections du système immunitaire | réactions cutanées ou réactions de type allergique (hypersensibilité)*, comme une éruption cutanée, un oedème angioneurotique, de l'urticaire, un laryngospasme et des réactions anaphylactiques* | Rare |
Troubles du métabolisme et de la nutrition | hypokaliémie* | Rare |
Affections psychiatriques | cas d’altérations psychologiques, agitation | Rare |
nervosité | Peu fréquent | |
Affections du système nerveux | céphalées, légers tremblements des muscles squelettiques, vertiges | Peu fréquent |
hyperactivité | Fréquence indéterminée | |
Affections oculaires | troubles de l’accommodation*, glaucome à angle fermé*, augmentation de la pression intra-occulaire*, mydriase*, vision trouble*, douleur oculaire*, œdème cornéen*, hyperémie de la conjonctive*, halo*. Voir aussi § "Mises en garde spéciales et précautions d’emploi". | Rare |
Affections cardiaques | fibrillation auriculaire, arythmies, tachycardie supraventriculaire*, ischémie myocardique* | Rare |
tachycardie, augmentation du rythme cardiaque, palpitations | Peu frequent : | |
Affections respiratoires, thoraciques et médiastinales | toux | Fréquent |
pharyngite, dysphonie | Peu fréquent | |
bronchospasme, irritation de la gorge, œdème pharyngé, spasme laryngé*, bronchospasme paradoxal*, sécheresse de la gorge* | Rare | |
Affections gastro-intestinales | sécheresse de la bouche, nausées, vomissements | Peu fréquent |
stomatite, glossite, œdème buccal*, troubles du transit gastro-intestinal, constipation* et diarrhée | Rare | |
Affections de la peau et du tissu sous-cutané | rash, hyperhidrose*, urticaire, prurit, angio-œdème* | Rare |
Affections musculo-squelettiques et systémiques | myalgie, faiblesse et spasmes musculaires | Rare |
Affections du rein et des voies urinaires | rétention urinaire | Rare |
Investigations | augmentation de la tension artérielle systolique | Rare |
diminution de la tension artérielle diastolique | Peu fréquent |
* Cet effet indésirable a été notifié spontanément dans le cadre de données de suivi post-commercialisation. Cet effet indésirable n’a été observé dans aucun des essais cliniques sélectionnés avec le Duovent. L’estimation est basée sur la limite supérieure de son intervalle de confiance à 95%, calculée à partir de la totalité des patients traités dans les essais cliniques et les études.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via
Belgique
Agence fédérale des médicaments et des produits de santéwww.afmps.be
Division Vigilance :Site internet : www.notifieruneffetindesirable.be
e-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Website : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHE
Boehringer Ingelheim SComm
Avenue Arnaud Fraiteur 15-23
1050 Bruxelles
8. NUMERO D'AUTORISATION DE MISE SUR LE MARCHE
Belgique : BE168506
Luxembourg : 2009030358
• NN 0213187 : 1*20 ampoules
• NN 0334716 : 1*60 ampoules
10. DATE DE MISE A JOUR DU TEXTE
06/05/2025
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1281286 | DUOVENT VIALS PR INHA 20X0,50MG | R03AL01 | € 13,92 | - | Oui | € 2,83 | € 1,7 |