- DENOMINATION DU MEDICAMENT
Yaz 0,02 mg/3 mg comprimés pelliculés
- COMPOSITION QUALITATIVE ET QUANTITATIVE
24 comprimés pelliculés rose pâle:
Chaque comprimé pelliculé contient 0,020 mg d’éthinylestradiol (sous forme de betadex clathrate) et 3 mg de drospirénone.
Excipient à effet notoire: lactose 46 mg (sous forme de lactose monohydraté 48,18 mg)
4 comprimés pelliculés placebos (inactifs) blancs :
Le comprimé ne contient pas de substances actives.
Excipient à effet notoire: lactose 22 mg (sous forme de lactose monohydraté 23,21 mg)
Pour la liste complète des excipients voir rubrique 6.1.
- FORME PHARMACEUTIQUE
Comprimé pelliculé
Les comprimés actifs sont des comprimés rose pâle, ronds, à faces convexes, avec les lettres « DS » marquées dans un hexagone régulier sur l’une des faces.
Les comprimés placebo sont des comprimé blanc, ronds, à faces convexes, avec les lettres « DP » marquées dans un hexagone régulier sur l’une des faces.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Contraception orale.
La décision de prescrire Yaz doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thrombo-embolie veineuse (TEV), ainsi que du risque de TEV associé à Yaz en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques 4.3 et 4.4).
4.2 Posologie et mode d'administration
Voie d’administration : voie orale
Posologie
Mode d'utilisation de Yaz
Les comprimés doivent être pris chaque jour, à peu près à la même heure, éventuellement avec un peu de liquide, en respectant l'ordre indiqué sur la plaquette. La prise des comprimés doit se faire de façon continue. Prendre un comprimé chaque jour pendant 28 jours consécutifs. Commencer la plaquette suivante le jour suivant la prise du dernier comprimé de la plaquette précédente. Une hémorragie de privation débute généralement 2 ou 3 jours après avoir commencé à prendre les comprimés placebos (situés sur la dernière rangée) et il est possible qu'elle ne soit pas terminée au moment d'entamer la plaquette suivante.
Modalités d’instauration du traitement par Yaz
- Absence de contraception hormonale antérieure (le mois précédent)
La prise des comprimés doit commencer le 1er jour du cycle, c'est-à-dire le premier jour des règles.
- Relais d’une contraception hormonale combinée (contraceptif oral combiné [COC], anneau vaginal ou patch transdermique)
Prendre le 1er comprimé de Yaz de préférence le jour qui suit la prise du dernier comprimé actif (dernier comprimé contenant les substances actives) de la précédente COC, ou au plus tard le jour qui suit la période habituelle d’arrêt des comprimés, ou le jour suivant la prise du dernier comprimé placebo de la précédente COC. En cas de relais d’un anneau vaginal ou d’un patch transdermique, prendre le 1er comprimé de Yaz de préférence le jour du retrait ou au plus tard le jour prévu pour la nouvelle pose.
- Relais d'une contraception progestative seule (pilule progestative seule, forme injectable, implant) ou par un système intra-utérin (SIU) contenant un progestatif :
Chez une femme, le relais peut se faire : à tout moment du cycle s'il s'agit d'une pilule progestative seule ; le jour du retrait s'il s'agit d'un implant ou d'un SIU ; ou le jour prévu pour l'injection suivante s'il s'agit d'une forme injectable. Dans tous les cas, il sera recommandé aux femmes d'utiliser une méthode de contraception mécanique complémentaire pendant les 7 premiers jours de prise de Yaz.
- Après une interruption de grossesse au cours du premier trimestre
Il est possible de commencer une contraception immédiatement chez ces femmes. Il n'est pas nécessaire d'utiliser une méthode de contraception complémentaire.
- Après un accouchement ou une interruption de grossesse au cours du deuxième trimestre
Il est conseillé de commencer la contraception 21 à 28 jours après l'accouchement ou l'interruption du 2e trimestre. Si cette contraception est démarrée plus tardivement, il leur sera recommandé d'utiliser une méthode de contraception mécanique complémentaire pendant les 7 premiers jours de traitement. Cependant, si des rapports sexuels ont déjà eu lieu, il convient de s'assurer de l'absence de grossesse avant de commencer la COC ou d'attendre le retour des règles.
En cas d'allaitement, voir rubrique 4.6.
Conduite à tenir en cas d'oubli d'un ou plusieurs comprimés :
L’oubli des 4 comprimés blancs de la dernière rangée de la plaquette correspond à l’oubli de comprimés placebos et n’a donc pas de réelle importance. Cependant, les comprimés oubliés doivent être jetés pour éviter toute prolongation non intentionnelle de la période sous placebo. Les conseils suivants s’appliquent uniquement en cas d’oubli de comprimés actifs.
Un retard de moins de 24 heures dans la prise d'un comprimé ne modifie pas l'efficacité contraceptive. Il sera conseillé aux femmes de prendre le comprimé oublié dès que cet oubli est constaté ; la prise des comprimés suivants s'effectuant à l'heure habituelle.
Si le retard est supérieur à 24 heures, la sécurité contraceptive peut être diminuée. En cas d'oubli de comprimés, les deux règles suivantes doivent être connues car nécessaires pour choisir la conduite à tenir :
- La durée recommandée pour l’intervalle de comprimés sans hormone est de 4 jours.
La prise de comprimés ne doit jamais être interrompue plus de 7 jours ;
- Sept jours de prise ininterrompue du traitement sont nécessaires afin d’obtenir une inhibition correcte de l'axe hypothalamo-hypophyso-ovarien.
En conséquence, les conseils suivants pourront être donnés dans le cadre de la pratique quotidienne.
- Jour 1 à 7 :
Il devra être demandé aux femmes de prendre le dernier comprimé oublié dès que l'oubli est constaté, même si cela implique la prise de deux comprimés en même temps. Les comprimés suivants devront être pris à l'heure habituelle. Une contraception mécanique complémentaire (préservatifs par exemple) est cependant nécessaire pendant les 7 jours suivants. Si des rapports sexuels ont eu lieu au cours des 7 jours précédant l'oubli, il existe un risque de grossesse. Le risque de grossesse est d'autant plus élevé que le nombre de comprimés oubliés est important ou que la date de l'oubli est proche du début de la rangée des comprimés placebos.
- Jour 8 à 14 :
Il devra être recommandé aux femmes de prendre le dernier comprimé oublié dès que l’oubli est constaté, même si cela implique la prise de deux comprimés en même temps. Les comprimés suivants devront être pris à l'heure habituelle. Si les comprimés ont été pris correctement au cours des 7 jours précédant le premier comprimé oublié, aucune mesure contraceptive complémentaire n'est nécessaire. Cependant, en cas d'oubli de plusieurs comprimés, il devra être recommandé aux femmes de prendre des précautions complémentaires pendant 7 jours.
- Jour 15 à 24 :
Le risque de diminution de l'activité contraceptive est maximal en raison de la proximité de la prise des 4 jours de comprimés placebos. Il est cependant possible d’empêcher la diminution de l'effet contraceptif en ajustant comme suit les modalités de prise des comprimés. L'adoption de l'une des deux possibilités suivantes permet d'éviter de prendre des mesures contraceptives supplémentaires, pourvu que la femme ait pris correctement tous les comprimés au cours des 7 jours précédant le premier comprimé oublié. Dans le cas contraire, il devra être recommandé aux femmes de suivre le premier schéma de prise et d'utiliser une méthode contraceptive complémentaire pendant les 7 jours suivants.
- Il sera recommandé aux femmes de prendre le dernier comprimé oublié dès que cet oubli est constaté, même si deux comprimés doivent être pris en même temps.
Les comprimés suivants sont ensuite pris à l'heure habituelle, jusqu’à avoir terminé les comprimés actifs de la plaquette. Les 4 comprimés de la dernière rangée (comprimés placebos) ne doivent pas être pris. La plaquette suivante doit être commencée immédiatement. Une hémorragie de privation est peu probable avant la fin des comprimés actifs de la seconde plaquette, mais des « spottings » ou des métrorragies peuvent être observés pendant la durée de prise des comprimés.
- On peut alternativement conseiller à la femme d’interrompre la prise des comprimés actifs de la plaquette en cours. Elle devra alors prendre des comprimés de la dernière rangée (comprimés placebos) pendant 4 jours maximum, incluant le nombre de jours où des comprimés ont été oubliés, et elle commencera ensuite la plaquette suivante.
Chez une femme ayant oublié de prendre un (des) comprimé(s), l'absence d'hémorragie de privation durant la prise des comprimés placebos devra faire rechercher une éventuelle grossesse.
Conduite à tenir en cas de troubles gastro-intestinaux
En cas de troubles gastro-intestinaux sévères (par exemple des vomissements ou une diarrhée), l'absorption d'un comprimé peut ne pas être complète ; des mesures contraceptives complémentaires doivent donc être prises. Si des vomissements se produisent dans les 3-4 heures qui suivent la prise d'un comprimé actif, un nouveau comprimé doit être pris en remplacement dès que possible. Le nouveau comprimé doit être pris si possible dans les 24 heures qui suivent l’heure habituelle de prise. Si plus de 24 heures se sont écoulées, les mêmes consignes que celles données pour les oublis de comprimés doivent s'appliquer (voir rubrique 4.2 « Conduite à tenir en cas d’oubli d’un ou plusieurs comprimés »). Si la femme ne veut pas modifier le calendrier normal de prise des comprimés, elle devra prendre le ou les comprimé(s) supplémentaire(s) sur une autre plaquette.
Comment retarder les règles ?
La survenue des règles peut être retardée en commençant une nouvelle plaquette de Yaz sans prendre les comprimés placebos de la plaquette en cours. Les règles peuvent être retardées jusqu'à la fin des comprimés actifs de la seconde plaquette si nécessaire. Pendant cette période, des métrorragies ou des « spottings » peuvent se produire. Yaz peut ensuite être repris normalement après la prise des comprimés placebos.
Il est possible de décaler la survenue des règles à un autre jour de la semaine en raccourcissant la durée de la prise des comprimés placebos du nombre de jours nécessaires. Comme pour un retard de règles, plus l'intervalle est court, plus le risque d'absence d'hémorragie de privation et de survenue de métrorragies ou de « spottings » lors de la prise des comprimés de la plaquette suivante est important.
Information supplémentaire concernant les populations particulières
Population pédiatrique
Yaz est uniquement indiqué après la ménarche.
Patientes âgées
Yaz n’est pas indiqué après la ménopause.
Patientes souffrant d’insuffisance hépatique
Yaz est contre-indiqué chez les femmes souffrant d’une maladie hépatique sévère. Voir aussi rubriques 4.3 et 5.2.
Patientes souffrant d’insuffisance rénale
Yaz est contre-indiqué chez les femmes souffrant d’insuffisance rénale sévère ou d’insuffisance rénale aiguë. Voir aussi rubriques 4.3 et 5.2.
4.3. Contre-indications
Les contraceptifs hormonaux combinés (CHC) ne doivent pas être utilisés dans les situations suivantes. En cas de survenue pour la première fois de l'une de ces pathologies lors de la prise d'un CHC, interrompre immédiatement le traitement :
- Présence ou risque de thrombo-embolie veineuse (TEV)
- Thrombo-embolie veineuse – présence de TEV (patient traité par des anticoagulants) ou antécédents de TEV (p. ex. thrombose veineuse profonde [TVP] ou embolie pulmonaire [EP])
- Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie veineuse, telle qu’une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S
- Intervention chirurgicale majeure avec immobilisation prolongée (voir rubrique 4.4)
- Risque élevé de thrombo-embolie veineuse dû à la présence de multiples facteurs de risque (voir rubrique 4.4)
- Présence ou risque de thrombo-embolie artérielle (TEA)
- Thrombo-embolie artérielle – présence ou antécédents de thrombo-embolie artérielle (p. ex. infarctus du myocarde [IM]) ou de prodromes (p. ex. angine de poitrine)
- Affection cérébrovasculaire – présence ou antécédents d’accident vasculaire cérébral (AVC) ou de prodromes (p. ex. accident ischémique transitoire [AIT])
- Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie artérielle, telle qu’une hyperhomocystéinémie ou la présence d’anticorps anti-phospholipides (anticorps anti- cardiolipine, anticoagulant lupique).
- Antécédents de migraine avec signes neurologiques focaux
- Risque élevé de thrombo-embolie artérielle dû à la présence de multiples facteurs de risque (voir rubrique 4.4) ou d’un facteur de risque sévère tel que :
- diabète avec symptômes vasculaires
- hypertension artérielle sévère
- dyslipoprotéinémie sévère
- affection hépatique sévère ou antécédent d'affection hépatique sévère, en l'absence de normalisation des tests fonctionnels hépatiques
- insuffisance rénale sévère ou aiguë
- tumeur hépatique (bénigne ou maligne) présente ou passée
- tumeur maligne hormono-dépendante connue ou suspectée (exemple: organes génitaux ou seins)
- saignements vaginaux d'origine inconnue
- hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1
Yaz est contre-indiqué en administration concomitante avec des médicaments contenant de l’ombitasvir/paritaprévir/ritonavir et du dasabuvir, ou des médicaments contenant du glécaprévir/pibrentasvir ou du sofosbuvir/velpatasvir/voxilaprévir (voir rubrique 4.5).
4.8 Effets indésirables
Pour les effets indésirables graves chez les utilisatrices de COC, voir aussi rubrique 4.4.
Les effets indésirables suivants ont été rapportés au cours de l'utilisation de Yaz :
Sur la base des essais cliniques, le tableau ci-dessous décrit par fréquence les effets indésirables selon la classification système-organe MedDRA. Le terme MedDRA le plus approprié est utilisé afin de décrire un certain type de réaction ainsi que ses synonymes et pathologies liées.
Effets indésirables associés à l’utilisation de Yaz en tant que contraceptif ou dans le traitement de l’acné modéré selon la terminologie et la classification système-organe MedDRA.
Classe de systèmes d’organes | Fréquent | Peu fréquent | Rare | Fréquence inconnue (ne peut pas être estimée à partir des données disponibles) |
Infections et infestations |
|
| Candidose |
|
Affections hématologiques et du système lymphatique |
|
| Anémie |
|
Affections du système immunitaire |
|
| Réaction allergique | Hypersensibilité |
Affections endocriniennes |
|
| Troubles endocriniens |
|
Troubles du métabolisme et de la nutrition |
|
| Augmentation de l’appétit |
|
Affections psychiatriques | Labilité émotionnelle | Dépression | Anorgasmie |
|
Affections du système nerveux | Maux de tête | Etourdissements | Vertige |
|
Affections oculaires |
|
| Conjonctivite |
|
Affections cardiaques |
|
| Tachycardie |
|
Affections vasculaires |
| Migraine | Phlébite |
|
Affections gastro-intestinales | Nausées | Douleur abdominale | Distension abdominale |
|
Affections hépatobiliaires |
|
| Douleur biliaire |
|
Affections de la peau et du tissu sous-cutané |
| Acné | Chloasma | Erythème polymorphe |
Affections musculo-squelettiques et systémiques |
| Douleur dorsale |
|
|
Affections des organes de reproduction et du sein | Douleur mammaire | Candidose vaginale | Dyspareunie |
|
Troubles généraux et anomalies au site d’administration |
| Asthénie | Malaise |
|
Investigations |
| Prise de poids | Perte de poids |
|
* les saignements irréguliers disparaissent généralement avec la poursuite du traitement
Déclaration de certains effets indésirables particuliers
Une augmentation du risque d'événement thrombotique et thrombo-embolique artériel et veineux, incluant l’infarctus du myocarde, l’AVC, les accidents ischémiques transitoires, la thrombose veineuse et l’embolie pulmonaire, a été observée chez les femmes utilisant des CHC ; ceci est abordé plus en détails en rubrique 4.4.
Les effets indésirables graves suivants observés chez des femmes utilisatrices de contraceptifs oraux combinés sont également décrits à la rubrique 4.4. :
- accidents thromboemboliques veineux
- accidents thromboemboliques artériels
- hypertension
- tumeurs hépatiques
- survenue ou aggravation d'affections dont l'association avec les contraceptifs oraux combinés n'est pas certaine : maladie de Crohn, colite ulcéreuse, épilepsie, myome utérin, porphyrie, lupus érythémateux disséminé, herpès gravidique, chorée de Sydenham, syndrome hémolytique et urémique, ictère cholestatique
- chloasma
- perturbations chroniques ou sévères de la fonction hépatique pouvant nécessiter l'arrêt de la contraception orale combinée jusqu'à normalisation des tests de la fonction hépatique.
La fréquence de diagnostic de cancer du sein est très légèrement augmentée chez les utilisatrices de contraceptifs oraux combinés. Comme le cancer du sein est rare chez les femmes de moins de 40 ans cette augmentation est faible par rapport au risque général de cancer du sein. La relation de causalité avec l'utilisation d'un contraceptif oral combiné reste inconnue. Pour plus d'information se reporter aux rubriques 4.3 et 4.4.
Interactions
Des métrorragies et/ou un échec de la contraception peuvent être la conséquence d’interactions entre d’autres médicaments (inducteurs enzymatiques) et les contraceptifs oraux (voir rubrique 4.5).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via
Belgique :
Agence fédérale des Médicaments et des Produits de Santé
www.afmps.be
Division Vigilance,
Site internet: www.notifieruneffetindesirable.be
E-mail: adr@fagg-afmps.be
Luxembourg :
Centre Régional de Pharmacovigilance de Nancy ou
Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
8. NUMERO D’AUTORISATION DE MISE SUR LE MARCHE
Belgique: BE321386
Luxembourg: 2008090015
1x 28 tabletten 0491184
3x 28 tabletten 0492536
6x 28 tabletten 0492553
13x 28 tabletten 0572221
- DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Date de première autorisation : 11 Aôut 2008
Date de dernier renouvellement : 13 Juin 2012
- DATE DE MISE A JOUR DU TEXTE
Date d’approbation : 02/2025
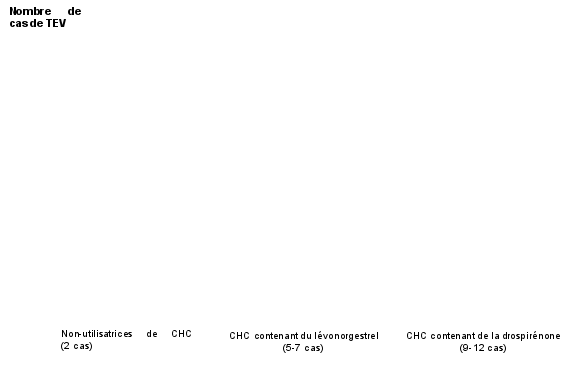
[1] Ces incidences ont été estimées à partir de l’ensemble des données des études épidémiologiques, en s’appuyant sur les risques relatifs liés aux différents CHC en comparaison aux CHC contenant du lévonorgestrel.
[2] Point central de l’intervalle de 5-7 pour 10 000 années-femmes sur la base d’un risque relatif, pour les CHC contenant du lévonorgestrel par rapport à la non-utilisation d’un CHC, d’environ 2,3 à 3,6
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2551877 | YAZ 0,02 MG/3 MG COMP PELL 3 X 28 | G03AA12 | € 34,81 | - | Oui | € 25,81 | € 25,81 |
| 2677417 | YAZ 0,02 MG/3 MG COMP PELL 13 X 28 | G03AA12 | € 116,85 | - | Oui | € 77,85 | € 77,85 |
| 2677425 | YAZ 0,02 MG/3 MG COMP PELL 6 X 28 | G03AA12 | € 59,42 | - | Oui | € 41,42 | € 41,42 |