1. DENOMINATION DU MEDICAMENT
Apidra 100 unités/ml solution injectable en flacon.
Apidra 100 unités/ml solution injectable en cartouche
Apidra Solostar 100 unités/ml solution injectable en stylo pré-rempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque ml contient 100 unités d’insuline glulisine (équivalent à 3,49 mg).
Apidra 100 unités/ml solution injectable en flacon
Chaque flacon contient 10 ml de solution injectable, équivalent à 1000 unités.
Apidra 100 unités/ml solution injectable en cartouche
Chaque cartouche contient 3 ml de solutioninjectable, équivalent à 300 unités.
Apidra Solostar 100 unités/ml solution injectable en stylo pré-rempli
Chaque stylo contient 3 ml de solution injectable, équivalent à 300 unités.
L’insuline glulisine est produite par la technique de l’ADN recombinant dans Escherichia coli.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Apidra 100 unités/ml solution injectable en flacon
Solution injectable en flacon.
Apidra 100 unités/ml solution injectable en cartouche
Solution injectable en cartouche.
Apidra Solostar 100 unités/ml solution injectable en stylo pré-rempli
Solution injectable en stylo pré-rempli.
Solution aqueuse, claire, incolore.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Traitement du diabète de l’adulte, l’adolescent et l’enfant à partir de 6 ans nécessitant un traitement par insuline.
4.2 Posologie et mode d’administration
Posologie
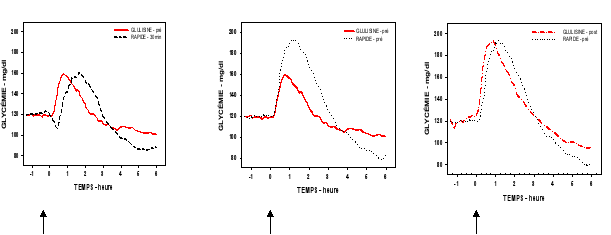
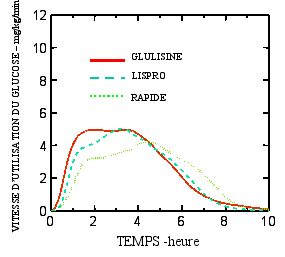
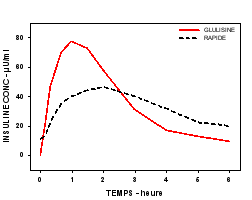
L’activité du produit est exprimée en unités. Ces unités sont spécifiques à Apidra et ne correspondent ni aux UI ni aux unités utilisées pour les autres analogues de l’insuline (voir rubrique 5.1).
Apidra doit être utilisé dans des schémas qui l’associent soit à une insuline humaine d’action intermédiaire ou d’action prolongée soit à un analogue de l’insuline basale et peut être utilisé avec des hypoglycémiants oraux.
La dose d’Apidra doit être ajustée individuellement.
Populations particulières
Insuffisance rénale
Les propriétés pharmacocinétiques de l’insuline glulisine sont généralement inchangées chez les patients insuffisants rénaux. Les besoins en insuline peuvent cependant être réduits en cas d’insuffisance rénale (voir rubrique 5.2).
Insuffisance hépatique
Les propriétés pharmacocinétiques de l’insuline glulisine n’ont pas été évaluées chez les patients ayant une altération de la fonction hépatique. Chez les patients insuffisants hépatiques, les besoins en insuline peuvent être diminués en raison d’une réduction de la néoglucogenèse et d’une réduction du métabolisme de l’insuline.
Sujet âgé
Les données pharmacocinétiques disponibles concernant les sujets âgés atteints de diabète sont limitées. Une altération de la fonction rénale peut provoquer une diminution des besoins en insuline.
Population pédiatrique
Il n’existe pas de données cliniques suffisantes sur l’utilisation d’Apidra chez l’enfant de moins de 6 ans.
Mode d’administration
Apidra 100 unités/ml solution injectable en flacon
Voie intraveineuse :
Apidra peut être administré par voie intraveineuse. Cela doit être réalisé par des professionnels de santé.
Apidra ne doit pas être mélangé avec une solution de glucose ou de Ringer ou avec une autre insuline.
Perfusion sous-cutanée continue d’insuline
Apidra peut être administré par perfusion sous-cutanée continue d’insuline (CSII) à l’aide d’une pompe à perfusion d’insuline avec des cathéters et des réservoirs adaptés. Les patients traités par CSII doivent être clairement informés sur l’utilisation de la pompe.
Le matériel de perfusion et le réservoir doivent être changés toutes les 48 heures en respectant les règles d’asepsie. Ces instructions peuvent différer des instructions générales du manuel de la pompe. Il est important que les patients suivent les instructions spécifiques à Apidra lors de l’utilisation d’Apidra. Le non-respect de ces instructions peut conduire à de graves effets indésirables.
En cas d’utilisation avec une pompe à perfusion sous-cutanée d’insuline, Apidra ne doit pas être mélangé à des diluants ou à aucune autre insuline.
Lorsqu’Apidra est administré par CSII, les patients doivent disposer d’un autre système de délivrance d'insuline en cas de défaillance de la pompe (voir rubriques 4.4 et 4.8).
Apidra 100 unités/ml solution injectable en flacon
Pour plus d’informations sur la manipulation voir rubrique 6.6.
Apidra 100 unités/ml solution injectable en cartouche
Apidra 100 unités/ml en cartouche ne convient que pour les injections sous-cutanées administrées au moyen d’un stylo réutilisable. Si une administration au moyen d’une seringue, une injection intraveineuse ou une pompe à perfusion est nécessaire, il convient d’utiliser un flacon (voir rubrique 4.4). Pour plus de détails sur la manipulation, voir rubrique 6.6.
Apidra Solostar 100 unités/ml solution injectable en stylo pré-rempli
Apidra Solostar 100 unités/ml en stylo pré-rempli ne convient que pour les injections sous-cutanées. Si une administration au moyen d’une seringue, une injection intraveineuse ou une pompe à perfusion est nécessaire, il convient d’utiliser un flacon (voir rubrique 4.4).
Voie sous-cutanée
Apidra doit être administré en injection sous-cutanée un peu avant (0-15 minutes) ou juste après les repas ou en perfusion sous-cutanée continue par pompe.
Apidra doit être administré en injection sous-cutanée dans la paroi abdominale, la cuisse ou la région deltoïde ou par perfusion continue dans la paroi abdominale. Dans une même zone d’injection (abdomen, cuisse ou deltoïde), il convient de varier, d’une injection à l’autre, les sites d’injection et les sites de perfusion, afin de diminuer le risque de développer une lipodystrophie ou une amyloïdose cutanée (voir rubriques 4.4 et 4.8).
Le taux d’absorption et, par conséquent, le début et la durée d’action peuvent être modifiés par le site d’injection, par l’exercice physique et par d’autres facteurs. L’injection sous-cutanée dans la paroi abdominale entraîne une absorption légèrement plus rapide qu’à partir des autres sites d’injection (voir rubrique 5.2).
Il faut s’assurer de ne pas pénétrer dans un vaisseau sanguin. Après l’injection, il ne faut pas masser le site d’injection. Les patients doivent être éduqués sur les bonnes techniques d’injection.
Mélange avec des insulines
En cas d’administration par injection sous-cutanée, Apidra ne doit pas être mélangé avec d’autres médicaments sauf avec l’insuline humaine NPH.
Pour d’autres précisions sur la manipulation, voir rubrique 6.6.
Le mode d’emploi inclus dans la notice doit être lu avec attention avant toute utilisation de SoloStar (voir rubrique 6.6).
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients répertoriés à la rubrique 6.1.
Hypoglycémie.
4.8 Effets indésirables
Résumé du profil de tolérance
L’hypoglycémie, l’effet indésirable le plus fréquemment rencontré lors de toute insulinothérapie, peut survenir si la dose d’insuline est supérieure aux besoins.
Tableau reprenant la liste des effets indésirables
Les effets indésirables rapportés lors des études cliniques sont listés ci-dessous, par classes de systèmes d’organes, dans un ordre décroissant en termes d’incidence (très fréquent : ≥1/10, fréquent : ≥1/100, <1/10 ; peu fréquent : ≥1/1000, <1/100 ; rare : ≥1/10 000, <1/1000 ; très rare : <1/10 000, fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables doivent être présentés suivant un ordre décroissant de gravité.
Classes de systèmes d’organes MedDRA | Très fréquent | Fréquent | Peu fréquent | Rare | Fréquence indéterminée |
Troubles du métabolisme et de la nutrition | Hypoglycémie |
|
|
| Hyperglycémie (pouvant conduire à une acidocétose diabétique(1)) |
Affections de la peau et du tissu sous-cutané |
| Réactions au site d’injection Réactions d’hypersensibilité locale |
| Lipodystrophie | Amyloïdose cutanée |
Troubles généraux et anomalies au site d’administration |
|
| Réactions d’hypersensibilité systémique |
|
|
(1) Apidra 100 unités/ml solution injectable en flacon La plupart des cas étaient liés à des erreurs de manipulation ou à une défaillance de la pompe lorsqu’Apidra a été utilisé par CSII. | |||||
Description des effets indésirables susmentionnés
- Troubles du métabolisme et de la nutrition
Les symptômes de l’hypoglycémie apparaissent en général subitement. Ils incluent sueurs froides, pâleur, fatigue, nervosité ou tremblement, anxiété, épuisement ou faiblesse inhabituels, confusion, difficulté de concentration, somnolence, faim intense, troubles de la vision, céphalée, nausées et palpitations.
L’hypoglycémie peut s’aggraver et entraîner une perte de la conscience et/ou des convulsions et peut conduire à une altération réversible ou non de la fonction cérébrale voire au décès.
Apidra 100 unités /ml solution injectable en flacon
Des cas d’hyperglycémie ont été rapportés avec Apidra lors de son utilisation par CSII (voir rubrique 4.4) ayant conduit à une acidocétose diabétique ; la plupart des cas étaient liés à des erreurs de manipulation ou à une défaillance de la pompe. Le patient doit toujours suivre les instructions spécifiques à Apidra et toujours avoir à disposition un autre système de délivrance d'insuline en cas de défaillance de la pompe.
- Affections de la peau et du tissu sous-cutané
Des réactions d’hypersensibilité locale (rougeur, gonflement et démangeaison au point d’injection) peuvent survenir pendant le traitement avec l’insuline. Ces réactions sont en général transitoires et elles disparaissent normalement au cours du traitement.
Une lipodystrophie et une amyloïdose cutanée peuvent survenir au site d’injection, ce qui peut retarder la résorption locale de l’insuline. Une rotation continue des sites d’injection dans une zone donnée peut aider à diminuer ou à éviter ces réactions (voir rubrique 4.4).
- Troubles généraux et anomalies au site d’administration
Les réactions d’hypersensibilité systémique peuvent se manifester par de l’urticaire, une oppression thoracique, une dyspnée, un eczéma allergique et un prurit. Les cas d’allergie généralisée grave, dont le choc anaphylactique, peuvent engager le pronostic vital.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via
Belgique : Agence Fédérale des Médicaments et des Produits de Santé : www.afmps.be – Division Vigilance : Site internet : www.notifieruneffetindesirable.be – E-mail : adr@fagg-afmps.be
Luxembourg : Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé – Site internet : www.guichet.lu/pharmacovigilance.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Sanofi-Aventis Deutschland GmbH
D-65926 Frankfurt am Main
Allemagne
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
Apidra 100 unités/ml solution injectable en flacon
EU/1/04/285/001-004
Apidra 100 unités/ml, solution injectable en cartouche
EU/1/04/285/005-012
Apidra Solostar 100 unités/ml solution injectable en stylo pré-rempli
EU/1/04/285/029-036
10. DATE DE MISE A JOUR DU TEXTE
04/02/2025
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu/
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2156719 | APIDRA 100 U/ML CARTOUCHE PATRONEN 5X3 ML 1500 U | A10AB06 | € 36,11 | - | Oui | - | - |
| 2381515 | APIDRA 100 U/ML FL INJ 10 ML 100 U/ML 1000 U | A10AB06 | € 24,22 | - | Oui | - | - |
| 2490324 | APIDRA 100 U/ML SOL INJ CARTOUCHE PREMPL 5X3ML | A10AB06 | € 40,27 | - | Oui | - | - |