1. DENOMINATION DU MEDICAMENT
RotaTeq solution buvable
Vaccin Rotavirus (vivant)
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Une dose (2 ml) contient :
type de Rotavirus* G1..............................au minimum 2,2 x 106 UI1, 2
type de Rotavirus* G2..............................au minimum 2,8 x 106 UI1, 2
type de Rotavirus* G3..............................au minimum 2,2 x 106 UI1, 2
type de Rotavirus* G4 ..............................au minimum 2,0 x 106 UI1, 2
type de Rotavirus* P1A[8] ..........................au minimum 2,3 x 106 UI1, 2
* rotavirus réassortants humain-bovin (vivant), produits sur cellules Vero
1 Unités Infectieuses
2 Limite inférieure de l’intervalle de confiance (p = 0,95)
Excipients à effet notoire
Ce vaccin contient 1080 milligrammes de saccharose et 37,6 milligrammes de sodium (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution buvable
Liquide clair, jaune pâle, pouvant avoir une teinte rosée
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
RotaTeq est indiqué pour l’immunisation active des nourrissons de l’âge de 6 semaines à 32 semaines pour la prévention des gastro-entérites dues à une infection à rotavirus (voir rubriques 4.2, 4.4 et 5.1).
RotaTeq doit être utilisé sur la base des recommandations officielles.
4.2 Posologie et mode d’administration
Posologie
De la naissance à 6 semaines
RotaTeq n'est pas indiqué dans cette tranche d'âge
La tolérance et l'efficacité de RotaTeq chez des sujets âgés de moins de 6 semaines n'ont pas été évaluées.
De 6 à 32 semaines
Le schéma de vaccination est en 3 doses.
La première dose peut être administrée à partir de l’âge de 6 semaines et au plus tard à l’âge de 12 semaines.
RotaTeq peut être administré à des nourrissons nés prématurés, à condition que la durée de la grossesse soit de 25 semaines au moins. Ces nourrissons doivent recevoir la première dose de RotaTeq au moins 6 semaines après leur naissance. Voir rubriques 4.4 et 5.1.
L’intervalle entre chaque dose doit être d’au moins 4 semaines.
Il est préférable que le schéma de vaccination en 3 doses soit terminé à l'âge de 20-22 semaines. Si nécessaire, la troisième (dernière) dose peut être faite jusqu'à l'âge de 32 semaines (voir rubrique 5.1).
Il n’existe pas de données sur l’interchangeabilité de RotaTeq avec un autre vaccin rotavirus. Il est recommandé que les enfants qui ont reçu une première dose de RotaTeq continuent de recevoir ce même vaccin pour les doses suivantes.
Si une dose incomplète a été avalée de façon certaine ou fortement probable, (par exemple si le nourrisson recrache ou régurgite le vaccin), une dose unique de remplacement peut être donnée lors de la même consultation, cependant cette pratique n’a pas été étudiée dans des essais cliniques. Si l’incident se reproduit, une dose additionnelle ne doit pas être donnée.
Il n’est pas recommandé d’administrer de dose supplémentaire après avoir terminé le schéma de vaccination en 3 doses (voir en rubriques 4.4 et 5.1 les informations disponibles sur la durée de la protection).
De 33 semaines à 18 ans
RotaTeq n'est pas indiqué dans cette tranche d'âge.
Mode d’administration
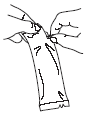
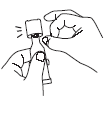
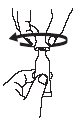
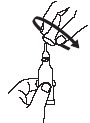
RotaTeq est utilisé en administration orale uniquement.
RotaTeq NE DOIT JAMAIS ETRE INJECTE.
RotaTeq peut être administré sans précaution particulière vis à vis de la nourriture, des liquides ou du lait maternel.
Voir rubrique 6.6 pour les instructions d’administration.
4.3 Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
![]() Hypersensibilité suite à une précédente administration de vaccin rotavirus.
Hypersensibilité suite à une précédente administration de vaccin rotavirus.
Antécédent d’invagination intestinale.
Nourrissons ayant une malformation congénitale de l’appareil gastro-intestinal pouvant prédisposer à une invagination intestinale.
Nourrissons ayant une immunodépression connue ou suspectée (voir rubrique 4.4 et 4.8).
L’administration de RotaTeq doit être différée chez les nourrissons ayant une maladie fébrile sévère aiguë grave. Une infection bénigne n’est pas une contre-indication à la vaccination.
L’administration de RotaTeq doit être différée chez les sujets présentant une diarrhée aiguë ou des vomissements.
4.8 Effets indésirables
a. Résumé du profil de tolérance
Les événements indésirables ont été étudiés dans un sous-groupe de nourrissons (n=6 130 recevant RotaTeq et 5 560 recevant un placebo) issus de 3 études cliniques contrôlées contre placebo. Les événements indésirables apparus dans les 42 jours suivant la vaccination avec RotaTeq, avec ou sans administration concomitante d’autres vaccins pédiatriques, ont été évalués. Au total, 47 % des nourrissons recevant RotaTeq ont présenté un effet indésirable comparé à 45,8 % des nourrissons recevant le placebo. Les effets indésirables les plus communément rapportés, qui sont survenus plus fréquemment avec le vaccin qu’avec le placebo, étaient fièvre (20,9 %), diarrhée (17,6 %) et vomissement (10,1 %).
Les effets indésirables graves ont été évalués chez tous les participants des 3 études cliniques (36 150 recevant RotaTeq et 35 536 recevant le placebo) jusqu’à 42 jours après chaque dose. Leur fréquence totale a été de 0,1 % pour les nourrissons recevant RotaTeq et 0,2 % pour les nourrissons recevant le placebo.
b. Résumé tabulé des effets indésirables
Les effets indésirables les plus fréquemment rapportés dans le groupe des vaccinés sont listés ci-dessous, par système classe-organe et fréquence. Sur la base de données issues de 3 essais cliniques au cours desquels 6 130 nourrissons ont reçu RotaTeq et 5 560 ont reçu le placebo, les effets indésirables listés ci-dessous sont survenus chez les nourrissons ayant reçu RotaTeq avec une augmentation de l’incidence entre 0,2 % et 2,5 % par rapport aux nourrissons ayant reçu le placebo.
Les fréquences sont rapportées comme :
Très fréquent ( 1/10), fréquent ( 1/100, 1/10), peu fréquent ( 1/1 000, 1/100), rare ( 1/10 000, 1/1 000), très rare ( 1/10 000), fréquence indéterminée (ne peut être estimée à partir des données disponibles)
Effets indésirables suivant l'administration de RotaTeq dans les essais cliniques et rapportés après commercialisation (en italique) | ||
Systèmes classe-organe | Fréquence | Evénement/effet indésirable |
Infections et infestations | Fréquent | Infection respiratoire haute |
Peu fréquent | Rhinopharyngite, otite moyenne | |
Affections du système immunitaire | Indéterminée | Réaction anaphylactique‡ |
Affections respiratoires, thoraciques et médiastinales | Rare | Bronchospasme |
Affections gastro-intestinales | Très fréquent | Diarrhées, vomissements |
Peu fréquent | Rectorragie†, douleur abdominale haute | |
| Très Rare | Invagination intestinale α * |
Affections de la peau et du tissu sous-cutané | Peu fréquent | Eruption |
Rare | Urticaire† | |
Indéterminée | Œdème de Quincke‡ | |
Troubles généraux et anomalies au site d'administration | Très fréquent | Fièvre |
Indéterminée | Irritabilité‡ | |
† Cet effet indésirable a été identifié lors de la surveillance après commercialisation
La catégorie de fréquence a été estimée à partir des données des essais cliniques.
α La catégorie de fréquence a été estimée à partir de données d'une étude observationnelle.
* Voir rubrique 4.4.
‡ Evénements indésirables observés après la mise sur le marché (leur fréquence ne peut pas être estimée sur la base des données disponibles).
c. Description d'effets indésirables sélectionnés
5 cas de la maladie de Kawasaki ont été rapportés sur 36 150 nourrissons ayant reçu le vaccin (<0,1%) et 1 cas sur 35 536 nourrissons ayant reçu le placebo (<0.1%) donnant un risque relatif (RR) de 4,9 [IC 95 %, 0,6 - 239,1] (non statistiquement significatif).
Aucun risque accru de maladie de Kawasaki n'a été observé chez les nourrissons ayant reçu RotaTeq lors d'une large étude observationnelle de surveillance de la tolérance après mise sur le marché (voir rubrique 5.1).
Invagination intestinale
Les données d'études observationnelles effectuées dans plusieurs pays indiquent que les vaccins contre le rotavirus entraînent une augmentation du risque d'invagination intestinale, jusqu'à 6 cas supplémentaires pour 100 000 nourrissons dans les 7 jours suivant la vaccination. Il existe des données limitées concernant une augmentation moindre du risque après la deuxième dose. L'incidence de base des invaginations intestinales chez les nourrissons de moins de 1 an variait dans ces pays de 25 à 101 pour 100 000 nourrissons par an. Il n'a pas été déterminé si les vaccins contre le rotavirus modifient l'incidence globale des invaginations intestinales sur des périodes de suivi plus longues (voir rubrique 4.4).
d. Autres populations particulières
Apnée chez les grands prématurés (nés à 28 semaines de grossesse ou moins) (voir rubrique 4.4).
Des gastro-entérites avec élimination dans les selles de virus vaccinal chez des nourrissons présentant un déficit immunitaire combiné sévère (DICS) ont été rapportées après commercialisation.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via via le système national de déclaration :
en Belgique: Agence fédérale des médicaments et des produits de santé, www.afmps.be. Division Vigilance : Site internet : www.notifieruneffetindesirable.be, e-mail: adr@fagg-afmps.be, au Luxembourg: Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé. Site internet: www.guichet.lu/pharmacovigilance.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Merck Sharp & Dohme B.V., Waarderweg 39, 2031 BN Haarlem, Pays-Bas
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
EU/1/06/348/001
EU/1/06/348/002
10. DATE DE MISE A JOUR DU TEXTE
04/2025
Des informations détaillées sur ce médicament sont disponibles sur le site Web de l'Agence européenne du Médicament http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2322436 | ROTATEQ 1 TUBE 1 DOSE 2ML | J07BH02 | € 52,98 | - | Oui | € 12,5 | € 7,82 |