1. DENOMINATION DU MEDICAMENT
Decapeptyl Sustained Release 3,75 mg poudre et solvant pour suspension injectable.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Flacon avec de la poudre : acétate de triptoréline correspondant à 4,2 mg de triptoréline (4,2 mg de principe actif par flacon d’injection permettent d'administrer une dose effective de 3,75 mg).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour suspension injectable.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Cancer de la prostate
- Traitement du cancer de la prostate hormonosensible localement avancé ou métastatique.
- En traitement néo-adjuvant, concomitant ou adjuvant à la radiothérapie dans le cancer de la prostate localisé à haut risque ou localement avancé (voir également rubrique 5.1).
Endométriose
Traitement de l’endométriose à localisation génitale et extragénitale.
Fibromes
Traitement des fibromes utérins préalablement à la chirurgie :
- si associés à une anémie (hémoglobine ≤ 8 g/dl)
- si la taille du fibrome doit être réduite pour faciliter ou permettre la chirurgie endoscopique ou transvaginale.
Infertilité féminine
Optimisation de la stimulation ovarienne par association de Decapeptyl Sustained Release et de gonadotrophines exogènes (HMG, FSH, HCG) dans le cadre d’une fécondation in vitro suivie d’un transfert d’embryons (FIVETE), un transfert intratubaire de gamètes (GIFT) ou un transfert intratubaire de zygotes (ZIFT).
Cancer du sein
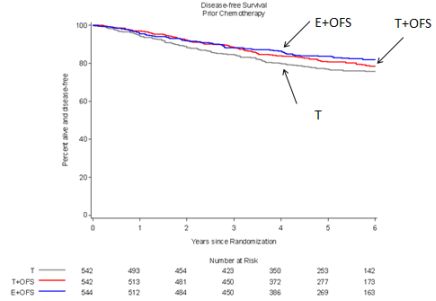
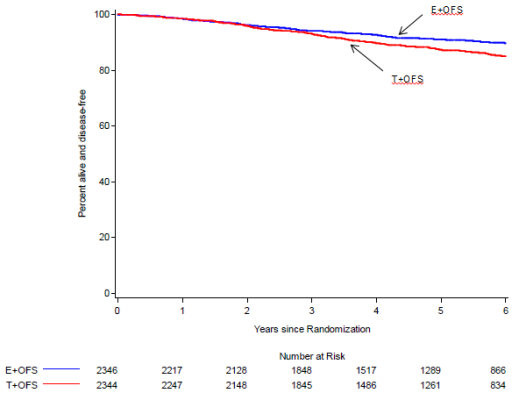
En association avec le tamoxifène ou un inhibiteur de l’aromatase, traitement adjuvant du cancer du sein de stade précoce et répondant à l’hormonothérapie, chez les femmes présentant un risque élevé de récurrence et un statut de pré-ménopause confirmé après la fin de la chimiothérapie (voir rubriques 4.3, 4.4, 4.8 et 5.1).
Puberté précoce d’origine centrale
Avant 8 ans chez la fille et de 10 ans chez le garçon.
4.2 Posologie et mode d'administration
Posologie
Parce que Decapeptyl Sustained Release 3,75 mg est une suspension de microsphères, l'injection intravasculaire involontaire est absolument à éviter.
Decapeptyl Sustained Release 3,75 mg doit être administré sous la supervision d'un médecin.
Aucun ajustement posologique n'est requis chez les patients dont la fonction rénale ou hépatique est diminuée
Il est important d’effectuer les injections en suivant rigoureusement les instructions de la notice.
Toute mauvaise manipulation conduisant à la perte d'une quantité de suspension supérieure à celle qui reste normalement dans le matériel utilisé pour l'injection doit être signalée.
Une fois la suspension préparée, elle doit être injectée immédiatement par voie intramusculaire profonde.
Cancer de la prostate
Une injection intramusculaire de Decapeptyl Sustained Release toutes les 4 semaines.
Durée du traitement : voir rubrique 5.1.
Endométriose
1 injection intramusculaire de Decapeptyl Sustained Release toutes les 4 semaines.
Le traitement doit être entamé dans les 5 premiers jours du cycle.
La durée du traitement dépend de la gravité initiale de l’endométriose et de l’évolution des manifestations cliniques (fonctionnelles et anatomiques) pendant le traitement. En principe, elle est de 4 à 6 mois. La durée du traitement est limitée à 6 mois (voir rubrique 4.8). Il n'est pas souhaitable d'entreprendre une deuxième cure par la triptoréline ou par les autres analogues de la GnRH. Chez les patientes avec une endométriose traitée par les analogues de la GnRH, il a été montré que l’ajout d’une add-back therapy (ABT –un œstrogène et un progestatif) réduisait la perte de densité minérale osseuse et les symptômes vasomoteurs. Par conséquent, le cas échéant, l’ABT doit être administrée en association à l’analogue de la GnRH en tenant compte des risques et des bénéfices de chaque traitement.
Fibrome
1 injection intramusculaire avec Decapeptyl Sustained Release toutes les 4 semaines.
Le traitement doit être entamé dans les 5 premiers jours du cycle menstruel. La durée du traitement ne peut pas dépasser 3 mois.
Infertilité féminine
1 injection intramusculaire de Decapeptyl Sustained Release à partir du deuxième jour du cycle.
En général, la stimulation par les gonadotrophines est pratiquée quand le taux d’œstrogènes est inférieur à 50 pg/ml (en général vers le 15e jour).
Cancer du sein
Une injection intramusculaire toutes les 4 semaines, en association avec le tamoxifène ou un inhibiteur de l’aromatase.
Le traitement par triptoréline doit débuter après la fin de la chimiothérapie, dès que le statut de pré-ménopause a été confirmé (voir rubrique 4.4).
Le traitement par triptoréline doit être instauré au moins 6 à 8 semaines avant le début du traitement par l’inhibiteur de l’aromatase. Au moins deux injections de triptoréline (en respectant un intervalle de 4 semaines entre les injections) doivent être administrées avant le début du traitement par l’inhibiteur de l’aromatase.
Pendant le traitement par l’inhibiteur de l’aromatase, l’administration de triptoréline ne doit pas être interrompue afin d’éviter toute augmentation rebond des taux circulants d’œstrogènes chez les femmes non ménopausées.
Dans le cadre d’un traitement adjuvant en association avec une autre hormonothérapie, la durée de traitement recommandée est de maximum 5 ans.
Population pédiatrique
Puberté précoce d’origine centrale
Le traitement des enfants par la triptoréline doit se faire sous la supervision d’un pédiatre endocrinologue, d’un pédiatre ou d’un endocrinologue ayant l’expérience du traitement de la puberté précoce d’origine centrale.
Enfant pesant plus de 30 kg : 1 injection intramusculaire toutes les 4 semaines (28 jours).
Enfant pesant entre 20 et 30 kg : deux tiers de la dose par voie intramusculaire, toutes les 4 semaines (28 jours) ; il faut donc administrer deux tiers du volume de la suspension reconstituée.
Enfant pesant moins de 20 kg : la moitié de la dose par voie intramusculaire, toutes les 4 semaines (28 jours) : il faut donc administrer la moitié du volume de la suspension reconstituée.
Le traitement doit être arrêté aux alentours de l’âge physiologique de la puberté chez les garçons et les filles, et il est recommandé de ne pas poursuivre le traitement chez les filles présentant une maturation osseuse correspondant à un âge de plus de 12-13 ans. Les données disponibles sont limitées concernant le moment optimal pour arrêter le traitement chez les garçons en fonction de l’âge osseux, mais il est conseillé d’arrêter le traitement chez les garçons présentant une maturation osseuse correspondant à un âge de 13-14 ans.
4.3 Contre-indications
Hypersensibilité à la GnRH, aux agonistes de la GnRH ou à l’un des excipients mentionnés à la rubrique 6.1.
Grossesse et allaitement.
Dans le cadre d’un cancer du sein chez une femme non ménopausée : Instauration du traitement par un inhibiteur de l’aromatase avant l’obtention d’une suppression ovarienne adéquate par la triptoréline (voir rubriques 4.2 et 4.4).
4.8 Effets indésirables
Expérience au cours des études cliniques
Tolérance générale chez l’homme (voir rubrique 4.4)
Les patients atteints d'un cancer de la prostate hormonodépendant localement avancé ou métastatique étant généralement âgés et présentant d'autres affections fréquemment rencontrées dans cette population âgée, plus de 90% des patients inclus dans les études cliniques ont rapporté des événements indésirables; souvent, le lien de causalité est difficile à évaluer. Comme cela s’observe également avec d’autres traitements par des agonistes de la GnRH ou après une castration chirurgicale, les événements indésirables les plus fréquemment observés en relation avec un traitement par la triptoréline étaient dus à ses effets pharmacologiques attendus. Ces effets incluaient des bouffées de chaleur et une diminution de la libido.
À l'exception des réactions immuno-allergiques (rares) et des réactions à l'endroit de l'injection (< 5%), tous les événements indésirables sont connus pour être liés aux modifications du taux de testostérone.
Les réactions indésirables suivantes, considérées comme pouvant au minimum être liées au traitement par la triptoréline, ont été rapportées. La plupart de ces événements sont connus pour être liés à la castration biochimique ou chirurgicale.
La fréquence des effets indésirables est classée de la façon suivante : très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥1/1.000 à <1/100) ; rare (≥1/10.000 à <1/1.000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Classes de systèmes d’organes | Très fréquent | Fréquent | Peu fréquent | Rare | Autres effets indésirables observés après la commercialisation |
Infections et infestations |
|
| Nasopharyngite |
| |
Affections hématologiques et du système lymphatique |
| Thrombocytose |
| Anémie | |
Affections du système immunitaire | Hypersensibilité |
| Réaction anaphylactique | Choc anaphylactique | |
Troubles du métabolisme et de la nutrition |
| Anorexie |
|
| |
Affections psychiatriques | Diminution de la libido | Dépression* | Insomnie | Confusion | Anxiété |
Affections du système nerveux | Paresthésies dans les membres inférieurs | Vertiges | Paresthésies | Trouble de la mémoire |
|
Affections oculaires |
| Altération de la vision | Sensation anormale au niveau des yeux |
| |
Affections de l’oreille et du labyrinthe |
| Acouphènes Vertiges |
|
| |
Affections endocriniennes |
|
|
| Apoplexie hypophysaire** | |
Affections cardiaques |
| Palpitations |
| Allongement du QT* (voir rubriques 4.4 et 4.5) | |
Affections vasculaires | Bouffées de chaleur | Hypertension |
| Hypotension |
|
Affections respiratoires, thoraciques et médiastinales |
|
| Dyspnée Epistaxis | Orthopnée |
|
Affections gastro-intestinales | Sécheresse buccale | Douleurs abdominales | Distension abdominale |
| |
Affections de la peau et du tissu sous-cutané | Hyperhidrose |
| Acné | Formation de vésicules | Œdème angioneurotique |
Affections musculo-squelettiques et systémiques | Dorsalgie | Douleur musculo-squelettique | Arthralgies | Rigidité articulaire |
|
Affections du rein et des voies urinaires |
| Nycturie |
| Incontinence urinaire | |
Affections des organes de reproduction et du sein | Dysfonction érectile (y compris incapacité à éjaculer, troubles de l'éjaculation) | Douleurs pelviennes | Gynécomastie |
|
|
Troubles généraux et anomalies au site d’admini-stration | Asthénie | Réaction au site d'injection (y compris érythème, inflammation et douleur) | Léthargie | Douleur thoracique | Malaise |
Investigations | Augmentation du poids | Augmentation des GPT | Augmentation des phosphatases alcalines dans le sang |
|
*Cette fréquence s’appuie sur les fréquences des effets de classe communes à tous les agonistes de la GnRH.
** Rapporté après l’administration initiale chez des patients avec un adénome hypophysaire
La triptoréline induit une augmentation passagère des taux circulants de testostérone au cours de la première semaine qui suit la première injection de la forme à libération prolongée. Du fait de cette augmentation initiale des taux circulants de testostérone, un petit pourcentage de patients (≤ 5%) peut ressentir une aggravation temporaire des signes et symptômes du cancer de la prostate (flambée de la tumeur), ce qui se manifeste habituellement par une augmentation des symptômes urinaires (< 2%) et des douleurs métastatiques (5%). Ceux-ci peuvent être traités de façon symptomatique. Ces symptômes sont passagers et disparaissent habituellement en une à deux semaines.
Des cas isolés d’aggravation des symptômes de la maladie, soit une obstruction de l’urètre ou une compression de la moelle épinière par une métastase ont été observés. C’est pourquoi, les patients présentant des métastases vertébrales et/ou une obstruction des voies urinaires supérieures ou inférieures seront étroitement suivis au cours de la première semaine de traitement (voir rubrique 4.4).
L’utilisation d’agonistes de la GnRH, en tant que traitement d’un cancer de la prostate peut s’accompagner d’une augmentation de la perte osseuse et peut entraîner une ostéoporose et une augmentation du risque de fracture osseuse.
Les patients qui reçoivent un traitement de longue durée au moyen d'analogues de la GnRH en association avec une radiothérapie peuvent présenter davantage d'effets indésirables, principalement des effets gastro-intestinaux et des effets en rapport avec la radiothérapie.
Une augmentation du nombre de lymphocytes a été signalée chez les patients sous traitement par un analogue de la GnRH. Cette lymphocytose secondaire est apparemment liée à la castration induite par la GnRH et semble indiquer que les hormones d’origine gonadique sont impliquées dans l’involution du thymus.
Tolérance générale chez la femme (voir rubrique 4.4)
Suite à la diminution des taux d’œstrogènes, les effets indésirables les plus fréquemment signalés (attendus chez au moins 10% des femmes) étaient des maux de tête, une diminution de la libido, des troubles du sommeil, des troubles de l’humeur, une dyspareunie, des dysménorrhées, des saignements génitaux, un syndrome d’hyperstimulation ovarienne, une hypertrophie ovarienne, des douleurs pelviennes, séborrhée, une sécheresse vulvo-vaginale, une hyperhidrose, des bouffées de chaleur et de l’asthénie.
Les réactions indésirables suivantes, considérées comme pouvant être liées au traitement par la triptoréline, ont été rapportées.
La fréquence des effets indésirables est classée comme suit : très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥1/1.000 à <1/100) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Classes de systèmes d’organes | Très fréquent | Fréquent | Peu fréquent | Autres effets indésirables observés après la commercialisation |
Affections du système immunitaire |
| Hypersensibilité |
| Choc anaphylactique |
Troubles du métabolisme et de la nutrition |
|
| Diminution de l'appétit |
|
Affections psychiatriques | Trouble du sommeil (y compris insomnie) | Dépression* | Labilité émotionnelle | Confusion |
Affections du système nerveux | Céphalées | Vertiges | Dysgeusie | Convulsions**** |
Affections oculaires |
|
| Sécheresse oculaire | Troubles visuels |
Affections de l’oreille et du labyrinthe |
|
| Vertiges |
|
Classes de systèmes d’organes | Très fréquent
| Fréquent
| Peu fréquent | Autres effets indésirables observés après la commercialisation Fréquence indéterminée |
Affections endocriniennes |
|
|
| Apoplexie hypophysaire*** |
Affections cardiaques |
|
| Palpitations |
|
Affections vasculaires | Bouffées de chaleur |
|
| Hypertension |
Affections respiratoires, thoraciques et médiastinales |
|
| Dyspnée |
|
Affections gastro-intestinales |
| Nausées | Distension abdominale | Diarrhées |
Affections de la peau et du tissu sous cutané | Acné |
| Alopécie | Œdème angioneurotique |
Affections musculo-squelettiques et systémiques |
| Arthralgies | Dorsalgies Myalgies | Faiblesse musculaire |
Classes de systèmes d’organes | Très fréquent | Fréquent | Peu fréquent | Autres effets indésirables observés après la commercialisation |
Affections des organes de reproduction et du sein | Troubles mammaires | Douleur mammaire | Saignements lors du coït | Aménorrhée |
Troubles généraux et anomalies au site d’administration | Asthénie | Réaction au site d'injection (y compris douleur, œdème, érythème et inflammation) |
| Pyrexie |
Investigations |
| Augmentation du poids | Diminution du poids | Augmentation des phosphatases alcalines dans le sang |
*Utilisation à long terme : cette fréquence s’appuie sur les fréquences des effets de cette classe de médicaments et qui sont communes à tous les agonistes de la GnRH.
**Utilisation à court terme : cette fréquence s’appuie sur les fréquences des effets de cette classe de médicaments et qui sont communes à tous les agonistes de la GnRH.
***Rapporté après l’administration initiale chez des patients avec un adénome hypophysaire
****Après la mise sur le marché, des convulsions ont été signalées chez des patients recevant des analogues de la GnRH, dont la triptoréline.
Au début du traitement, les symptômes d’endométriose y compris les douleurs pelviennes et les dysménorrhées peuvent très fréquemment (≥ 10%) être exacerbées au cours de l’augmentation initiale temporaire des taux plasmatiques de l’œstradiol. Ces symptômes sont passagers et disparaissent habituellement en une à deux semaines.
Des saignements génitaux, y compris des ménorragies et des métrorrhagies, peuvent survenir dans le mois suivant la première injection.
Lorsque ce médicament est utilisé dans le cadre du traitement de l’infertilité, l’association avec des gonadotrophines peut entraîner un syndrome d’hyperstimulation ovarienne. Une hypertrophie ovarienne, des douleurs pelviennes et/ou abdominales peuvent être observées.
Cancer du sein
Au cours des études TEXT et SOFT, les effets indésirables les plus fréquemment observés en cas d'association de la triptoréline avec le tamoxifène ou un inhibiteur de l’aromatase, pendant une durée allant jusqu’à 5 ans, étaient : bouffées vasomotrices, affection musculo-squelettique, fatigue, insomnie, hyperhidrose, sécheresse vulvovaginale et dépression.
Le tableau suivant présente les fréquences des effets indésirables signalés en cas d’association de la triptoréline avec le tamoxifène (N = 2325) ou l’exémestane (N = 2318). La classification des fréquences est la suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1.000, < 1/100), rare (≥ 1/10.000, < 1/1.000); fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Classes de systèmes d’organes | Très fréquent | Fréquent | Peu fréquent | Autres effets indésirables observés après la commercialisation |
Affections cardiaques |
|
| Ischémie myocardique | Allongement de l'intervalle QT |
Troubles du métabolisme et de la nutrition |
| Diabète sucré (intolérance au glucose) |
|
|
Affections gastro-intestinales | Nausées |
|
|
|
Troubles généraux et anomalies au site d'administration | Fatigue | Réaction au site d’injection |
|
|
Affections du système immunitaire |
| Hypersensibilité |
|
|
Affections musculo-squelettiques et systémiques | Affection musculo-squelettique | Fracture |
|
|
Affections du système nerveux |
|
| Ischémie cérébrale |
|
Affections psychiatriques | Insomnie |
|
|
|
Affections du rein et des voies urinaires | Incontinence urinaire |
|
|
|
Affections des organes de reproduction et du sein | Dyspareunie |
|
|
|
Affections de la peau et du tissu sous-cutané | Hyperhidrose |
|
|
|
Affections vasculaires | Bouffées vasomotrices | Embolie |
|
|
Les EI identifiés ci-dessus doivent être mentionnés en complément des EI de la triptoréline identifiés chez les hommes et les femmes, qui sont décrits dans les tableaux ci-dessus, en vue de décrire le profil total d’EI lié à l’association d’un médicament inducteur d’une SFO avec l’exémestane ou le tamoxifène.
En cas d’association de triptoréline et d’exémestane, on signale une fréquence plus élevée d’ostéoporose qu’avec l’association au tamoxifène (39% contre 25%) (voir rubrique 4.4).
Les affections musculo-squelettiques et les fractures ont également été plus fréquemment signalées en cas d'association à l’exémestane qu’avec l'association au tamoxifène (respectivement 89% contre 76% et 6,8% contre 5,2%).
En cas d'association de triptoréline avec l’exémestane ou le tamoxifène, une hypertension a été mentionnée en tant qu’effet indésirable ciblé, à une fréquence définie comme « très fréquente » (respectivement 23% et 22%).
En cas d'association de triptoréline avec l’exémestane ou le tamoxifène, une hyperglycémie et un diabète ont été signalés en tant qu’effets indésirables ciblés, à une fréquence définie comme « fréquente » (hyperglycémie : respectivement 2,6% et 3,4% ; diabète : respectivement 2,3% et 2,3%).
Tolérance générale chez la population pédiatrique (voir rubrique 4.4)
La fréquence des effets indésirables est classée comme suit : très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥ 1/1000 à <1/100); fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Classes de systèmes d’organes | Très fréquent | Fréquent | Peu fréquent | Autres effets indésirables observés après la commercialisation |
Affections du système immunitaire |
| Hypersensibilité |
| Choc anaphylactique |
Métabolisme et troubles de la nutrition |
|
| Obésité |
|
Affections psychiatriques |
|
| Modifications de l'humeur | Labilité émotionnelle |
Affections du système nerveux |
| Céphalées |
| Hypertension intracrânienne idiopathique (pseudotumor cerebri) (voir rubrique 4.4) |
Affections oculaires |
|
| Détérioration de la vision | Troubles visuels |
Affections vasculaires |
| Bouffées de chaleur |
| Hypertension |
Affections respiratoires, thoraciques et médiastinales |
|
| Épistaxis |
|
Affections gastro-intestinales |
| Douleurs abdominales | Vomissements |
|
Affections de la peau et du tissu sous-cutané |
| Acné | Prurit | Œdème angioneurotique |
Affections musculo-squelettiques et systémiques |
|
| Douleurs cervicales | Myalgies |
Affections des organes de reproduction et du sein | Saignements vaginaux (y compris hémorragies vaginales, hémorragies de privation, saignements utérins), pertes vaginales, saignements vaginaux (y compris spotting) | | Douleurs mammaires |
|
Troubles généraux et anomalies au site d’administration |
| Réaction au site d'injection (y compris douleur, érythème et inflammation) | Malaise |
|
Investigations |
| Augmentation du poids |
| Augmentation de la prolactinémie |
*Après la mise sur le marché, des convulsions ont été signalées chez des patients recevant des analogues de la GnRH, dont la triptoréline.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via:
Belgique
Agence fédérale des médicaments et des produits de santé. www.afmps.be. Division Vigilance: Site internet: www.notifieruneffetindesirable.be, e-mail: adr@fagg-afmps.be.
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé. Site internet : www.guichet.lu/pharmacovigilance.
7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHE
IPSEN nv
Treurenberg 2 - 4, boîte 4
1000 Bruxelles
8. NUMERO(S) D'AUTORISATION DE MISE SUR LE MARCHE
BE145826
LU: 1996035542
● Numéro national 0299942: 1 flacon
10. DATE DE MISE A JOUR DU TEXTE
Date d’approbation : 10/2025
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 0676882 | DECAPEPTYL SR 3,75MG FL LYO IM SOL | L02AE04 | € 93,82 | - | Oui | € 2 | € 1 |