1. DÉNOMINATION DU MÉDICAMENT
Somatuline Autogel Injectable 60 mg / 90 mg / 120 mg
solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lanréotide 60 mg, 90 mg, 120 mg, sous forme d’acétate de lanréotide.
Chaque seringue préremplie contient une solution sursaturée d’acétate de lanréotide correspondant à 0,246 mg de lanréotide base/mg de solution, ce qui garantit respectivement l’injection réelle d’une dose de 60 mg, 90 mg et 120 mg de lanréotide.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution injectable en seringue préremplie.
Solution blanche à jaune pâle, visqueuse et sursaturée.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Somatuline Autogel Injectable est indiqué :
- dans le traitement à long terme de l’acromégalie lorsque les taux d’hormone de croissance (GH) et/ou d’insulin-like growth factor (IGF-1) ne sont pas normalisés après chirurgie et/ou radiothérapie, ou lorsque la chirurgie et/ou la radiothérapie ne peuvent pas être envisagés. Le but du traitement dans l’acromégalie est de baisser les taux d’hormone de croissance (GH) et d’IGF-1 et, si possible, de les normaliser.
- pour diminuer les symptômes de l’acromégalie.
- pour le traitement des symptômes cliniques, notamment les bouffées vasomotrices et la diarrhée, associés aux tumeurs carcinoïdes qui ne peuvent pas être traitées chirurgicalement.
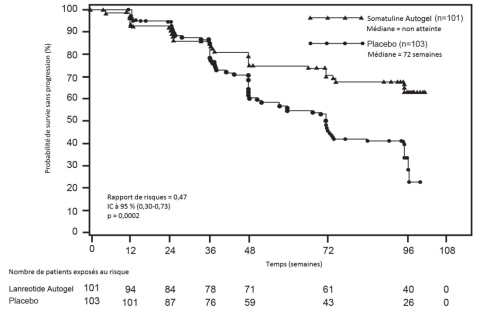
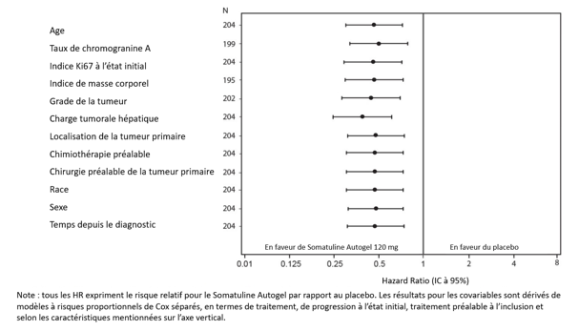
- pour le traitement des tumeurs neuroendocrines gastro-entéro-pancréatiques (TNE-GEP) dont l’origine se situe au niveau de l’intestin moyen ou du pancréas ou est inconnue, lorsqu’une origine au niveau de l’intestin postérieur a été exclue, de grade 1 et d’un sous-groupe de grade 2 (indice Ki67 jusqu’à 10%), chez les patients adultes ayant une maladie localement avancée non résécable ou métastatique (voir rubrique 5.1).
4.2 Posologie et mode d’administration
Posologie
Somatuline Autogel Injectable est disponible en trois dosages avec 60 mg, 90 mg et 120 mg de lanréotide.
Acromégalie
La dose initiale recommandée est comprise entre 60 et 120 mg, à administrer tous les 28 jours.
Par la suite, la dose devra être adaptée individuellement en fonction de la réponse du patient (évaluée par la diminution des symptômes et/ou la réduction des taux de GH et/ou d’IGF-1).
Si la réponse désirée n’est pas obtenue, la dose pourra être augmentée.
La dose peut être augmentée lorsque les concentrations de GH sont supérieures à 2,5 ng/ml.
Lorsque les concentrations de GH sont comprises entre 2,5 ng/ml et 1 ng/ml, la dose peut être maintenue si le taux d'IGF-1 ajusté à l'âge est normal.
En cas de contrôle complet (basé sur des taux de GH inférieurs à 1 ng/ml, une normalisation des taux d’IGF-1 et/ou une disparition des symptômes), la dose pourra être diminuée.
Des patients, qui sont bien contrôlés par un analogue de la somatostatine, peuvent être traités par Somatuline Autogel Injectable 120 mg tous les 42 à 56 jours. Par exemple, les patients bien contrôlés par la Somatuline Autogel Injectable 60 mg administrée tous les 28 jours, peuvent être traités par Somatuline Autogel Injectable 120 mg tous les 56 jours et les patients bien contrôlés par la Somatuline Autogel Injectable 90 mg administrée tous les 28 jours, peuvent être traités par Somatuline Autogel Injectable 120 mg tous les 42 jours.
Une surveillance à long terme des symptômes, des taux de GH et d’IGF-1, doit être effectuée en fonction de l’indication clinique.
Symptômes associés aux tumeurs carcinoïdes
La dose initiale recommandée est comprise entre 60 à 120 mg, à administrer tous les 28 jours.
La dose doit être adaptée en fonction du degré de diminution des symptômes qui sera obtenu. La dose maximale recommandée est de 120 mg de Somatuline Autogel Injectable tous les 28 jours.
Des patients, qui sont bien contrôlés par un analogue de la somatostatine, peuvent être traités par Somatuline Autogel Injectable 120 mg tous les 42 à 56 jours. Par exemple, les patients bien contrôlés par la Somatuline Autogel Injectable 60 mg administrée tous les 28 jours, peuvent être traités par Somatuline Autogel Injectable 120 mg tous les 56 jours et les patients bien contrôlés par la Somatuline Autogel Injectable 90 mg administrée tous les 28 jours, peuvent être traités par Somatuline Autogel Injectable 120 mg tous les 42 jours. Une surveillance étroite des symptômes doit être effectuée lorsque le traitement est modifié pour passer à l’intervalle posologique étendu.
Tumeurs neuroendocrines gastro-entéro-pancréatiques (TNE-GEP’s) dont l’origine se situe au niveau de l’intestin moyen ou du pancréas ou est inconnue, lorsqu’une origine au niveau de l’intestin postérieure a été exclue, de grade 1 et d’un sous-groupe de grade 2 (indice Ki67 jusqu’à 10 %), chez les patients adultes ayant une maladie localement avancée non résécable ou métastatique
La dose recommandée est d’une seule injection de Somatuline Autogel Injectable 120 mg, à administrer tous les 28 jours. Le traitement par Somatuline Autogel Injectable doit être poursuivi pendant toute la durée nécessaire au contrôle de la tumeur.
Insuffisance rénale et/ou hépatique
Chez les patients présentant une insuffisance rénale ou hépatique, il n’est pas nécessaire d’ajuster la posologie compte tenu de la large fenêtre thérapeutique du lanréotide (voir rubrique 5.2 Propriétés pharmacocinétiques).
Sujets âgés
Chez le sujet âgé, aucun ajustement posologique n’est nécessaire compte tenu de la fenêtre thérapeutique large du lanréotide (voir rubrique 5.2 Propriétés pharmacocinétiques).
Population pédiatrique
La sécurité et l'efficacité de Somatuline Autogel Injectable chez l'enfant et l'adolescent n'ont pas été établies.
Mode d’administration
Somatuline Autogel Injectable doit être administré en injection sous-cutanée profonde dans le quadrant supérieur externe du muscle fessier ou dans le haut de la face externe de la cuisse.
Les patients recevant une dose fixe de Somatuline Autogel Injectable, le produit peut être administré soit par le patient, soit par une personne de son entourage après une formation appropriée par un professionnel de santé. Dans le cas d’une auto-injection, celle-ci devra être réalisée dans la région supérieure externe de la cuisse.
La décision d’administration par le patient ou par une autre personne formée devra être prise par le professionnel de santé.
Quel que soit le site d’injection, la peau ne doit pas être pincée et l’aiguille doit être introduite rapidement sur toute sa longueur, perpendiculairement à la peau.
Le site d’injection doit alterner entre le côté droit et le côté gauche.
4.3 Contre-indications
Hypersensibilité à la substance active, à la somatostatine ou des peptides apparentés, ou à l'un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Les effets indésirables ayant été mentionnés au cours d’études cliniques par des patients atteints d’acromégalie ou de TNE-GEP traités par lanréotide sont listés par système/classe d’organes selon les fréquences suivantes : très fréquent (≥ 1/10); fréquent (≥ 1/100, < 1/10); peu fréquent (≥ 1/1000, < 1/100); fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Les effets indésirables les plus fréquents lors du traitement par lanréotide sont les troubles gastro-intestinaux (le plus souvent diarrhée et douleurs abdominales, habituellement légères à modérées et transitoires), la lithiase biliaire (souvent asymptomatique) et les réactions au site d’injection (douleur, nodule et induration).
Le profil de tolérance observé dans toute indication est similaire.
Système/classe d’organes | Très fréquent (≥1/10) | Fréquent (≥1/100, <1/10) | Peu fréquent (≥1/1000, <1/100) | Expérience post-commercialisa-tion (fréquence indéterminée) |
Affections du système immunitaire |
|
|
| Réactions allergiques (incluant angio-œdème, anaphylaxie, hypersensibilité) |
Troubles du métabolisme et de la nutrition |
| Hypoglycémie, diminution d’appétit**, hyperglycémie, diabète |
|
|
Affections psychiatriques |
|
| Insomnie* |
|
Affections du système nerveux |
| Sensations vertigineuses, céphalées, |
|
|
Affections cardiaques |
| Bradycardie sinusale* |
|
|
Affections vasculaires |
|
| Bouffées de chaleur* |
|
Affections gastro-intestinales | Diarrhée, selles molles*, douleurs abdominales | Nausées, vomissements, constipation, flatulence, | Selles décolorées* | Insuffisance pancréatique exocrine, pancréatite |
Affections hépatobiliaires | Lithiase biliaire | Dilatation biliaire* |
| Cholécystite, |
Affections de la peau et du tissu sous-cutané |
| Alopécie, hypotrichose* |
|
|
Affections musculosquelettiques et du tissu conjonctif |
| Douleur musculosquelettique**, myalgie** |
|
|
Troubles généraux et anomalies au site d’administration |
| Asthénie, |
| Abcès au site d’injection |
Investigations |
| Elévation des GPT/ALAT*, anomalies des GOT/ASAT* | Elévation des GOT/ASAT*, élévation des phosphatases alcalines dans le sang*, bilirubinémie anormale*, diminution de la natrémie* |
|
* sur la base d’une méta-analyse d’études réalisées chez des patients atteints d’acromégalie
** sur la base d’une méta-analyse d’études réalisées chez des patients ayant des TNE-GEP
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé, Division Vigilance. Avenue Galilée 5/03, 1210 BRUXELLES. Site internet: www.notifieruneffetindesirable.be. e-mail: adr@afmps.be.
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé. Site internet : www.guichet.lu/pharmacovigilance.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
IPSEN nv
Guldensporenpark 87
9820 Merelbeke
Belgique
8. NUMÉROS D’AUTORISATION DE MISE SUR LE MARCHÉ
Somatuline Autogel Injectable 60 mg solution injectable en seringue préremplie :
BE234062
LU : 2003020040
● Numéro national 0340792 : 1 seringue
Somatuline Autogel Injectable 90 mg solution injectable en seringue préremplie :
BE234071
LU : 2003020041
● Numéro national 0340808 : 1 seringue
Somatuline Autogel Injectable 120 mg solution injectable en seringue préremplie :
BE234087
LU : 2003020042
● Numéro national 0340811 : 1 seringue
10. DATE DE MISE A JOUR DU TEXTE
Date d’approbation : 09/2023
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1720424 | SOMATULINE AUTOGEL INJECT 60 MG SER 1X0,5ML | H01CB03 | € 673,24 | - | Oui | € 12,5 | € 8,3 |
| 1720432 | SOMATULINE AUTOGEL INJECT 120 MG SER 1X0,5ML | H01CB03 | € 1023,88 | - | Oui | € 12,5 | € 8,3 |
| 1720440 | SOMATULINE AUTOGEL INJECT 90 MG SER 1X0,5ML | H01CB03 | € 804,64 | - | Oui | € 12,5 | € 8,3 |