1. DÉNOMINATION DU MÉDICAMENT
Dysport 500 U, poudre pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
500 U de Clostridium botulinum type A, complexe toxine-hémagglutinine par flacon.
1 ng correspond à 40 unités.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre pour solution injectable.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
- Blépharospasmes chez l’adulte
- Spasmes hémifaciaux chez l’adulte
- Torticolis spasmodique chez l’adulte
- Déformation dynamique du pied en équin induite par la spasticité chez les patients âgés de 2 ans et plus, présentant une infirmité motrice cérébrale
- Traitement symptomatique de la spasticité focale des membres supérieurs chez les patients pédiatriques âgés de deux ans et plus, présentant une infirmité motrice cérébrale
- Traitement symptomatique de la spasticité focale des membres supérieurs chez l'adulte
- Traitement symptomatique de la spasticité focale de l'articulation de la cheville chez l'adulte
- Hyperhidrose axillaire
- Incontinence urinaire chez l’adulte ayant une hyperactivité neurogène du détrusor résultant d’une lésion de la moelle épinière (traumatique ou non traumatique) ou de la sclérose en plaques, qui réalise régulièrement un sondage vésicale stérile intermittent (‘clean intermittent catheterisation’, CIC).
Remarque:
Avant de commencer le traitement par Dysport, le patient doit être informé de l'existence d'autres options thérapeutiques (médicamenteuses, chirurgicales) et du fait que tous les patients ne répondent pas au traitement par Dysport. Il se peut que certains patients ne constatent qu’un soulagement partiel des symptômes.
4.2 Posologie et mode d’administration
Les unités sont spécifiques pour un produit et ne sont pas interchangeables avec celles d'autres produits de toxine botulique.
Dysport ne peut être administré que par des médecins correctement formés dans ce domaine.
Nettoyer à l'alcool la partie centrale du bouchon en caoutchouc du flacon avant de le percer. Il faut utiliser une aiguille stérile de 23 ou 25 Gauge.
Sauf pour l’indication d’incontinence urinaire résultant d’une hyperactivité neurogène du détrusor (pour laquelle des instructions spécifiques suivent par après), les instructions de reconstitution pour l’obtention des concentrations spécifiques à chaque indication sont les suivantes:
Posologie obtenue (U/ par ml) | Diluant* par flacon de 500 U |
500 U | 1 ml |
200 U | 2,5 ml |
100 U | 5 ml |
*solution injectable de chlorure de sodium à 0,9% (9 mg/ml) sans conservateur
Pour le traitement de la spasticité chez les enfants atteints d’infirmité motrice cérébrale, la posologie étant calculée en unités par kg de poids corporel, une dilution supplémentaire peut s’avérer nécessaire pour obtenir le volume d’injection final.
Instructions de dilution pour l’incontinence urinaire résultant d’une hyperactivité neurogène du détrusor :
Le résultat global après la préparation est de répartir de manière égale le volume requis de 15 ml de solution injectable reconstituée de Dysport dans deux seringues de 10 ml : chaque seringue contenant 7,5 ml de solution reconstituée de Dysport à la même concentration.
Après la reconstitution dans la seringue, le produit doit être immédiatement utilisé.
- Pour la dose de 600 U :
Reconstituer deux flacons de 500 U, chacun avec 2,5 ml de solution injectable de chlorure de sodium à 0,9% (9 mg/ml) sans conservateur.
Dans la première seringue de 10 ml, prélever 1,5 ml du premier flacon et dans la seconde seringue de 10 ml, prélever 1,5 ml du second flacon.
Terminer la reconstitution en ajoutant 6 ml de solution injectable de chlorure de sodium à 0,9% (9 mg/ml) sans conservateur dans les deux seringues et mélanger doucement.
On obtient ainsi deux seringues de 10 ml, contenant chacune 7,5 ml et fournissant un total de 600 U de solution reconstituée de Dysport.
- Pour la dose de 800 U :
Reconstituer deux flacons de 500 U, chacun avec 2,5 ml de solution injectable de chlorure de sodium à 0,9% (9 mg/ml) sans conservateur.
Dans la première seringue de 10 ml, prélever 2 ml du premier flacon et dans la seconde seringue de 10 ml, prélever 2 ml du second flacon.
Terminer la reconstitution en ajoutant 5,5 ml solution injectable de chlorure de sodium à 0,9% (9 mg/ml) sans conservateur dans les deux seringues et mélanger doucement.
On obtient ainsi deux seringues de 10 ml, contenant chacune 7,5 ml et fournissant un total de 800 U de solution reconstituée de Dysport.
Blépharospasmes et spasmes hémifaciaux
Posologie
Dans une étude clinique visant à déterminer la dose de Dysport dans le traitement du blépharospasme essentiel bénin, une dose de 40 unités par œil s’est montrée très efficace. Une dose de 80 unités par œil a prolongé l’effet. Mais, l’incidence des effets indésirables locaux, en particulier le ptosis, était liée à la dose. Dans le traitement des blépharospasmes et des spasmes hémifaciaux, la dose maximale ne peut dépasser la dose totale de 120 unités par œil.
Injecter une dose de 10 unités (0,05 ml) dans la partie médiane et une dose de 10 unités (0,05 ml) dans la partie latérale de la jonction entre les zones préseptales et orbitales des muscles orbiculaires supérieurs (3 et 4) et inférieurs (5 et 6) de chaque œil.
Afin de réduire le risque de ptose, il convient d’éviter les injections à proximité du muscle élévateur de la paupière supérieure.
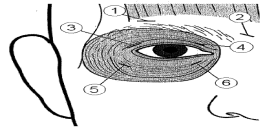
Lors des injections dans la paupière supérieure, l'aiguille doit être détournée du centre pour éviter le muscle releveur de la paupière. Vous trouverez en annexe un schéma montrant comment placer ces injections. On peut s’attendre à l’amélioration des symptômes dans les 2 à 4 jours qui suivent l’injection, avec un effet maximal dans les 2 semaines.
Pour éviter la réapparition des symptômes, les injections sont répétées toutes les 12 semaines ou quand c’est utile, au cas par cas, toutefois sans dépasser la fréquence de 12 semaines.
Dans ces injections de rappel, si l’on considère la réponse au traitement initial insuffisante, la dose peut être augmentée à 60 unités par œil : 10 unités (0,05 ml) médialement et 20 unités (0,1 ml) latéralement, 80 unités : 20 unités (0,1 ml) médialement et 20 unités (0,1 ml) latéralement ou jusqu’à 120 unités : 20 unités (0,1 ml) médialement et 40 unités (0,2 ml) latéralement, au-dessus et en dessous de chaque œil, comme décrit précédemment. Des injections peuvent également être faites à d’autres endroits dans le muscle frontal, au-dessus des sourcils (1 et 2), si des spasmes y interfèrent avec la vision.
En cas de spasmes unilatéraux, le traitement doit se limiter à l’œil atteint. Les patients présentant des spasmes hémifaciaux doivent être traités de la même façon que les patients présentant des blépharospasmes unilatéraux. Les doses recommandées conviennent à l’adulte de tout âge ainsi qu’à la personne âgée.
Population pédiatrique
La sécurité et l’efficacité de Dysport n’ont pas été démontrées dans le traitement des blépharospasmes et des spasmes hémifaciaux chez les enfants.
Mode d’administration
Pour le traitement des blépharospasmes et des spasmes hémifaciaux, reconstituer Dysport à l’aide de 2,5 ml de chlorure de sodium à 0,9% pour obtenir une solution contenant 200 unités par ml.
Dysport est administré à l’aide d’une injection sous-cutanée, dans la partie médiane et dans la partie latérale de la jonction entre les zones préseptales et orbitales des muscles orbiculaires supérieurs et inférieurs de chaque œil.
Torticolis spasmodique
Posologie
Les doses recommandées pour un torticolis conviennent à l’adulte de tout âge, à condition que l’adulte ait un poids corporel normal et que sa masse musculaire au niveau de la nuque ne soit pas manifestement faible. Une dose plus faible peut être indiquée chez un patient présentant un sous-poids évident ou chez la personne âgée pouvant présenter une diminution de la masse musculaire.
La dose recommandée pour le traitement du torticolis spasmodique est de 500 unités par patient. Cette quantité doit être administrée au niveau des deux ou trois muscles les plus actifs de la nuque. Les injections sont généralement administrées au niveau du sterno-cléido-mastoïdien, du splénius capitis et du trapèze.
Pour les torticolis rotatoires : les 500 unités seront réparties comme suit : 350 unités dans le splénius capitis homolatéral par rapport à la direction de la rotation du menton/de la tête et 150 unités dans le sterno-cléido-mastoïdien controlatéral par rapport à la rotation.
Pour les latérocolis : les 500 unités seront réparties comme suit : 350 unités dans le splénius capitis homolatéral et 150 unités dans le sterno-cléido-mastoïdien homolatéral. En cas de relèvement de l’épaule, un traitement du trapèze et de l’angulaire de l’omoplate homolatéraux peut également s’avérer nécessaire, en fonction de l’hypertrophie visible du muscle ou des résultats électromyographiques. S’il s’avère nécessaire d’injecter 3 muscles, répartir les 500 unités comme suit : 300 unités dans le splénius capitis, 100 unités dans le sterno-cléido-mastoïdien et 100 unités dans le troisième muscle.
Pour les rétrocolis : les 500 unités seront réparties comme suit : 250 unités dans chaque splénius capitis. Des injections de façon bilatérale dans les splénius peuvent augmenter le risque de diminution de la force des muscles du cou.
Les autres formes de torticolis dépendent essentiellement de la connaissance du spécialiste et de l’EMG pour identifier et traiter les muscles les plus actifs.
L’EMG doit être utilisé de façon diagnostique dans toute forme de torticolis complexe, en cas de réévaluation après un échec des injections dans des cas non complexes et pour accompagner des injections dans des muscles profonds ou chez des patients en surpoids et dont des muscles du cou sont difficilement palpables.
Pour les injections suivantes, les doses peuvent être ajustées en fonction de l'effet clinique et des effets secondaires observés. Des doses comprises entre 250 et 1000 unités sont recommandées ; des doses plus élevées peuvent s’accompagner d’une augmentation des effets indésirables, principalement la dysphagie. La dose maximale administrée ne peut dépasser 1000 unités.
L'amélioration des symptômes du torticolis apparaît normalement en l’espace d’une semaine. Les injections peuvent être répétées toutes les 16 semaines environ ou selon les besoins afin de maintenir une réponse, mais pas plus fréquemment que toutes les 12 semaines.
Population pédiatrique
La sécurité et l’efficacité de Dysport n’ont pas été démontrées dans cette indication chez les enfants.
Mode d’administration
Dans le traitement du torticolis spasmodique, Dysport est reconstitué avec 1 ml de chlorure de sodium (0,9%) solution pour injection pour obtenir une solution contenant 500 unités par ml. En cas de traitement d’un torticolis spasmodique, Dysport doit être administré par voie intramusculaire, selon le mode d’administration indiqué ci-dessus.
Spasticité focale chez les enfants âgés de deux ans et plus
La déformation dynamique du pied en équin induite par la spasticité focale chez les patients présentant une infirmité motrice cérébrale
Posologie
Au cours du traitement initial et de la poursuite du traitement, la posologie doit être adaptée de manière individuelle et en fonction de la taille, du nombre et de la localisation des muscles atteints, de la gravité de la spasticité, de la présence d’une faiblesse musculaire locale, de la réponse du patient au traitement antérieur et/ou de ses antécédents d’effets indésirables probablement induits par des toxines botuliques.
La dose totale maximale de Dysport administrée par traitement ne peut pas dépasser 15 unités/kg pour les injections unilatérales au niveau des membres inférieurs, ou 30 unités/kg pour les injections bilatérales. De plus, la dose totale de Dysport par traitement ne peut pas dépasser 1 000 unités ou 30 unités/kg, selon la valeur la plus faible des deux. La dose totale administrée doit être répartie entre les différents muscles spastiques atteints du/des membre(s) inférieur(s). Si possible, la dose doit être répartie entre plusieurs sites d’injection dans un même muscle. La dose administrée par site d’injection ne peut pas dépasser 0,5 ml de Dysport. Voir tableau ci-dessous pour la posologie recommandée.
Muscle | Intervalle des doses recommandées par muscle par jambe (U/kg de poids corporel) | Nombre de sites d’injection par muscle |
Distal | ||
Muscles jumeaux | 5 à 15 U/kg | Maximum 4 |
Muscle soléaire | 4 à 6 U/kg | Maximum 2 |
Muscle jambier postérieur | 3 à 5 U/kg | Maximum 2 |
Dose totale | Maximum 15 U/kg/jambe | |
Même si la palpation permet de déterminer la localisation précise des sites d’injection, il est recommandé d’utiliser une technique complémentaire au cours de l’injection, notamment l’électromyographie, la stimulation électrique ou l’échoscopie.
Le traitement par Dysport doit être répété lorsque l’effet de l’injection précédente se dissipe, mais en respectant des intervalles d’au moins 12 semaines entre les traitements. Au cours des études cliniques, la plupart des patients nécessitaient un nouveau traitement toutes les 16 à 22 semaines. Chez certains patients, la réponse se maintenait plus longtemps et persistait jusqu’à 28 semaines. La sévérité et le type de spasticité musculaire au moment de la réinjection peuvent nécessiter des adaptations au niveau de la posologie de Dysport et des muscles à injecter.
Spasticité focale des membres supérieurs chez les patients pédiatriques présentant une infirmité motrice cérébrale
Posologie
Au cours des séances de traitement initiale et ultérieures, la posologie doit être adaptée de manière individuelle, en fonction de la taille, du nombre et de la localisation des muscles concernés, de la sévérité de la spasticité, de la présence d'une faiblesse musculaire locale, de la réponse du patient au traitement antérieur et/ou de ses antécédents d'effets indésirables liés à l'utilisation de toxines botuliques.
En cas d’injection unilatérale, la dose maximale de Dysport administrée par séance de traitement ne doit pas dépasser 16 U/kg ou 640 U, selon la valeur la plus faible. En cas d’injection bilatérale, la dose maximale de Dysport administrée par séance de traitement ne doit pas dépasser 21 U/kg ou 840 U, selon la valeur la plus faible.
La dose totale administrée doit être répartie entre les différents muscles spastiques atteints du/des membre(s) supérieur(s). La dose administrée par site d’injection ne doit pas dépasser 0,5 ml de Dysport. Voir tableau ci-dessous pour la posologie recommandée :
Posologie de Dysport par muscle chez les patients pédiatriques présentant une spasticité des membres supérieurs
Muscle | Intervalle des doses recommandées par muscle par membre supérieur (U/kg de poids corporel) | Nombre de sites d’injection par muscle |
Brachial | 3 à 6 U/kg | Maximum 2 |
Brachioradial | 1,5 à 3 U/kg | 1 |
Biceps brachial | 3 à 6 U/kg | Maximum 2 |
Rond pronateur | 1 à 2 U/kg | 1 |
Carré pronateur | 0,5 à 1 U/kg | 1 |
Fléchisseur radial du carpe | 2 à 4 U/kg | Maximum 2 |
Fléchisseur ulnaire du carpe | 1,5 à 3 U/kg | 1 |
Fléchisseur profond des doigts de la main | 1 à 2 U/kg | 1 |
Fléchisseur superficiel des doigts de la main | 1,5 à 3 U/kg | Maximum 4 |
Court fléchisseur du pouce/opposant du pouce | 0,5 à 1 U/kg | 1 |
Adducteur du pouce | 0,5 à 1 U/kg | 1 |
Dose totale | Maximum 16 U/kg par membre supérieur (et sans dépasser 21 U/kg en cas d’injection dans les deux membres supérieurs) | |
Même si la localisation exacte des sites d’injection peut être déterminée par la palpation, l'utilisation d'une technique de guidage pour l'injection, p. ex. électromyographie, stimulation électrique ou échographie, est recommandée pour viser avec précision les sites d’injection.
Le traitement par Dysport doit être répété si l'effet de l’injection précédente s’est réduit, mais en respectant un délai d’au moins 16 semaines après l’injection précédente. Au cours des études cliniques, le traitement a été répété dans les 16 à 28 semaines chez la plupart des patients ; chez certains patients, la durée de la réponse a néanmoins été plus longue, c.-à-d. d’au moins 34 semaines. Le degré et la localisation de la spasticité musculaire au moment de la nouvelle injection peuvent nécessiter une modification de la dose de Dysport et des muscles à injecter.
Spasticité focale associée à une déformation dynamique du pied et à une spasticité des membres supérieurs chez les patients pédiatriques présentant une infirmité motrice cérébrale
Posologie
Pour le traitement combiné de la spasticité des membres supérieurs et inférieurs chez les enfants âgés de 2 ans et plus, voir la rubrique posologie pour l’indication individuelle, c.-à-d. traitement de la spasticité focale des membres supérieurs ou de la déformation dynamique du pied chez les patients pédiatriques présentant une infirmité motrice cérébrale. La dose de Dysport à injecter en cas de traitement concomitant ne doit pas dépasser une dose totale par séance de traitement de 30 U/kg ou 1000 U, selon la valeur la plus faible.
La répétition du traitement combiné des membres supérieurs et inférieurs doit être envisagée si l'effet de l’injection précédente s’est réduit, mais en respectant un délai de 12 à 16 semaines après la séance de traitement précédente. Le moment optimal de la répétition du traitement doit être déterminé en fonction de l’évolution individuelle du patient et de sa réponse au traitement.
Mode d’administration
Au cours du traitement de la spasticité focale associée à une déformation dynamique du pied ou à une spasticité des membres supérieurs chez des enfants présentant une infirmité motrice cérébrale, ou en cas d’association des deux composantes de l’affection, Dysport est reconstitué avec une solution injectable de chlorure de sodium B.P. (0,9% p/v) (voir également rubrique 6.6) et est administré par injection intramusculaire de la manière décrite ci-dessus.
Traitement symptomatique de la spasticité focale des membres supérieurs chez l'adulte
Posologie
Lors du traitement initial et du traitement ultérieur, la posologie doit être adaptée individuellement, sur base du volume, du nombre et de la localisation des muscles concernés, de la sévérité de la spasticité, de la présence d'une faiblesse musculaire locale, de la réponse du patient au précédent traitement et/ou de ses antécédents d'effets secondaires suspectés lors de l'utilisation de toxines botuliques.
Dans les études cliniques, des doses de 500 U, 1000 U et 1500 U ont été réparties sur les muscles sélectionnés au cours d'une séance de traitement déterminée. Des doses supérieures à 1000 U et pouvant aller jusqu'à 1500 U peuvent être administrées lorsque les muscles de l'épaule sont également injectés. Voir le tableau ci-dessous pour la posologie recommandée.
Muscle | Dose de Dysport recommandée (U)1 | Nombre de sites d'injection par muscle2 |
Muscle grand palmaire (GP) | 100-200 U | 1 |
Muscle cubital antérieur (CA) | 100-200 U | 1 |
Muscle fléchisseur commun profond des doigts (FPD) | 100-200 U | 1 |
Muscle fléchisseur commun superficiel des doigts(FSD) | 150-250 U | 1 |
Muscle long fléchisseur propre du pouce | 100-200 U | Pas d'info spécifique |
Muscle adducteur du pouce | 25-50 U | Pas d'info spécifique |
Muscle brachial antérieur | 200-400 U | Pas d'info spécifique |
Muscle huméro-stylo-radial | 100-200 U | Pas d'info spécifique |
Muscle biceps brachial(BB) | 300-400 U | 2 |
Muscle rond pronateur | 100-200 U | Pas d'info spécifique |
Muscle triceps brachial (long chef) | 150-300 U | 1-2 |
Muscle grand pectoral | 150-300 U | 1-2 |
Muscle sous-scapulaire | 150-300 U | 1-2 |
Muscle grand dorsal | 150-300 U | 1-2 |
1La dose initiale doit être réduite s'il existe une raison de supposer que cette dose peut donner lieu à une faiblesse excessive des muscles ciblés, comme chez les patients chez qui les muscles ciblés sont petits, chez qui le biceps brachial ne doit pas être injecté ou chez les patients qui doivent recevoir des injections à de multiples niveaux. | ||
Habituellement, on n'administrera pas plus de 1 ml par endroit d'injection. Des doses supérieures à 1500 U n'ont pas été étudiées pour le traitement de la spasticité des membres supérieurs chez l'adulte.
Bien que la localisation précise des endroits d'injection puisse être déterminée par la palpation, l'utilisation d'une technique auxiliaire pour l'injection, comme l'électromyographie, la stimulation électrique ou l'échoscopie, est recommandée afin d'aider à localiser précisément les endroits d'injection.
Le traitement par Dysport doit être répété si l'effet de la précédente injection est réduit, mais pas plus souvent qu'une fois toutes les 12 semaines.
Dans les études cliniques, la plupart des patients ont été à nouveau traités dans les 12 à 16 semaines. Chez certains patients, la réponse a persisté plus longtemps, jusqu'à 20 semaines. La sévérité et la distribution de la spasticité musculaire au moment de la nouvelle injection peuvent nécessiter une modification de la dose de Dysport et des muscles à injecter.
On peut s'attendre à une amélioration clinique endéans une semaine.
Patients âgés (≥ 65 ans)
L'expérience clinique ne montre aucune différence, au plan de la réponse, entre les patients âgés et les patients adultes plus jeunes. En général, les patients âgés doivent être surveillés afin d'évaluer leur tolérance du complexe toxine botulique de type A – hémagglutinine, en raison de la fréquence plus élevée de maladies concomitantes et d'autres traitements médicamenteux.
Traitement symptomatique de la spasticité focale de l'articulation de la cheville chez l'adulte
(Traitement symptomatique de la spasticité focale des membres inférieurs chez l'adulte)
Posologie
Des doses de 1500 U maximum peuvent être administrées en intramusculaire au cours d'une seule séance de traitement. La posologie précise lors de la séance de traitement initiale et des séances suivantes doit être adaptée individuellement sur base de la taille et du nombre des muscles impliqués ainsi que de la sévérité de la spasticité, en tenant également compte de la présence d'une faiblesse musculaire locale et de la réponse du patient au précédent traitement. Toutefois, la dose totale ne peut pas dépasser 1500 U. D'une manière générale, on n'administrera pas plus de 1 ml en un seul site d'injection.
Muscle | Dose recommandée | Nombre de sites d'injection par muscle |
Distal | ||
Muscle soléaire | 300 – 550 U | 2 - 4 |
Gastrocnémien |
|
|
Chef médial | 100 – 450 U | 1 - 3 |
Chef latéral | 100 – 450 U | 1 - 3 |
Jambier postérieur | 100 – 250 U | 1 - 3 |
Fléchisseur commun des orteils | 50 – 200 U | 1 - 2 |
Court fléchisseur plantaire | 50 – 200 U | 1 - 2 |
Long fléchisseur propre du gros orteil | 50 – 200 U | 1 - 2 |
Court fléchisseur du gros orteil | 50 – 100 U | 1 - 2 |
Le degré et la distribution de la spasticité musculaire au moment de la nouvelle injection peuvent nécessiter une modification de la dose de Dysport et des muscles à injecter.
Bien que la localisation concrète des sites d'injection puisse être déterminée par palpation, l'utilisation de techniques de guidage pour l'injection, par ex. l'électromyographie, l'électrostimulation ou l'échographie, est recommandée pour aider à cibler précisément les sites d'injection.
Le traitement par Dysport sera répété toutes les 12 à 16 semaines ou plus, en fonction de la nécessité, sur base de la réapparition des symptômes cliniques, mais minimum 12 semaines après la précédente injection.
Membres supérieurs et inférieurs
Si un traitement des membres supérieurs et inférieurs est requis au cours de la même séance, la dose de Dysport à injecter dans chaque membre devra être adaptée en fonction des besoins individuels, sans toutefois dépasser une dose totale de 1500 U.
Mode d’administration (membres supérieurs et inférieurs)
Dans le traitement de la spasticité focale affectant les membres supérieurs et inférieurs, Dysport est reconstitué avec 1,0 ml de chlorure de sodium à 0,9%, solution pour injection, afin d’obtenir une solution contenant 500 unités par ml. Dysport doit être injecté par voie intramusculaire dans les muscles indiqués ci-dessus.
Hyperhidrose axillaire
Posologie
La dose initiale recommandée est de 100 unités par creux axillaire (aisselle). Lorsque l’effet escompté n’est pas atteint, on peut administrer jusqu’à 200 unités par aisselle lors des injections suivantes. La dose maximale administrée ne peut pas dépasser 200 unités par aisselle. La zone d’injection doit être préalablement déterminée au moyen du test à l’iode-amidon. Les deux aisselles doivent être lavées et désinfectées à fond. Ensuite, on administre des injections intradermiques en dix endroits différents, chaque endroit recevant 10 unités, donc 100 unités par aisselle. L’effet maximal doit être perceptible 2 semaines après l’injection. Dans la majorité des cas, la dose recommandée assurera un contrôle suffisant de la sécrétion sudorale pendant environ 48 semaines. Le moment pour administrer un traitement ultérieur doit être déterminé sur base individuelle, en fonction du moment où la sécrétion sudorale du patient réapparaît comme avant, mais en veillant à espacer les administrations d’au moins 12 semaines. Il existe des indications d’un effet cumulatif en cas de doses répétées, de sorte que le moment où chaque patient est traité doit être déterminé individuellement.
Population pédiatrique
La sécurité et l’efficacité de Dysport dans le traitement de l’hyperhidrose axillaire n’ont pas été démontrées chez les enfants.
Mode d’emploi
Dans le traitement de l’hyperhidrose axillaire, Dysport est reconstitué avec 2,5 ml de chlorure de sodium (0,9%) solution pour injection afin d’obtenir une solution contenant 200 unités par ml. Dans le traitement de l’hyperhidrose axillaire, Dysport est administré au moyen d’injections intradermiques pratiquées en dix endroits.
Incontinence urinaire résultant d’une hyperactivité neurogène du détrusor :
Posologie
La dose recommandée est de 600 U. En cas de réponse insuffisante ou chez les patients ayant une forme sévère de la maladie (p. ex. en fonction de la sévérité des signes et symptômes, et/ou des paramètres urodynamiques), une dose de 800 U peut être utilisée.
Dysport doit être administré aux patients qui réalisent régulièrement un sondage vésicale stérile intermittent (‘clean intermittent catheterisation’, CIC).
La dose totale administrée doit être divisée en 30 injections dans le détrusor, réparties de manière uniforme dans le muscle détrusor entier, en évitant le trigone. Dysport s’injecte au moyen d’un cystoscope flexible ou rigide et chaque injection doit être réalisée à une profondeur d’environ 2 mm, en délivrant 0,5 ml à chaque endroit. Pour l’injection finale, il faut injecter environ 0,5 ml de chlorure de sodium 0,9% (9 mg/ml) solution injectable afin de s’assurer que la totalité de la dose est bien administrée.
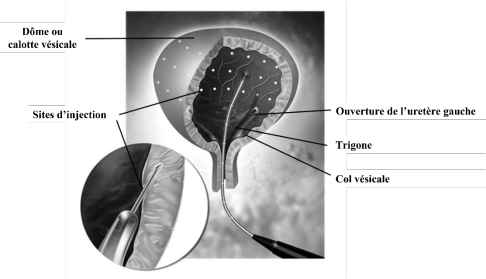
Une antibiothérapie prophylactique doit être instaurée conformément aux directives et protocoles locaux ou tel qu’utilisé dans les études cliniques (voir rubrique 5.1).
Le traitement par des anticoagulants doit être arrêté au moins 3 jours avant l’administration de Dysport et il ne doit être réinstauré que le lendemain de l’administration. Si cela s’avère médicalement indiqué, des héparines de bas poids moléculaire peuvent être administrées 24 heures avant l’administration de Dysport.
Avant l’injection, un anesthésique local pour l’urètre ou un gel lubrifiant peut être administré pour faciliter l’insertion confortable du cystoscope. Si requis, l’instillation intravésicale d’un anesthésique dilué (avec ou sans sédation) ou une anesthésie générale peut également être pratiquée. Si l’instillation d’un anesthésique local est pratiquée, la solution d’anesthésique local doit être drainée, puis la vessie doit être instillée (rincée) avec chlorure de sodium 0,9% (9 mg/ml) solution injectable et à nouveau drainée avant de poursuivre la procédure d’injection dans le détrusor.
Avant l’injection, la vessie doit être instillée avec une quantité suffisante de chlorure de sodium 0,9% (9 mg/ml) solution injectable pour obtenir une visualisation adéquate pour les injections.
Après l’administration de la totalité des 30 injections dans le détrusor, la chlorure de sodium 0,9% (9 mg/ml) solution injectable utilisée pour la visualisation de la paroi vésicale doit être drainée. Les patients doivent rester en observation pendant au moins les 30 minutes suivant l’injection.
L’apparition de l’effet survient généralement dans les 2 semaines suivant le début du traitement. Le traitement par Dysport doit être répété si l'effet de la précédente injection est réduit, mais pas plus souvent qu'une fois toutes les 12 semaines. Chez les patients traités par Dysport dans les études cliniques (voir rubrique 5.1), le délai médian jusqu’à un retraitement était compris entre 39 et 47 semaines, mais la durée de la réponse peut être plus longue car plus de 40% des patients n’ont reçu aucun retraitement au bout de 48 semaines.
Population pédiatrique
La sécurité et l’efficacité de Dysport dans le traitement d’incontinence urinaire résultant d’une hyperactivité neurogène du détrusor chez les enfants (moins de 18 ans) n’ont pas été démontrées.
Mode d’administration
Dysport s’administre au moyen d’injections dans le détrusor, de la manière décrite ci-dessus. Au cours du traitement de l’incontinence urinaire résultant d’une hyperactivité neurogène du détrusor, Dysport est reconstitué avec chlorure de sodium 0,9% (9 mg/ml) solution injectable pour obtenir 15 ml d’une solution contenant 600 ou 800 unités. Pour les instructions de reconstitution du médicament avant l’administration, voir rubrique 4.2.
4.3 Contre-indications
- Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
- Infection des voies urinaires au moment du traitement de l’incontinence urinaire résultant d’une hyperactivité neurogène du détrusor.
4.8 Effets indésirables
Très fréquents (≥1/10) ; fréquents (≥1/100, <1/10) ; peu fréquents (≥1/1000, <1/100) ; rares (≥1/10 000, <1/1000) ; très rares (<1/10 000).
En général
Environ 28,2% des patients traités par Dysport dans le cadre d’études cliniques ont développé un effet secondaire.
Les effets indésirables suivants ont été observés chez les patients traités pour toutes sortes d’indications comme un blépharospasme, des spasmes hémifaciaux, un torticolis, une spasticité suite à une encéphalopathie infantile ou un AVC, une hyperhidrose axillaire et d’incontinence urinaire résultant d’une hyperactivité neurogène du détrusor :
Des cas sporadiques d'hypersensibilité ont été rapportés.
Des effets indésirables résultant de la diffusion des effets de la toxine à des endroits éloignés du site d'injection ont été très rarement rapportés (faiblesse musculaire excessive, dysphagie, pneumonie d'aspiration pouvant être fatale).
Classes de systèmes d’organes | Fréquence | Effet indésirable |
Affections du système nerveux | Rare | Amyotrophie neuralgique |
Affections de la peau et du tissu sous-cutané | Peu fréquent | Prurit |
| Rare | Rash |
Troubles généraux et anomalies au site d’administration | Fréquent | Asthénie, fatigue, malaise grippal et douleur au site d’injection/ecchymose |
Blépharospasmes et spasmes hémifaciaux
Dans le traitement de blépharospasmes et spasmes hémifaciaux, les effets indésirables suivants ont été observés.
Classes de systèmes d’organes | Fréquence | Effet indésirable |
Affections du système nerveux | Fréquent | Paralysie faciale |
Peu fréquent | Paralysie du VIIème nerf crânien (nerf facial) | |
Affections oculaires | Très fréquent | Ptosis |
| Fréquent | Diplopie, sécheresse oculaire, larmoiement accru |
| Rare | Ophtalmoplégie |
Affections de la peau et du tissu sous-cutané | Fréquent | Gonflement des paupières |
| Rare | Entropion |
Des effets indésirables peuvent se produire suite à une injection profonde ou mal orientée de Dysport qui paralyse de façon temporaire des groupes musculaires voisins.
Torticolis spasmodique
Dans le traitement de torticolis spasmodique, les effets indésirables suivants ont été observés.
Classes de systèmes d’organes | Fréquence | Effet indésirable |
Affections du système nerveux | Fréquent | Maux de tête, sensations vertigineuses, parésie faciale |
Affections oculaires | Fréquent | Vision floue, diminution de l’acuité visuelle |
| Peu fréquent | Diplopie, ptosis |
Affections respiratoires, thoraciques et médiastinales | Fréquent | Dysphonie, dyspnée |
| Rare | Fausse déglutition |
Affections gastro-intestinales | Très fréquent | Dysphagie, sécheresse buccale |
| Peu fréquent | Nausée |
Affections musculosquelettiques et du tissu conjonctif | Très fréquent | Faiblesse des muscles |
| Fréquent | Douleurs du cou, douleurs musculosquelettiques, myalgies, douleurs aux membres, raideur musculosquelettique |
| Peu fréquent | Atrophie musculaire, troubles au niveau des mâchoires |
La dysphagie semble être liée à la dose et survient plus fréquemment après une injection dans le muscle sterno-cléido-mastoïdien. Une alimentation à base d’aliments mous peut s’avérer nécessaire jusqu’à disparition des symptômes.
Spasticité focale chez les patients pédiatriques âgés de deux ans et plus, présentant une infirmité motrice cérébrale
La déformation dynamique du pied en équin chez les patients ambulants, présentant une infirmité motrice cérébrale
Les effets indésirables suivants ont été observés chez des patients traités par Dysport pour une spasticité de la jambe secondaire à une infirmité motrice cérébrale.
Classes de systèmes d’organes | Fréquence | Effet indésirable |
Affections musculosquelettiques et du tissu conjonctif | Fréquent | Myalgies, faiblesse musculaire |
Affections du rein et des voies urinaires | Fréquent | Incontinence urinaire |
Troubles généraux et anomalies au site d’administration | Fréquent | Syndrome grippal, réactions au site d’administration (p. ex. douleur, érythème, contusion), démarche anormale, fatigue |
| Peu fréquent | Asthénie |
Lésions, intoxications et complications liées aux procédures | Fréquent | Chutes |
Spasticité des membres supérieurs chez les patients pédiatriques présentant une infirmité motrice cérébrale
Classes de systèmes d’organes | Fréquence | Effet indésirable |
Affections musculosquelettiques et du tissu conjonctif | Fréquent | Myalgies, Faiblesse musculaire |
Troubles généraux et anomalies au site d’administration | Fréquent | Syndrome grippal, fatigue, réactions au site d’administration (eczéma, contusion, douleur, gonflement, éruption cutanée) |
Peu fréquent | Asthénie | |
Affections de la peau et du tissu sous-cutané | Fréquent | Eruption cutanée |
Traitement concomitant d’une déformation dynamique du pied en équin et d’une spasticité des membres supérieurs chez les patients pédiatriques ambulants présentant une infirmité motrice cérébrale
On ne dispose d’aucune donnée issue d’études cliniques contrôlées par placebo ; selon les données existantes, le nombre d’effets indésirables liés au traitement n’est pas plus élevé pour des doses allant jusqu’à 30 U/kg ou 1 000 U, selon la valeur la plus faible, par comparaison au nombre observé au cours du traitement isolé des muscles des membres supérieurs ou des membres inférieurs.
Traitement symptomatique de la spasticité focale chez l'adulte
*membres supérieurs :
Dans le traitement de la spasticité du bras chez l’adulte après un accident vasculaire cérébral, les effets indésirables suivants ont été observés.
Classes de systèmes d’organes | Fréquence | Effet indésirable |
Troubles généraux et anomalies au site d’administration | Fréquent | Réactions à l'endroit de l'injection (par ex. douleur, érythème, œdème etc.), asthénie, fatigue, symptômes de type grippal |
Affections musculosquelettiques et du tissu conjonctif | Fréquent | Faiblesse au niveau du membre supérieur, douleurs musculosquelettiques, douleurs dans les extrémités |
Affections gastro-intestinales | Peu fréquent | Dysphagie* |
* La fréquence relative aux dysphagies est issue de l’analyse combinée des essais cliniques réalisés en ouvert. Aucun cas de dysphagie n’a été rapporté dans les études cliniques conduites en double aveugle.
*membres inférieurs :
Dans le traitement de la spasticité focale de l'articulation de la cheville chez l'adulte, les effets indésirables suivants ont été observés :
Classes de systèmes d’organes | Fréquence | Effet indésirable |
Troubles généraux et anomalies au site d'administration | Fréquent | Asthénie, fatigue, syndrome grippal, réactions au site d'injection (douleur, hématome, rash, prurit) |
Lésions, intoxications et complications liées aux procédures | Fréquent | Chute |
Affections musculosquelettiques et du tissu conjonctif | Fréquent | Faiblesse musculaire, myalgie |
Affections gastro-intestinales | Fréquent | Dysphagie |
Lors du traitement concomitant des membres supérieurs et inférieurs au moyen de Dysport à une dose totale de maximum 1500 U, aucun problème de sécurité n'a été observé autre que ceux attendus lors du traitement des seuls muscles du membre supérieur ou du membre inférieur.
Hyperhidrose axillaire
Dans le traitement de l’hyperhidrose axillaire, les effets indésirables suivants ont été observés.
Classes de systèmes d’organes | Fréquence | Effet indésirable |
Affections du système nerveux | Peu fréquent | Sensations vertigineuses, céphalées, paresthésies, contractions involontaires des muscles de la paupière |
Affections vasculaires | Peu fréquent | Bouffées vasomotrices |
Affections respiratoires, thoraciques et médiastinales | Fréquent | Dyspnée |
| Peu fréquent | Epistaxis |
Affections de la peau et du tissu sous-cutané | Fréquent | Transpiration compensatoire |
Affections musculosquelettiques et du tissu conjonctif | Fréquent | Douleurs de l’épaule, du haut du bras et du cou, myalgies dans l’épaule et le mollet |
Incontinence urinaire résultant d’une hyperactivité neurogène du détrusor
Classes de systèmes d’organes | Fréquence | Effet indésirable |
Infections et infestations | Fréquent | Infection des voies urinairesa,b |
| ||
Affections du système nerveux | Fréquent | Maux de tête |
| Peu fréquent | Hypoesthésie |
Affections gastro-intestinales | Fréquent | Constipation |
Affections musculosquelettiques et du tissu conjonctif | Peu fréquent | Faiblesse musculaire |
Affections du rein et des voies urinaires | Fréquent | Hématuriea |
Peu Fréquent | Rétention urinaire c | |
Affections des organes de reproduction et du sein | Fréquent | Dysfonction érectile |
Troubles généraux et anomalies au site d'administration | Fréquent | Pyrexi |
| Peu Fréquent | Douleur dans la vessiea |
Lésions, intoxications et complications liées aux procédures | Peu fréquent | Dysréflexie autonomea |
a peut être liée à la procédure
bAu cours des études pivots réalisées en double aveugle et contrôlées par placebo, une infection des voies urinaires a été signalée au cours des 2 premières semaines du traitement chez 4% des patients traités par Dysport et 6,2% des patients traités par placebo. Les infections des voies urinaires peuvent entraîner une inflammation du bassin rénal.
cpeut se produire si les patients ont un programme de cathétérisme inadéquat
Expériences post-commercialisation
Le profil des effets secondaires signalés à la firme depuis la commercialisation du produit reflète la pharmacologie du produit ainsi que les effets secondaires qui ont été observés lors des essais cliniques.
Classes de systèmes d’organes | Effet secondaire | Fréquence |
Affections du système immunitaire | Hypersensibilité | Fréquence indéterminée |
Affections du système nerveux | Hypoesthésie | Fréquence indéterminée |
Affections musculosquelettiques et du tissu conjonctif | Atrophie musculaire | Fréquence indéterminée |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé. www.afmps.be. Division Vigilance : Site internet: www.notifieruneffetindesirable.be, e-mail: adr@fagg-afmps.be.
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé. Site internet : www.guichet.lu/pharmacovigilance.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
IPSEN sa
Treurenberg 2 - 4 boîte 4
1000 Bruxelles
Belgique
8. NUMÉRO D’AUTORISATION DE MISE SUR LE MARCHÉ
BE180521
LU: 2002020015
- Numéro national 0312493: 1 flacon
- Numéro national 0312509: 2 flacons
10. DATE DE MISE À JOUR DU TEXTE
Date d’approbation : 01/2026
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 1374560 | DYSPORT PULV LYOPH SOL INJ 2FL 500U | M03AX01 | € 402,88 | - | Oui | - | - |
| 1389881 | DYSPORT PULV LYOPH SOL INJ 1FL 500U | M03AX01 | € 256,5 | € 232,36 | Oui | - | - |