ANNEXE I
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
![]() Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
1. DÉNOMINATION DU MÉDICAMENT
Tibsovo 250 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé pelliculé contient 250 mg d’ivosidenib.
Excipient(s) à effet notoire:
Chaque comprimé pelliculé contient du lactose monohydraté équivalent à 9,5 mg de lactose (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé (comprimé).
Comprimé pelliculé bleu de forme ovale, de 18 mm de longueur environ, gravé « IVO » sur une face et « 250 » sur l’autre face.
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
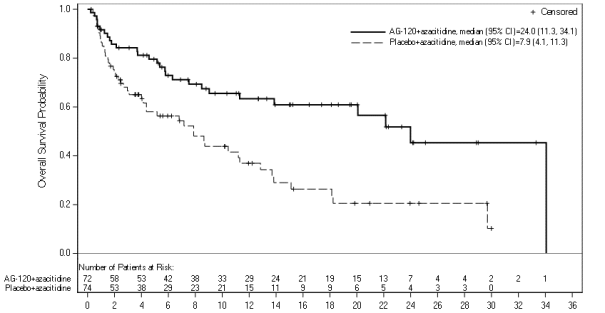
Tibsovo en association avec l'azacitidine est indiqué dans le traitement des patients adultes ayant une leucémie aiguë myéloïde (LAM) nouvellement diagnostiquée avec une mutation de l’isocitrate déshydrogénase 1 (IDH1) R132, non éligibles à la chimiothérapie d’induction standard (voir rubrique 5.1).
Tibsovo en monothérapie est indiqué dans le traitement des patients adultes ayant un cholangiocarcinome localement avancé ou métastatique avec une mutation IDH1 R132 et précédemment traités avec au moins une ligne de traitement systémique (voir rubrique 5.1).
4.2 Posologie et mode d’administration
Le traitement doit être instauré sous la supervision de médecins expérimentés dans l’utilisation des traitements anticancéreux.
Avant de prendre Tibsovo, la mutation de l’IDH1 R132 doit être confirmée au moyen d'un test diagnostique approprié.
Posologie
Leucémie aiguë myéloïde (LAM)
La dose recommandée est de 500 mg d’ivosidenib (2 comprimés de 250 mg) par voie orale une fois par jour.
Ivosidenib doit être commencé au jour 1 du cycle 1 en association avec l'azacitidine à 75 mg/m2 de surface corporelle, par voie intraveineuse ou sous-cutanée, une fois par jour aux jours 1 à 7 de chaque cycle de 28 jours. Au premier cycle de traitement, l’azacitidine doit être administrée à 100% de la dose. Il est recommandé que les patients soient traités pendant un minimum de 6 cycles.
Concernant la posologie et le mode d’administration de l’azacitidine, veuillez-vous référer à son information produit complète.
Le traitement doit être poursuivi jusqu’à la progression de la maladie ou jusqu’à ce que le traitement ne soit plus toléré par le patient.
Cholangiocarcinome
La dose recommandée est de 500 mg d’ivosidenib (2 comprimés de 250 mg) par voie orale une fois par jour.
Le traitement doit être poursuivi jusqu’à la progression de la maladie ou jusqu’à ce que le traitement ne soit plus toléré par le patient.
Oubli ou retard de la prise du traitement
Si une dose est oubliée ou n’est pas prise à l’heure habituelle, les comprimés doivent être pris dès que possible dans les 12 heures suivant la dose oubliée. Il ne faut pas prendre deux doses en moins de 12 heures. Les comprimés doivent être pris comme d’habitude le jour suivant.
Si une dose est vomie, aucun comprimé ne doit être pris en remplacement. Les comprimés doivent être pris comme d’habitude le jour suivant.
Précautions à prendre avant l’administration et surveillance
Un électrocardiogramme (ECG) doit être réalisé avant l’instauration du traitement. L’intervalle QT corrigé (QTc) de la fréquence cardiaque doit être inférieur à 450 ms avant l’initiation du traitement et en cas d’intervalle QT anormal, le bénéfice/risque de l’initiation d’ivosidenib doit être attentivement réévalué par le prescripteur. En cas de prolongation de l’intervalle QTc entre 480 ms et 500 ms, l’initiation du traitement par ivosidenib doit rester exceptionnelle et faire l’objet d’une surveillance rapprochée.
Un ECG doit être réalisé avant l’initiation du traitement, au moins une fois par semaine pendant les trois premières semaines de traitement puis mensuellement par la suite si l’intervalle QTc reste ≤ 480 ms. Les anomalies de l’intervalle QTc doivent être prises en charge rapidement (voir Tableau 1 et rubrique 4.4). En cas de symptomatologie évocatrice, un ECG doit être réalisé si cliniquement indiqué.
L’administration concomitante de médicaments connus pour allonger l’intervalle QTc ou d’inhibiteurs modérés ou puissants du CYP3A4 peut accroître le risque d’allongement de l’intervalle QTc et doit être évitée dans la mesure du possible pendant le traitement par Tibsovo. Les patients doivent être traités avec prudence et surveillés étroitement afin de détecter tout allongement de l’intervalle QTc s’il n’est pas possible d’utiliser une alternative appropriée. Un ECG doit être réalisé avant la co-administration, puis chaque semaine pendant au moins 3 semaines et si le tableau clinique le justifie (voir ci-dessous et rubriques 4.4, 4.5 et 4.8).
La numération formule sanguine complète et la biochimie sanguine doivent être évaluées avant l’initiation du traitement par Tibsovo, au moins une fois par semaine pendant le 1er mois de traitement, une fois toutes les deux semaines pendant le 2ème mois de traitement et à chaque consultation médicale pendant le traitement si cliniquement indiqué.
Modification de la dose en cas d’administration concomitante d’inhibiteurs puissants ou modérés du CYP3A4
Si la prise d’inhibiteurs puissants ou modérés du CYP3A4 ne peut être évitée, la dose recommandée d’ivosidenib doit être réduite à 250 mg (1 comprimé de 250 mg) une fois par jour. Si l’inhibiteur puissant ou modéré du CYP3A4 est arrêté, la dose d’ivosidenib doit être augmentée à 500 mg après au moins 5 demi-vies de l’inhibiteur du CYP3A4 (voir ci-dessus et rubriques 4.4 et 4.5).
Modifications de la posologie et recommandations de prise en charge des effets indésirables
Tableau 1 – Recommandations de modification de la posologie en cas d’effets indésirables | |
Effet indésirable | Mesure recommandée |
Syndrome de différenciation |
|
Leucocytose (nombre de globules blancs > 25 x 109/L ou augmentation absolue du nombre de globules blancs totaux > 15 x 109/L par rapport à la valeur initiale, voir rubriques 4.4 et 4.8) |
|
Allongement de l’intervalle QTc supérieur à 480 ms et jusqu’à 500 ms |
|
Allongement de l’intervalle QTc ˃ 500 ms |
|
Allongement de l’intervalle QTc avec des signes/symptômes d’arythmie ventriculaire menaçant le pronostic vital |
|
Autres effets indésirables de grade 3 ou plus |
|
Le grade 1 est léger, le grade 2 est modéré, le grade 3 est sévère, le grade 4 met en jeu le pronostic vital
Populations spécifiques
Patients âgés
Aucun ajustement posologique n’est requis pour les patients âgés (≥ 65 ans, voir rubriques 4.8 et 5.2). Aucune donnée n’est disponible chez les patients âgés de 85 ans ou plus.
Insuffisance rénale
Aucun ajustement posologique n’est nécessaire pour les patients présentant une insuffisance rénale légère (60 ≤ débit de filtration glomérulaire estimé [DFGe] < 90 ml/min/1,73 m²) ou modérée (30 ≤ DFGe ˂ 60 ml/min/1,73 m²). Aucune recommandation posologique n’a été établie pour les patients présentant une insuffisance rénale sévère (DFGe ˂ 30 ml/min/1,73 m²). Tibsovo doit être utilisé avec prudence chez les patients présentant une insuffisance rénale sévère et cette population de patients doit être étroitement surveillée (voir rubriques 4.4 et 5.2).
Insuffisance hépatique
Aucun ajustement posologique n’est nécessaire pour les patients présentant une insuffisance hépatique légère (classe A de Child-Pugh). Aucune recommandation posologique n’a été établie pour les patients présentant une insuffisance hépatique modérée ou sévère (classes B et C de Child-Pugh). Tibsovo doit être utilisé avec prudence chez les patients présentant une insuffisance hépatique modérée ou sévère et cette population de patients doit être étroitement surveillée (voir rubriques 4.4 et 5.2).
Population pédiatrique
La sécurité et l’efficacité de Tibsovo chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Voie orale.
Les comprimés doivent être pris une fois par jour à peu près à la même heure chaque jour. Les patients ne doivent pas manger dans les 2 heures qui précèdent et dans l’heure qui suit la prise des comprimés (voir rubrique 5.2). Les comprimés doivent être avalés entiers avec de l’eau.
Le patient doit être informé qu’il faut éviter de consommer du pamplemousse ou du jus de pamplemousse pendant le traitement (voir rubrique 4.5). Le patient doit être également informé qu’il ne faut pas avaler le dessicant en gel de silice présent dans le flacon des comprimés (voir rubrique 6.5).
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Administration concomitante d’inducteurs puissants du CYP3A4 ou de dabigatran (voir rubrique 4.5).
Syndrome du QT long congénital.
Antécédent familial de mort subite ou d’arythmie ventriculaire polymorphe.
Intervalle QT/QTc > 500 ms, quelle que soit la méthode de correction (voir rubriques 4.2 et 4.4).
4.8 Effets indésirables
Leucémie aiguë myéloïde nouvellement diagnostiquée en association avec l'azacitidine
Résumé du profil de sécurité
Les effets indésirables les plus fréquents ont été vomissements (40%), neutropénie (31%), thrombopénie (28%), allongement de l'intervalle QT à l’ECG (21%), insomnie (19%).
Les effets indésirables graves les plus fréquents ont été syndrome de différenciation (8%) et thrombopénie (3%).
Chez les patients traités par ivosidenib en association avec l'azacitidine, la fréquence d'arrêt du traitement par ivosidenib en raison d'effets indésirables a été de 6%. Les effets indésirables ayant conduit à l'arrêt du traitement étaient allongement de l'intervalle QT à l’ECG (1%), insomnie (1%), neutropénie (1%) et thrombopénie (1%).
La fréquence des interruptions de traitement par ivosidenib en raison d'effets indésirables a été de 35%. Les effets indésirables les plus fréquents ayant conduit à une interruption de traitement ont été neutropénie (24%), allongement de l'intervalle QT à l'ECG (7%), thrombopénie (7%), leucopénie (4%) et syndrome de différenciation (3%).
La fréquence des diminutions de la posologie d’ivosidenib en raison d'effets indésirables a été de 19%. Les effets indésirables ayant conduit à une diminution de la posologie ont été allongement de l'intervalle QT à l’ECG (10%), neutropénie (8%) et thrombopénie (1%).
Tableau des effets indésirables
Les fréquences des effets indésirables sont basées sur l'étude AG120-C-009 qui a inclus 72 patients ayant une LAM nouvellement diagnostiquée, randomisés et traités par ivosidenib (500 mg par jour) en association avec l'azacitidine. La durée médiane du traitement par Tibsovo a été de 8 mois (intervalle de 0,1 à 40,0 mois). Les fréquences des effets indésirables sont basées sur les fréquences des événements indésirables toutes causes confondues, pour lesquels une proportion de ces évènements peut avoir d'autres causes qu’ivosidenib, comme la maladie, d'autres médicaments ou des causes non reliées.
Les fréquences sont définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000). Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Tableau 2 – Effets indésirables rapportés chez les patients ayant une LAM nouvellement diagnostiquée et traités par ivosidenib en association avec l'azacitidine dans l'étude clinique AG120-C-009 (N=72) |
Classe de systèmes d’organes | Fréquence | Effets indésirables |
Affections hématologiques et du système lymphatique
Très fréquent
Syndrome de différenciation, Leucocytose, Thrombopénie, Neutropénie
Fréquent
Leucopénie
Affections psychiatriques
Très fréquent
Insomnie
Affections du système nerveux
Très fréquent
Céphalée, Sensation vertigineuse
Fréquent
Neuropathie périphérique
Affections gastro-intestinales
Très fréquent
Vomissement1
Fréquent
Douleur oropharyngée
Affections musculo-squelettiques et systémiques
Très fréquent
Extrémités douloureuses, Arthralgie, Dorsalgie
Investigations
Très fréquent
Allongement de l’intervalle QT à l’électrocardiogramme (ECG)
1 Terme regroupant vomissement et effort de vomissement.
Cholangiocarcinome localement avancé ou métastatique préalablement traité,
Résumé du profil de sécurité
Les effets indésirables les plus fréquents ont été : fatigue (43 %), nausées (42 %), douleur abdominale (35 %), diarrhée (35 %), appétit diminué (24 %), ascite (23 %), vomissements (23 %), anémie (19 %) et rash (15 %).
Les effets indésirables graves les plus fréquents ont été : ascite (2 %), hyperbilirubinémie (2 %) et ictère cholestatique (2 %).
Chez les patients traités par ivosidenib, la fréquence d’arrêt du traitement en raison d’effets indésirables a été de 2 %. Les effets indésirables ayant conduit à l’arrêt du traitement ont été l’ascite (1 %) et l’hyperbilirubinémie (1 %).
La fréquence d’interruption d'ivosidenib en raison d’effets indésirables a été de 16 %. Les effets indésirables les plus fréquents ayant conduit à une interruption du traitement ont été : hyperbilirubinémie (3 %), alanine aminotransférase augmentée (3 %), aspartate aminotransférase augmentée (3 %), ascite (2 %) et fatigue (2 %).
La fréquence des diminutions de la posologie d’ivosidenib en raison d’effets indésirables a été de 4 %. Les effets indésirables ayant entraîné une diminution de la posologie ont été un allongement de l’intervalle QT à l’ECG (3 %) et une neuropathie périphérique (1 %).
Tableau des effets indésirables
Les fréquences des effets indésirables sont basées sur l’étude AG120-C-005 qui a inclus 123 patients ayant un cholangiocarcinome localement avancé ou métastatique préalablement traité, randomisés et traités par 500 mg d’ivosidenib une fois par jour. La durée médiane du traitement par Tibsovo a été de 2,8 mois (intervalle de 0,1 à 45,1 mois ; moyenne (écart type [ET]) 6,7 [8,2] mois).
Les fréquences des effets indésirables sont basées sur les fréquences des évènements indésirables toutes causes confondues pour lesquels une proportion des évènements indésirables peut avoir d'autres causes qu’ivosidenib, comme la maladie, d'autres médicaments ou des causes non reliées.
Les fréquences sont définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000). Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre de gravité décroissante.
Tableau 3 – Effets indésirables observés chez des patients ayant un cholangiocarcinome localement avancé ou métastatique traités par ivosidenib dans l'essai clinique AG120-C-005 (N = 123) | ||
Classe de systèmes d’organes | Fréquence | Effets indésirables |
Affections hématologiques et du système lymphatique | Très fréquent | Anémie |
Troubles du métabolisme et de la nutrition | Très fréquent | Appétit diminué |
Affections du système nerveux | Très fréquent | Neuropathie périphérique |
Affections gastro-intestinales | Très fréquent | Ascite |
Affections hépatobiliaires | Fréquent | Ictère cholestatique |
Affections de la peau et du tissu sous-cutané | Très fréquent | Rash1 |
Troubles généraux et anomalies au site d’administration | Très fréquent | Fatigue |
Fréquent | Chute | |
Investigations | Très fréquent | Aspartate aminotransférase augmentée |
Fréquent | Allongement de l’intervalle QT à l’électrocardiogramme | |
1 Terme regroupant rash, rash maculo-papuleux, érythème, rash maculeux, dermite exfoliatrice généralisée, éruption d’origine médicamenteuse et hypersensibilité médicamenteuse | ||
Description de certains effets indésirables
Syndrome de différenciation chez les patients ayant une leucémie aiguë myéloïde (voir rubriques 4.2 et 4.4)
Dans l'essai AG120-C-009, parmi les 72 patients ayant une LAM nouvellement diagnostiquée et traités par Tibsovo en association à l’azacitidine, 14 % ont présenté un syndrome de différenciation Aucun patient n’a arrêté son traitement par ivosidenib en raison d’un syndrome de différenciation et l'interruption du traitement pour la prise en charge des signes/symptômes n'a été nécessaire que pour une minorité de patients (3 %). Parmi les 10 patients ayant eu un syndrome de différenciation, tous se sont rétablis après traitement ou après l’interruption de Tibsovo. Le délai médian d'apparition du syndrome de différenciation était de 20 jours. Le syndrome de différenciation est apparu dès le 3ème jour et jusqu'à 46 jours après l’initiation du traitement par ivosidenib en association.
Allongement de l’intervalle QTc (voir rubriques 4.2, 4.4 et 4.5)
Dans l'essai AG120-C-009, un allongement de l’intervalle QT à l’ECG a été observé chez 21 % des 72 patients ayant une LAM nouvellement diagnostiquée et traités par ivosidenib en association à l’azacitidine ; 11 % ont eu des réactions de grade 3 ou plus. D’après l’analyse des ECG, 15 % des patients traités avec ivosidenib en association à l’azacitidine, qui ont fait l’objet d’au moins une évaluation ECG après le début de l'essai, ont présenté un intervalle QTc ˃ 500 ms, 24 % ont présenté un allongement de l’intervalle QTc ˃ 60 ms par rapport à la valeur initiale. Un pourcent (1%) des patients a arrêté le traitement par ivosidenib en raison d’un allongement de l’intervalle QT à l’ECG, une interruption et une diminution de la posologie ont été nécessaires respectivement chez 7 % et 10 % des patients. Le délai médian de survenue d’un allongement de l’intervalle QT chez les patients traités par ivosidenib a été de 29 jours. L’allongement de l’intervalle QT à l’ECG est survenu dès le premier jour et jusqu’à 18 mois après le début du traitement.
Dans l'essai AG120-C-005, un allongement de l’intervalle QT à l’ECG a été observée chez 10 % des 123 patients ayant un cholangiocarcinome localement avancé ou métastatique traités par ivosidenib en monothérapie ; 2 % ont présenté des réactions de grade 3 ou plus. D’après l’analyse des ECG, 2 % des patients ont présenté un intervalle QTc ˃ 500 ms et 5 % un allongement du QTc initial ˃ 60 ms par rapport à la valeur initiale. Une diminution de la posologie du traitement pour prendre en charge les signes/symptômes a été nécessaire pour 3 % des patients. Le délai médian de survenue d’un l’allongement de l’intervalle QT chez les patients traités par ivosidenib en monothérapie a été de 28 jours. L’allongement de l’intervalle QT à l’ECG est survenu dès le premier jour et jusqu’à 23 mois après l’initiation du traitement.
Populations spécifiques
Insuffisance hépatique
La sécurité d’emploi et l’efficacité d’ivosidenib n’ont pas été établies chez les patients présentant une insuffisance hépatique modérée ou sévère (classes B et C de Child-Pugh). Une tendance à une incidence plus élevée d’effets indésirables a été observée chez les patients présentant une insuffisance hépatique légère (Classe A de Child-Plugh) (voir rubriques 4.2 et 5.2).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration.
Pour la Belgique et le Luxembourg (voir détails ci-dessous).
Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance
Site internet : www.notifieruneffetindesirable.be
E-mail : adr@fagg-afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
ou Division de la pharmacie et des médicaments
de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHÉ
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
France
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/23/1728/001
10. DATE DE MISE À JOUR DU TEXTE
08/2024
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu/.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 4696035 | TIBSOVO 250MG COMP PELL 60 | - | € 13800 | Oui | - | - |