![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
1. DÉNOMINATION DU MÉDICAMENT
Bylvay 200 microgrammes, gélules
Bylvay 400 microgrammes, gélules
Bylvay 600 microgrammes, gélules
Bylvay 1200 microgrammes, gélules
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Bylvay 200 μg, gélules
Chaque gélule contient de l’odévixibat sesquihydraté équivalent à 200 microgrammes d’odévixibat.
Bylvay 400 μg, gélules
Chaque gélule contient de l’odévixibat sesquihydraté équivalent à 400 microgrammes d’odévixibat.
Bylvay 600 μg, gélules
Chaque gélule contient de l’odévixibat sesquihydraté équivalent à 600 microgrammes d’odévixibat.
Bylvay 1200 μg, gélules
Chaque gélule contient de l’odévixibat sesquihydraté équivalent à 1200 microgrammes d’odévixibat.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Gélule
Bylvay 200 μg, gélules
Gélule de taille 0 (21,7 mm × 7,64 mm) composée d’une coiffe opaque ivoire et d’un corps opaque blanc ; portant l’inscription à l’encre noire « A200 ».
Bylvay 400 μg, gélules
Gélule de taille 3 (15,9 mm × 5,82 mm) composée d’une coiffe opaque orange et d’un corps opaque blanc ; portant l’inscription à l’encre noire « A400 ».
Bylvay 600 μg, gélules
Gélule de taille 0 (21,7 mm × 7,64 mm) composée d’une coiffe et d’un corps opaques ivoire ; portant l’inscription à l’encre noire « A600 ».
Bylvay 1200 μg, gélules
Gélule de taille 3 (15,9 mm × 5,82 mm) composée d’une coiffe et d’un corps opaques orange ; portant l’inscription à l’encre noire « A1200 ».
4. INFORMATIONS CLINIQUES
4.1 Indications thérapeutiques
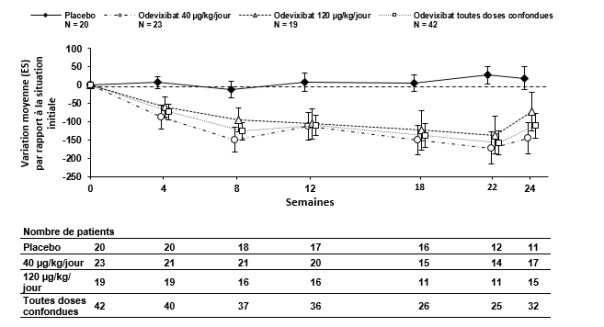
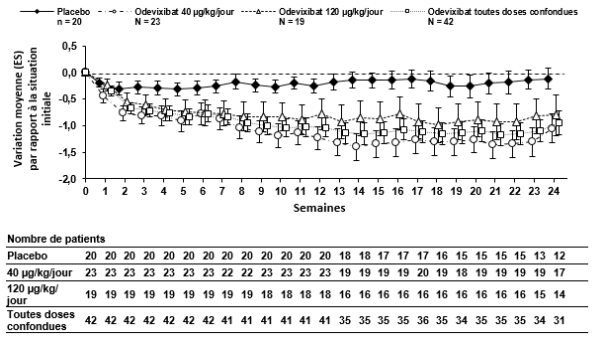
Bylvay est indiqué dans le traitement de la cholestase intrahépatique progressive familiale (PFIC pour Progressive Familial Intrahepatic Cholestasis) chez les patients âgés de 6 mois ou plus (voir rubriques 4.4 et 5.1).
4.2 Posologie et mode d'administration
Le traitement doit être instauré et supervisé par des médecins expérimentés dans la prise en charge de la PFIC.
Posologie
La dose recommandée d’odévixibat est de 40 μg/kg administrée par voie orale une fois par jour le matin. L’odévixibat peut être pris avec ou sans aliments.
Le tableau 1 indique le dosage et le nombre de gélules qui doivent être prises quotidiennement en fonction du poids corporel pour obtenir une dose approximative de 40 μg/kg/jour.
Tableau 1: Nombre de gélules de Bylvay nécessaires pour atteindre la dose nominale de 40 μg/kg/jour
Poids corporel (kg) | Nombre de gélules de 200 μg |
| Nombre de gélules de 400 μg |
4 à < 7,5 | 1 | ou | Sans objet |
7,5 à < 12.5 | 2 | ou | 1 |
12,5 à < 17,5 | 3 | ou | Sans objet |
17,5 à < 25,5 | 4 | ou | 2 |
25,5 à < 35,5 | 6 | ou | 3 |
35,5 à < 45,5 | 8 | ou | 4 |
45,5 à < 55,5 | 10 | ou | 5 |
≥ 55,5 | 12 | ou | 6 |
La concentration/le nombre de gélules en gras est recommandé(e) en fonction de la facilité d’administration prévue.
Augmentation de la dose
Après l’instauration du traitement par l’odévixibat, la diminution du prurit et la réduction des taux sériques d’acides biliaires se fait de façon progressive chez certains patients. Si une réponse clinique adéquate n’a pas été obtenue après 3 mois de traitement continu, la dose peut être augmentée à 120 μg/kg/jour (voir rubrique 4.4).
Le tableau 2 indique le dosage et le nombre de gélules qui doivent être prises quotidiennement en fonction du poids corporel pour obtenir une dose approximative de 120 μg/kg/jour, avec une dose quotidienne maximale de 7200 μg par jour.
Tableau 2: Nombre de gélules de Bylvay nécessaires pour atteindre la dose nominale de 120 μg/kg/jour
Poids corporel (kg) | Nombre de gélules de 600 μg |
| Nombre de gélules de 1200 μg |
4 à < 7,5 | 1 | ou | Sans objet |
7,5 à < 12,5 | 2 | ou | 1 |
12,5 à < 17,5 | 3 | ou | Sans objet |
17,5 à < 25,5 | 4 | ou | 2 |
25,5 à < 35,5 | 6 | ou | 3 |
35,5 à < 45,5 | 8 | ou | 4 |
45,5 à < 55,5 | 10 | ou | 5 |
≥ 55,5 | 12 | ou | 6 |
La concentration/le nombre de gélules en gras est recommandé(e) en fonction de la facilité d’administration prévue.
Un traitement alternatif doit être envisagé chez les patients pour lesquels aucun bénéfice thérapeutique ne peut être établi après 6 mois de traitement quotidien continu par l’odévixibat.
Doses oubliées
En cas d’oubli d’une dose d’odévixibat, le patient doit prendre la dose oubliée dès que possible, sans excéder une dose par jour.
Populations particulières
Patients présentant une insuffisance rénale
Il n’existe pas de données cliniques disponibles pour l’utilisation de l’odévixibat chez les patients présentant une insuffisance rénale modérée ou sévère ou une insuffisance rénale au stade terminal (IRST) nécessitant une hémodialyse (voir rubrique 5.2). Cependant, en raison de l’excrétion rénale négligeable, aucun ajustement de la dose n’est nécessaire pour les patients présentant une insuffisance rénale légère ou modérée.
Patients présentant une insuffisance hépatique
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance hépatique légère ou modérée (voir rubriques 5.1 et 5.2). L'odévixibat n'a pas été suffisamment étudié chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C). En raison de la faible absorption, aucun ajustement de dose n'est nécessaire cependant une surveillance supplémentaire des effets indésirables peut être justifiée chez ces patients lorsque l’odévixibat est utilisé (voir rubrique 4.4).
Population pédiatrique
La sécurité et l’efficacité de l’odévixibat chez les enfants âgés de moins de 6 mois n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Bylvay est utilisé par voie orale. À prendre avec ou sans aliments le matin (voir rubrique 5.2).
Les gélules de plus grande taille, de 200 μg et 600 μg, sont destinées à être ouvertes et saupoudrées sur les aliments ou dans une boisson mais elles peuvent aussi être avalées entières.
Les gélules de plus petite taille, de 400 μg et 1200 μg, sont destinées à être avalées entières mais peuvent aussi être ouvertes et saupoudrées sur les aliments ou dans une boisson.
Si la gélule doit être avalée entière, il convient d’informer le patient de la prendre avec un verre d’eau, le matin.
Dans le cas où les gélules sont ouvertes et saupoudrées sur des aliments semi-solides, le patient doit suivre les instructions suivantes :
- Déposer une petite quantité (30 ml ou 2 cuillères à soupe) d’aliments semi-solides (yaourt, compote de pommes, porridge aux flocons d’avoine, purée de bananes, purée de carottes, crème dessert au chocolat ou riz au lait) dans un bol. Les aliments doivent être à une température inférieure ou égale à la température ambiante.
- Tenir la gélule horizontalement par les deux extrémités, tourner les deux parties dans les sens opposés et tirer pour faire tomber les granulés dans le bol d’aliments semi-solides. La gélule doit être légèrement tapotée pour s’assurer que tous les granulés en sont extraits.
- Répéter l’étape précédente si la dose nécessite plus d’une gélule.
- Mélanger délicatement les granulés aux aliments semi-solides avec une cuillère.
- Administrer la totalité de la dose immédiatement après avoir mélangé. Ne pas conserver le mélange en vue d’une utilisation ultérieure.
- Boire un verre d’eau après la prise du médicament.
- Jeter les enveloppes des gélules vides.
Dans le cas où les gélules sont ouvertes et saupoudrées dans une boisson, la personne qui administre le médicament devra suivre les instructions suivantes :
- Tenir la gélule horizontalement par les deux extrémités, tourner les deux parties dans les sens opposées et tirer pour faire tomber les granulés dans un petit récipient destiné au mélange. La gélule doit être légèrement tapotée pour s'assurer que tous les granulés en sont extraits.
- Répéter l'étape précédente si la dose nécessite plus d'une gélule.
- Ajouter 1 cuillère à café (5 ml) d'une boisson adaptée à l'âge (par exemple, du lait maternel, du lait maternisé ou de l'eau). Laisser reposer les granulés dans la boisson pendant environ 5 minutes pour permettre un mouillage complet (les granulés ne se dissolvent pas).
- Après 5 minutes, plonger complètement l'embout de la seringue orale dans le récipient du mélange. Tirer lentement le piston de la seringue vers le haut pour aspirer le mélange boisson/granulés dans la seringue. Pousser doucement le piston vers le bas pour faire descendre le mélange boisson/granulés dans le récipient du mélange. Répéter cette opération 2 à 3 fois pour assurer un mélange complet des granulés dans la boisson (les granulés ne se dissolvent pas).
- Aspirer la totalité du contenu du récipient dans la seringue en tirant sur le piston de la seringue.
- Placer l'embout de la seringue à l'avant de la bouche de l'enfant, entre la langue et le côté de la bouche, puis pousser doucement le piston vers le bas pour extraire le mélange boisson/granulés entre la langue de l'enfant et le côté de la bouche. Ne pas faire gicler le mélange boisson/granulés au fond de la gorge de l'enfant, car cela pourrait provoquer un haut-le-cœur ou un étouffement.
- S'il reste du mélange boisson/granulés dans le récipient, répéter l'étape précédente jusqu'à ce que la totalité de la dose ait été administrée. Le mélange ne doit pas être conservé en vue d'une utilisation ultérieure.
- Après la prise du médicament, faire boire du lait maternel, de lait maternisé ou une autre boisson adaptée à l'âge de l'enfant.
- Jeter toutes les enveloppes gélules vides.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.8 Effets indésirables
Résumé du profil de sécurité
L’effet indésirable le plus fréquemment rapporté a été la diarrhée (32,2 %). Les autres effets indésirables rapportés étaient des augmentations légères à modérées des taux sanguins de bilirubine (24,8 %), d’ALAT (14 %) et d’ASAT (9,1 %), des vomissements (16,5 %), des douleurs à l’estomac (11,6 %) et des diminutions des taux de vitamine D (11 %) et E (5%).
Tableau récapitulatif des effets indésirables
Le tableau présente les effets indésirables identifiés lors d’essais cliniques menés chez des patients atteints de PFIC âgés de 4 mois à 25 ans (âge médian de 3 ans et 7 mois).
Les effets indésirables sont classés par classe de systèmes d’organes en appliquant les conventions suivantes : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), et fréquence indéterminée (ne peut pas être estimée sur la base des données disponibles).
Tableau 3: Fréquence des effets indésirables chez les patients atteints de PFIC
Classe de systèmes d’organes selon MedDRA | Fréquence | Effet indésirable |
Affections gastro-intestinales | Très fréquent | diarrhéea, |
Affections hépatobiliaires | Très fréquent | bilirubine sanguine augmentée, |
Fréquent | hépatomégalie, | |
Troubles du métabolisme et de la nutrition | Très fréquent | déficit en vitamine D |
Fréquent | déficit en vitamine E |
a Sur la base de la fréquence combinée de la diarrhée, de la diarrhée hémorragique et des selles molles
b y compris douleur abdominale haute et douleur abdominale basse
ALAT = alanine aminotransférase
ASAT = aspartate aminotransférase
Description de certains effets indésirables
Effets indésirables gastro-intestinaux
Dans les essais cliniques, l'effet indésirable gastro-intestinal le plus fréquent était la diarrhée. Les effets indésirables de type diarrhée, diarrhée hémorragique et selles molles ont été de courte durée, la plupart des effets ayant duré au plus 5 jours. La plupart des cas de diarrhée étaient d’intensité légère à modérée et sans gravité. Pour cause de diarrhée, des cas de réduction de dose, d'interruption ou d'arrêt du traitement ont été rapportés chez quelques patients nécessitant une hydratation par voie intraveineuse ou orale (voir rubrique 4.4).
Les autres troubles gastro-intestinaux fréquemment rapportés étaient des vomissements et des douleurs abdominales (y compris des douleurs abdominales hautes et basses), tous sans gravité, légers à modérés et ne nécessitant généralement pas d'adaptation de dose.
Affections hépatobiliaires
Les effets indésirables hépatiques les plus fréquents étaient une augmentation de la bilirubine sanguine, des ASAT et des ALAT. La majorité de ces effets indésirables étaient de sévérité légère à modérée. Des interruptions de traitement dues à des augmentations des tests de la fonction hépatique ont été observées chez des patients atteints de PFIC et traités par l'odévixibat. La plupart des excursions des valeurs d'ALAT, d'ASAT et de bilirubine étaient également dues à la maladie sous-jacente, ainsi qu'à des maladies virales ou infectieuses concomitantes intermittentes, fréquentes à l'âge des patients. De ce fait, il est recommandé de surveiller les tests de la fonction hépatique (voir rubrique 4.4).
Troubles du métabolisme et de la nutrition
En raison de la diminution de la libération des acides biliaires dans l'intestin et d'une malabsorption, les patients atteints de PFIC présentent un risque de carence en vitamines liposolubles (voir rubrique 4.4). Des réductions des taux de vitamines ont été observées au cours d'un traitement à long terme par l'odévixibat ; la majorité de ces patients étaient répondeurs à une supplémentation vitaminique appropriée. Ces effets étaient d'intensité légère et n'ont pas conduit à l'arrêt du traitement par l'odévixibat.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé. www.afmps.be. Division Vigilance : Site internet: www.notifieruneffetindesirable.be, e-mail: adr@fagg-afmps.be.
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé. Site internet : www.guichet.lu/pharmacovigilance.
7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
Ipsen Pharma
70 rue Balard
75015 Paris
France
8. NUMÉRO(S) D'AUTORISATION DE MISE SUR LE MARCHÉ
EU/1/21/1566/001
EU/1/21/1566/002
EU/1/21/1566/003
EU/1/21/1566/004
10. DATE DE MISE À JOUR DU TEXTE
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 4624292 | BYLVAY 200MCG CAPS 30 | A05AX05 | - | - | Oui | - | - |
| 4624300 | BYLVAY 400MCG CAPS 30 | A05AX05 | - | - | Oui | - | - |
| 4624318 | BYLVAY 600MCG CAPS 30 | A05AX05 | - | - | Oui | - | - |
| 4624326 | BYLVAY 1200MCG CAPS 30 | A05AX05 | - | - | Oui | - | - |