RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT VÉTÉRINAIRE
Ficoxil 227 mg comprimés à croquer pour chiens.
4. INFORMATIONS CLINIQUES
4.2 Indications d’utilisation, en spécifiant les espèces cibles
Soulagement de la douleur et de l’inflammation associées à l’arthrose chez le chien.
Soulagement de la douleur post-opératoire et de l’inflammation associée à la chirurgie des tissus mous, à la chirurgie orthopédique et à la chirurgie dentaire chez le chien.
4.3 Contre-indications
Ne pas utiliser chez les chiennes gestantes ou en lactation.
Ne pas utiliser chez les animaux âgés de moins de 10 semaines ou d’un poids inférieur à 3 kg.
Ne pas utiliser chez des animaux présentant un saignement gastro-intestinal, une dyscrasie sanguine ou des troubles hémorragiques.
Ne pas utiliser en association avec des corticostéroïdes ou d’autres anti-inflammatoires non stéroïdiens
(AINS).
Ne pas utiliser en cas d’hypersensibilité connue à la substance active ou à l’un des excipients.
4.8 Interactions médicamenteuses et autres formes d’interactions
Un traitement préalable par d’autres anti-inflammatoires peut entraîner l’apparition ou l’aggravation d’effets indésirables. Il est donc recommandé d’observer une période de 24 heures sans traitement avant de commencer le traitement avec le produit. La durée de cette période de transition doit être adaptée en fonction des propriétés pharmacocinétiques des produits utilisés précédemment.
Ne pas administrer le produit simultanément avec d’autres AINS ou des glucocorticoïdes. Une ulcération du tractus gastro-intestinal peut être exacerbée par les corticostéroïdes chez les animaux à qui des produits anti-inflammatoires non-stéroïdiens ont été administrés.
Un traitement simultané avec des molécules ayant un effet sur le flux sanguin rénal, telles que les diurétiques ou les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA), doit faire l’objet d’un suivi clinique. Toute association avec des produits potentiellement néphrotoxiques doit être évitée en raison d’un risque accru de toxicité rénale. Les produits anesthésiques pouvant affecter la perfusion
rénale, un apport liquidien parentéral doit être envisagé pendant l’opération afin de réduire de potentielles
complications rénales lors de l’utilisation d’AINS en péri-opératoire.
L’utilisation simultanée d’autres principes actifs fortement liés aux protéines peut entraîner une compétition avec le firocoxib sur les sites de liaison, et avoir par conséquent des effets toxiques.
4.9 Posologie et voie d’administration
Voie orale. Arthrose :
Administrer 5 mg firocoxib/kg de poids vif en une fois par jour selon le tableau ci-dessous.
La durée du traitement varie selon la réponse observée. Comme la durée des études de terrain était
limitée à 90 jours, la mise en place d’un traitement plus long devrait être évaluée avec attention et faire l’objet d’un suivi vétérinaire régulier.
Soulagement de la douleur post-opératoire :
Administrer une dose quotidienne de 5 mg firocoxib/kg de poids vif selon le tableau ci-dessous, jusqu’à 3 jours si nécessaire. La première dose est administrée environ 2 heures avant l’opération.
Après une chirurgie orthopédique et suivant la réponse observée, le traitement peut être poursuivi après les 3 premiers jours suivant la même posologie quotidienne et laissé au jugement du vétérinaire traitant.
Le tableau suivant est destiné à servir de guide pour l'administration du médicament vétérinaire à la dose recommandée.
| Nombre de comprimés par présentation |
| |
57 mg | 227 mg | ||
3,0 – 5,5 | ½ |
| 5,2 – 9,5 |
5,6 – 7,5 | ¾ |
| 5,7 – 7,6 |
7,6 – 10 | 1 ou ¼ | 5,7 – 7,5 | |
10,1 – 13 | 1 ¼ |
| 5,5 – 7,1 |
13,1 – 16 | 1 ½ |
| 5,3 – 6,5 |
16,1 – 18,5 | 1 ¾ |
| 5,4 – 6,2 |
18,6 – 22,5 |
| ½ | 5,0 – 6,1 |
22,6 – 34 |
| ¾ | 5,0 – 7,5 |
34,1 – 45 |
| 1 | 5,0 – 6,7 |
45,1 – 56 |
| 1 ¼ | 5,1 – 6,3 |
56,1 – 68 |
| 1 ½ | 5,0 – 6,1 |
68,1 – 79 |
| 1 ¾ | 5,0 – 5,8 |
79,1 – 90 |
| 2 | 5,0 – 5,7 |
![]()
![]()
![]()
![]() = ¼ de comprimé = ½ comprimé = ¾ de comprimé = 1 comprimé
= ¼ de comprimé = ½ comprimé = ¾ de comprimé = 1 comprimé
Les comprimés peuvent être divisés en 2 à 4 fractions égales pour permettre un ajustement précis de la dose.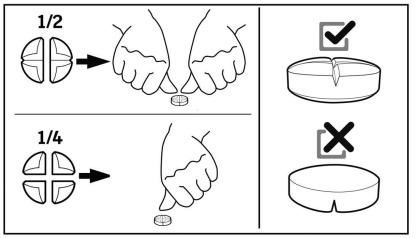
Les comprimés peuvent être administrés avec ou sans nourriture.
4.11 Temps d’attente
Sans objet.